L’article suivant a pour but de donner un aperçu des symptômes non moteurs (SNM) les plus courants de la maladie de Parkinson, de leur diagnostic et de leur traitement, d’autant plus que certains peuvent être traités et que leur amélioration a un impact considérable sur la qualité de vie des patients. L’apathie peut répondre à un traitement dopaminergique. En cas de dépression, il convient de traiter en premier lieu par un traitement dopaminergique, puis de préférence par des agonistes dopaminergiques ayant une affinité pour le récepteur D3. Le traitement des psychoses et des troubles du contrôle des impulsions comprend d’abord la réduction des médicaments responsables. La démence peut être influencée positivement par un traitement avec des inhibiteurs de la cholinestérase. La dopamine jouant un rôle dans le cycle veille-sommeil, les troubles du sommeil peuvent également répondre à un traitement dopaminergique. L’optimisation et l’utilisation d’analgésiques permettent de soulager la douleur. La stimulation cérébrale profonde peut également améliorer les symptômes non moteurs.
Les symptômes non moteurs (SNM) sont présents chez presque tous les patients au cours de la maladie de Parkinson [1]. Il s’agit d’un large éventail de symptômes qui réduisent souvent la qualité de vie plus que les symptômes moteurs et auxquels les personnes concernées, les soignants et les médecins n’accordent souvent pas suffisamment d’attention [2, 3]. Par conséquent, ils sont également sous-diagnostiqués et sous-traités, certains des symptômes pouvant être considérés comme des effets indésirables du traitement dopaminergique.
En général, les symptômes non moteurs sont plus fréquents dans la maladie de Parkinson avancée, mais certains comme l’hyposmie, les troubles du sommeil paradoxal ou encore la constipation et la dépression peuvent précéder de quelques années la maladie de Parkinson motrice [4]. Il est désormais bien établi que les NMS, comme la dépression ou les troubles du sommeil, mais surtout le nombre total de NMS, réduisent considérablement la qualité de vie des patients atteints de la maladie de Parkinson [3, 4]. La physiopathologie est complexe et il est possible de distinguer les symptômes dopaminergiques et non dopaminergiques, les connexions sérotoninergiques et noradrénergiques sont également probablement impliquées. Selon le concept initié par Braak et ses collaborateurs sur la base d’autopsies d’une pathologie à corps de Lewy ascendante en six étapes, commençant dans le bulbe olfactif et les noyaux inférieurs du tronc cérébral [5], certains NMS semblent pouvoir être expliqués comme des symptômes prémoteurs (Fig. 1).

La détection histologique de l’α-synucléine dans les noyaux parasympathiques sacrés, les ganglions sympathiques et dans les plexus nerveux entériques soutient également l’hypothèse d’une pathologie ascendante, mais aussi systémique. La triade classique de symptômes moteurs peut être attribuée aux stades trois et quatre avec implication de la substantia nigra.
Le tableau 1 donne un aperçu du large éventail des NEM.

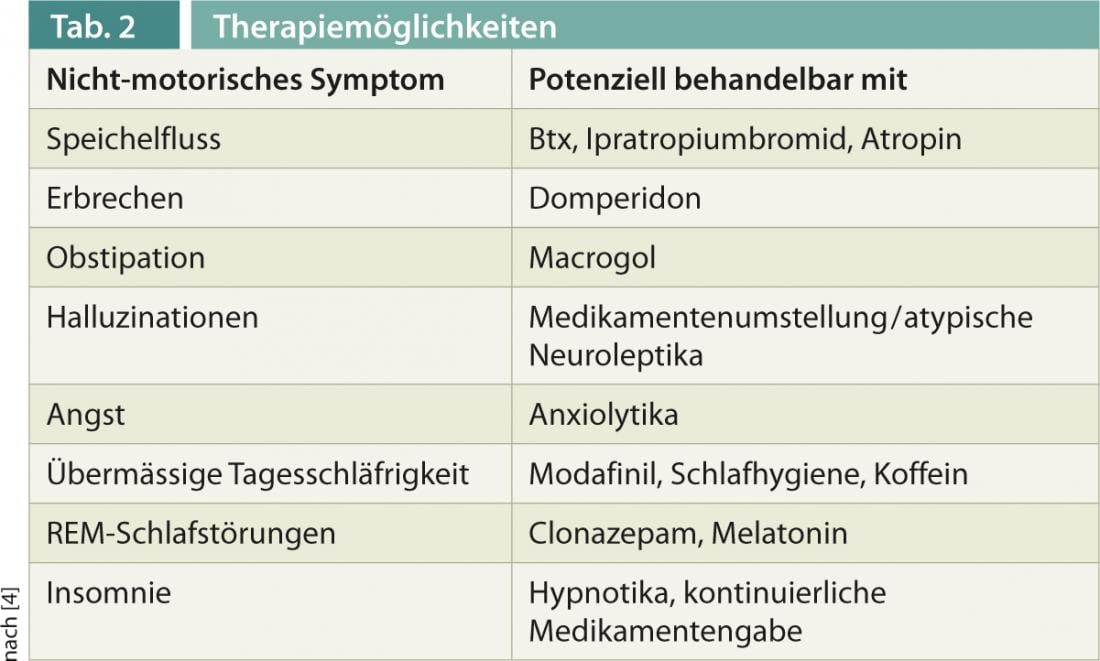
Pour l’exploration et la documentation du NMS, différentes échelles se sont établies ces dernières années, comme l’échelle des symptômes non moteurs (NMSS), ou des questionnaires pour des questions ciblées comme l’échelle de la maladie de Parkinson en sommeil (PDSS-2). Pour certains symptômes, il existe désormais des thérapies bien établies, présentées ci-dessous et également dans le tableau 2 .
Apathie, dépression et psychose
Les symptômes neuropsychiatriques ont un impact important sur la qualité de vie, les patients atteints de la maladie de Parkinson non dominés par le tremblement étant plus susceptibles de présenter un déclin cognitif, une dépression, une apathie et des hallucinations [4].
L’apathie est un problème spécifique à la maladie de Parkinson et peut répondre à un traitement dopaminergique, en particulier à l’administration d’agonistes dopaminergiques.
La dépression peut précéder les symptômes moteurs et il n’y a pas de corrélation entre la dépression et la sévérité du syndrome parkinsonien moteur. Les agonistes dopaminergiques ayant une nette affinité pour le récepteur D3, en particulier le pramipexole et le ropinirole, semblent être supérieurs aux autres agonistes dopaminergiques en termes d’effet antidépresseur. L’étape suivante consiste à utiliser les ISRS et les IRSN, qui sont plutôt récents. Les antidépresseurs plus récents tels que la mirtazapine, la réboxétine et la venlafaxine sont également pris en compte ici, malgré le fait que les preuves soient encore limitées [6].
La psychose est l’une des complications non motrices les plus invalidantes de la maladie de Parkinson. Les hallucinations visuelles peuvent précéder ou accompagner un déclin cognitif et sont considérées comme un signal d’alarme pour le développement d’une démence dans la maladie de Parkinson [4]. Après avoir exclu d’autres facteurs déclencheurs tels que les infections ou les troubles métaboliques, le traitement consiste d’abord à réduire ou à arrêter les médicaments responsables (dans l’ordre : anticholinergiques, antidépresseurs, amantadine, agonistes dopaminergiques, inhibiteurs de la MAO-B et, en dernier lieu, inhibiteurs de la COMT et lévodopa), puis l’administration de neuroleptiques atypiques tels que la clozapine ou encore la quétiapine, la clozapine étant la seule autorisée dans cette indication.
Démence, troubles du contrôle des impulsions et Troubles du sommeil
La prévalence de la démence chez les patients atteints de la maladie de Parkinson est de 30 à 40%. L’âge est considéré comme le principal facteur de risque pour le développement d’une démence, plutôt que la durée de la maladie. Dans un premier temps, il convient d’arrêter les médicaments susceptibles d’entraîner un déclin cognitif, puis, dans un second temps, d’utiliser des inhibiteurs de la cholinestérase, les données étant les plus convaincantes pour la rivastigmine, qui est autorisée pour la démence parkinsonienne légère à modérée [4].
Les troubles du contrôle des impulsions tels que le jeu pathologique, la nourriture, le shopping ou l’hypersexualité ne sont généralement pas signalés, même par honte, et sont plus fréquents en association avec les agonistes dopaminergiques et chez les hommes. Les médecins traitants doivent activement rechercher ces symptômes, car si les troubles du contrôle des impulsions ne sont pas pris en compte, de graves problèmes relationnels durables, voire des difficultés financières, peuvent survenir. Le traitement consiste à réduire ou à arrêter immédiatement les agonistes dopaminergiques en particulier.
Les troubles du sommeil peuvent se présenter sous différentes formes (tableau 1), constituent un problème très fréquent et souvent grave et peuvent avoir différentes causes. La dopamine jouant un rôle dans le cycle veille-sommeil, certains troubles du sommeil dans la maladie de Parkinson peuvent répondre à un traitement dopaminergique optimisé. Cela a été démontré, par exemple, pour la rotigotine transdermique, qui a entraîné une amélioration significative à la fois des limitations motrices matinales et des troubles du sommeil, évalués par le PDSS-2 [7]. Lors de l’utilisation d’agonistes dopaminergiques, il faut faire attention aux effets secondaires possibles d’une augmentation de la somnolence diurne et de crises soudaines d’endormissement, qui peuvent nécessiter une réduction de la dose ou même un arrêt [8]. Le trouble du comportement du sommeil paradoxal se caractérise par la réalisation de rêves (souvent des cauchemars) en raison de l’absence d’atonie musculaire pendant le sommeil paradoxal. Le traitement médicamenteux consiste à utiliser du clonazépam la nuit [9]. Le traitement du syndrome des jambes sans repos repose principalement sur les agonistes dopaminergiques, avec comme alternative, selon la gravité, la gabapentine ou la prégabaline, et dans les cas graves, les opioïdes [10]. Un élément important dans le traitement de tous les troubles du sommeil reste toujours le respect d’une bonne hygiène de sommeil (heures de coucher et de réveil régulières, temps raisonnable passé au lit, c’est-à-dire généralement pas plus de 8 heures). Les autres causes de troubles du sommeil pouvant être traitées, comme le syndrome d’apnée obstructive du sommeil, doivent être exclues.
Douleur
La douleur est un symptôme fréquent chez les patients atteints de la maladie de Parkinson et peut avoir de nombreuses causes différentes (musculo-squelettiques, secondaires à une dystonie, centrales, radiculaires, neuropathiques). L’adaptation du traitement dopaminergique peut conduire à une amélioration, et l’utilisation d’analgésiques doit être envisagée dans une étape ultérieure, en fonction de la cause.
Outre les fluctuations motrices, la stimulation cérébrale profonde (SCP) dans le noyau sous-thalamique améliore la sévérité et les fluctuations des symptômes non moteurs tels que les paresthésies, les douleurs, le besoin d’uriner, les dysautonomies et les troubles du sommeil. Les troubles gastro-intestinaux sont également soulagés, ce qui se traduit globalement par une amélioration notable de la qualité de vie un an après le THS [11].
Pertinence pour les thérapies neuroprotectrices
En particulier, dans la perspective de thérapies neuroprotectrices possibles à l’avenir, le diagnostic précoce, compte tenu des NMS susmentionnés, pourrait revêtir une importance clinique considérable [10]. L’attention, la recherche et le traitement de la NMS dans la maladie de Parkinson vont devenir de plus en plus importants.
Dr. med. Stephan Nitschke
Prof Dr. med. Barbara Tettenborn
Dr. med. Stefan Hägele-Link
Littérature :
- Barone P, et al : The PRIAMO study : a multicentre assessment of non-motor symptoms and their impact on quality of life in Parkinson’s disease. Mov Disord 2009 ; 24(11) : 1641-1649.
- Chaudhuri KR, et al : La non-déclaration des symptômes non moteurs de la maladie de Parkinson aux professionnels de la santé : une étude internationale utilisant le questionnaire sur les symptômes non moteurs. Mov Disord 2010 ; 25 (6) : 704-709.
- Chaudhuri KR, et al : Parkinson’s disease : The non-motor issues. Parkinsonism Relat Disord 2011 Dec ; 17(10) : 717-723.
- Chaudhuri KR, et al : Handbook of Non-Motor Symptoms in Parkinson’s disease. Springer 2011.
- Braak H, et al : Staging of brain pathology related to sporadic Parkinson’s disease. Neurobiol Aging 2003 ; 24 (2) : 197-211.
- Lignes directrices de la DGN, septembre 2012.
- Trenkwalder C, et al : Rotigotine effects on early morning motor function and sleep in Parkinson’s disease : a double-blind, randomised, placebo-controlled study (RECOVER). Mov Disord 2011, 26(1) : 90-99.
- Maass A, et al : Sleep and non-motor symptoms in Parkinson’s disease. J Neural Transm 2013 Avr ; 120(4) : 565-569.
- Aurora RN, et al : Guide des meilleures pratiques pour le traitement du trouble du comportement du sommeil paradoxal (TCSP). J Clin Sleep Med 2010 ; 6(1) : 85-95.
- Garcia-Borreguero D, et al : European guidelines on management of restless legs syndrome : report of a joint task force by the European Federation of Neurological Societies, the European Neurological Society and the European Sleep Research Society. Eur J Neurol 2012 ; 19(11) : 1385-1396.
- Steigerwald F, Volkmann J : Stimulation cérébrale profonde (SCP) dans la maladie de Parkinson : vérifier l’indication de la SCP dès les premières fluctuations d’efficacité. InFoNeurologie&Psychiatrie 2013 ; 15(5) : 38-45.











