L’incidence de la maladie à chlamydia et à gonocoque en Suisse est en augmentation. Parallèlement, les gonocoques multirésistants et M. genitalium compliquent le traitement antibiotique. De nouvelles stratégies sont nécessaires pour empêcher la propagation de ces agents pathogènes.
L’urétrite est la maladie sexuellement transmissible la plus fréquente chez les hommes. Elle représente une inflammation de l’urètre avec une augmentation des leucocytes dans l’exsudat urétral. Alors que des causes infectieuses et non infectieuses peuvent être présentes (tab. 1), elle est généralement due à des agents pathogènes sexuellement transmissibles. En raison de l’incidence élevée et des complications possibles de l’infection par des agents urétraux chez les patients et les partenaires sexuels, la gestion de la maladie est une priorité de santé publique. Les objectifs du traitement sont, outre le traitement des symptômes, la prévention des complications et la réduction de la transmission, y compris des co-infections (comme le VIH). L’identification et le traitement des personnes en contact ainsi que les mesures éducatives avec motivation pour un comportement adapté ont finalement une importance épidémiologique supplémentaire.

Classification et symptômes
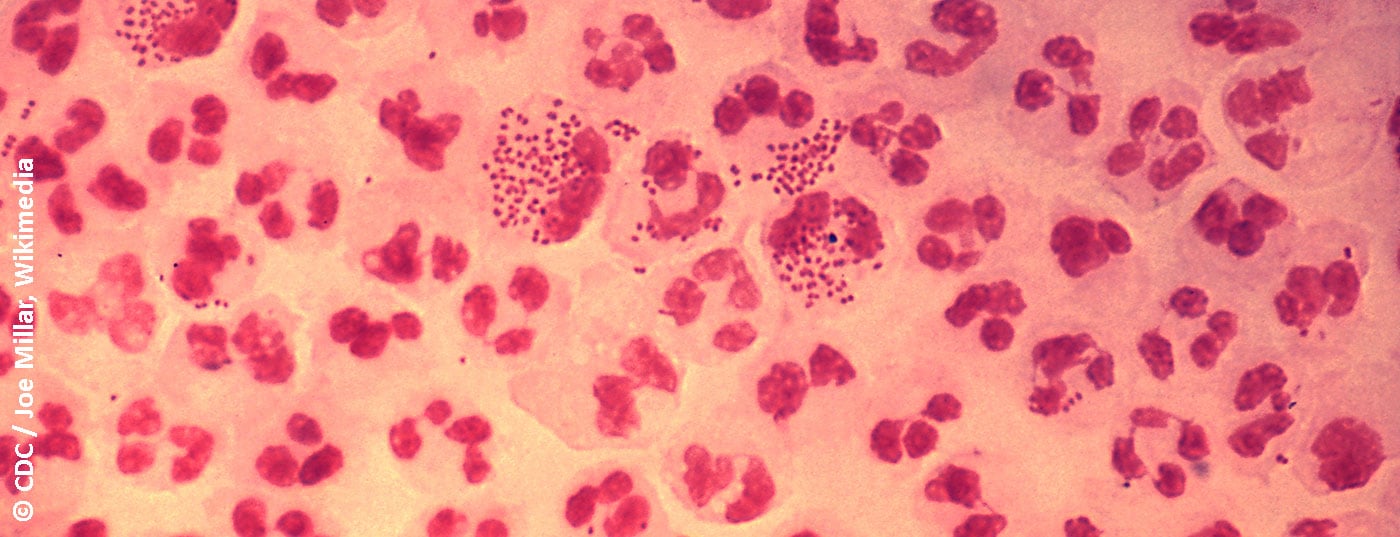
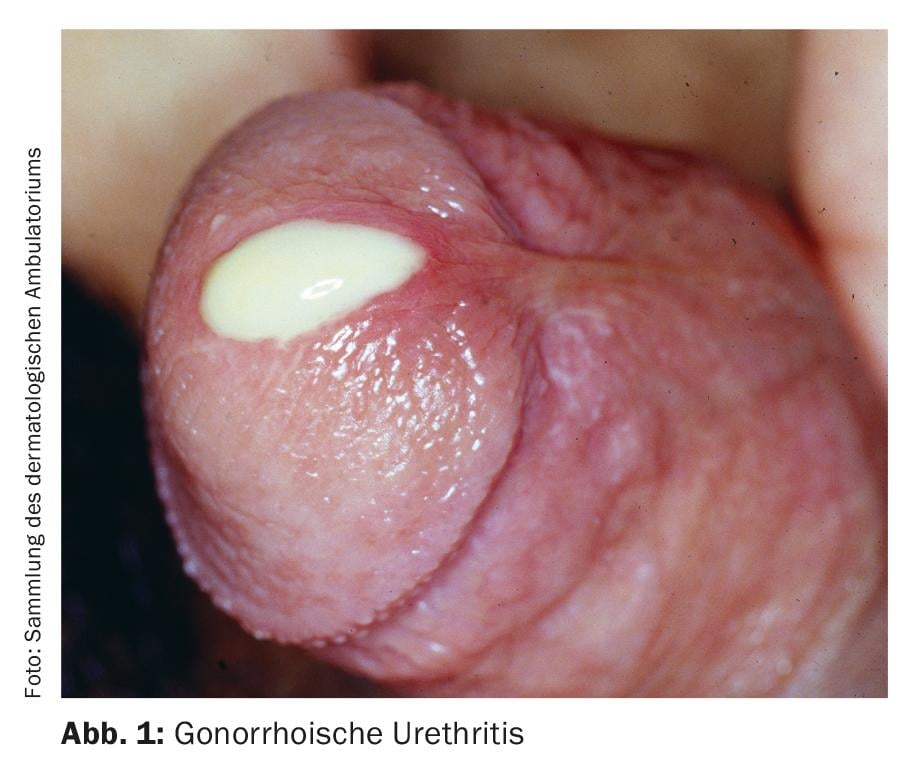
La classification de l’urétrite en forme gonorrhéique et non gonorrhéique est basée sur la coloration traditionnelle de Gram de l’écoulement urétral pour les diplocoques Gram-négatifs. Les symptômes typiques sont des écoulements, typiquement purulents en cas d’urétrite gonorrhéique (Fig. 1), et mucoïdes en cas d’urétrite non gonorrhéique. Les autres symptômes possibles sont la dysurie, les brûlures ou démangeaisons urétrales et l’irritation du méat urétral, parfois accompagnée d’une balanite. Cependant, l’urétrite est souvent asymptomatique [4]. Il faut distinguer l’urétrite d’une infection des voies urinaires ou d’une prostatite, dont le diagnostic différentiel doit être envisagé.
Spectre des agents pathogènes
Les agents pathogènes les plus courants sont Neisseria gonorrhoeae, Chlamydia trachomatis et les mycoplasmes, en particulier le mycoplasma genitalium (M. genitalium). L’incidence des infections à chlamydia et de la gonorrhée a fortement augmenté en Suisse au cours des dernières années. Parmi les mycoplasmes, le rôle pathogène de M. genitalium est le mieux établi. Il convient de noter que la difficulté d’une éradication complète et un problème croissant de résistance compliquent le traitement des mycoplasmes. Actuellement, les auteurs des directives britanniques sur la prise en charge des infections à M. genitalium se sont prononcés contre le dépistage des individus asymptomatiques, estimant qu’il était plus dommageable au niveau de la population [5]. Jusqu’à présent, on a accordé trop peu d’attention à l’importance des agents pathogènes de la vaginose bactérienne comme cause de l’urétrite. Après un rapport oral, les germes respiratoires tels que Haemophilus spp. et les agents viraux tels que l’herpès simplex et les adénovirus (souvent accompagnés d’une conjonctivite) sont plus fréquents. Chez les voyageurs de retour de zones d’endémie, il peut également être utile de rechercher Trichomonas vaginalis.
Diagnostic
L’examen des symptômes urétraux comprend l’anamnèse, l’examen clinique, la réalisation d’une préparation directe complétée par des examens de laboratoire pour rechercher des agents pathogènes urétraux. En outre, un dépistage élargi des maladies sexuellement transmissibles telles que le VIH et la syphilis est généralement approprié. L’anamnèse sexuelle (dans la langue du patient) doit explorer les pratiques sexuelles, les mesures de protection, le nombre de partenaires et l’orientation sexuelle afin de procéder à une évaluation différenciée des risques et de pouvoir conseiller le patient de manière ciblée. Cliniquement, outre l’évaluation du flux, on recherche une lymphadénopathie inguinale ainsi que d’éventuelles ulcérations. Le diagnostic comprend, dans la mesure du possible, une préparation directe, réalisée par écouvillonnage de l’urètre chez l’homme et du canal cervical chez la femme [6].
La morphologie du frottis permet de distinguer l’urétrite gonorrhéique des urétrites non gonorrhéiques grâce à la présence de diplocoques intracellulaires typiques, ainsi que l’origine virale avec une prédominance de cellules mononucléées. La sensibilité et la spécificité des autres méthodes de diagnostic sont inférieures à celles du frottis urétral. Si la microscopie n’est pas disponible, l’urétrite peut être diagnostiquée sur la base de la présence d’un écoulement mucopurulent, d’un test de leucocytes estérase positif lors de l’examen des urines du premier jet ou de la présence de stries dans les urines du premier jet (également possible physiologiquement) [6].
Le frottis urétral ou l’urine du premier jet sont également analysés par amplification génique pour détecter Neisseria gonorrhoeae, Chlamydia trachomatis et, chez les patients symptomatiques, M. genitalium. Un examen bactériologique du frottis par culture doit toujours être envisagé, car la culture permet d’examiner le profil de résistance des gonocoques et de rechercher ainsi d’autres agents bactériens. Si disponible, la résistance aux macrolides doit également être recherchée lors de l’identification de M. genitalium, en analysant les gènes de résistance connus par réaction en chaîne par polymérase (“polymerase chain reaction”). Chez les patientes, l’examen du frottis vaginal pour l’amplification génique est supérieur aux premières urines radiologiques pour le diagnostic de la gonorrhée ou d’une infection à chlamydia.
Thérapie
Chez les patients présentant une urétrite confirmée, il est recommandé de traiter à la fois les gonocoques et les chlamydiae, sauf si les résultats des tests d’amplification génique sont déjà disponibles et permettent de limiter le traitement à l’agent pathogène spécifique. Les recommandations thérapeutiques de l’urétrite gonorrhéique et de l’urétrite non gonorrhéique sans complications, adaptées selon les directives actuelles, sont résumées dans le tableau 2. Pour la gonorrhée, la norme est la bithérapie antimicrobienne. L’approche thérapeutique combinée devrait permettre de mieux garantir l’éradication et donc d’éviter la propagation de gonocoques résistants. Dans le cas de l’urétrite non gonococcique, le traitement par la doxycycline vise à traiter une infection à chlamydia, et aucun problème de résistance n’est connu dans ce cas. En cas d’infection à M. genitalium, la doxycycline n’est utilisée que dans 30% des cas et n’entraîne pas de résistance [7].

Le traitement par azithromycine 1 g (dose unique) doit être évité dans la mesure du possible, car il risque d’induire une résistance aux macrolides dans la M. genitalium. L’azithromycine n’est pas un traitement fiable, en particulier pour la co-infection rectale à Chlamydia, qui est souvent asymptomatique. En cas de détection de M. genitalium, l’azithromycine doit être administrée pendant plusieurs jours, par exemple 500 mg le jour 1 suivi de 250 mg par jour pendant 4 jours supplémentaires. On obtient ainsi une meilleure éradication qu’avec une dose unique [7], ce qui permet de réduire l’apparition de résistances [8]. Lors de l’utilisation de la moxifloxacine, il faut tenir compte d’une éventuelle hépatotoxicité.
L’identification et le traitement des partenaires sexuels revêtent évidemment une grande importance pour le partenaire concerné, pour le patient afin d’éviter une réinfection et, sur le plan épidémiologique, en particulier au vu du problème croissant de la résistance. A titre indicatif, les partenaires sexuels des 60 derniers jours doivent être examinés et traités. La recommandation d’abstinence sexuelle s’applique pendant au moins une semaine ou jusqu’à la fin de l’examen [1].
Un contrôle de l’efficacité du traitement est effectué au plus tôt après deux semaines pour les gonocoques [9], et au plus tôt après trois semaines, ou mieux, cinq semaines pour les mycoplasmes [7]. Un contrôle du traitement de la chlamydia n’est recommandé que pendant la grossesse ou après un traitement de deuxième ligne quatre semaines après le traitement [10]. Toutefois, une réinfection par la chlamydia doit être recherchée après trois mois.
Mesures visant à enrayer le développement de la résistance chez les gonocoques et M. genitalium
Des cas de résistance étendue aux antibiotiques couramment utilisés sont observés dans le monde entier chez les gonocoques et M. genitalium, et l’on craint qu’ils ne se propagent. Ces dernières années, une diminution de la susceptibilité des gonocoques à la ceftriaxone a été constatée en Suisse [13]. En 2018, un total de trois cas d’infections gonococciques résistantes à la fois à la ceftriaxone et à l’azithromycine ont été identifiés en Angleterre et en Australie [14]. Dans le cas de M. genitalium, la résistance aux macrolides est fréquente dans les pays où un traitement de première ligne par azithromycine est utilisé. La résistance à la moxifloxacine est de <10% en Europe, elle est beaucoup plus fréquente en Asie. En raison de la situation en matière de résistance, des craintes se font jour quant au fait que les infections à M. genitalium ne pourront bientôt plus être traitées.
Les mesures de lutte contre la résistance chez les gonocoques comprennent le prélèvement systématique d’une culture et, si possible, la recherche de gènes de résistance par amplification génique chez M. genitalium, afin d’utiliser un traitement adapté à la détermination de la résistance. Selon l’agent pathogène, il faut également tenir compte des infections concomitantes pharyngées et anales, souvent asymptomatiques, qui doivent être davantage recherchées et traitées. L’utilisation de l’azithromycine 1 g en dose unique doit être évitée autant que possible, et même son utilisation dans le traitement combiné de la gonorrhée est controversée. La mise en place d’un suivi thérapeutique, d’un traitement du partenaire et de mesures préventives concernant le comportement sexuel sont des mesures supplémentaires pour éviter la propagation d’agents pathogènes résistants.
Messages Take-Home
- L’incidence de la maladie à chlamydia et à gonocoque en Suisse est en augmentation.
- Parallèlement, dans le monde entier, y compris en Europe, des
- Ces dernières années, on a découvert des gonocoques et des M. genitalium multirésistants qui ne peuvent plus être traités avec les antibiotiques habituellement utilisés.
- De nouvelles stratégies sont indiquées pour empêcher la propagation de ces agents pathogènes.
Littérature :
- Lautenschlager S : Uréthrite non gonorrhéique : spectre des agents pathogènes et prise en charge. Journal d’urologie et d’urogynécologie 2014 ; 21 (1) (édition pour la Suisse) : 17-20.
- Moi H, Blee K, Horner PJ : Gestion de l’urétrite non-gonococcique. BMC Infect Dis 2015;15 : 294.
- Bachmann LH, et al : Advances in the Understanding and Treatment of Male Urethritis. Clin Infect Dis 2015 ; 61(Suppl 8) : 763-769.
- Kälin U, Lauper U, Lautenschlager S : Uréthrite. Spectre des agents pathogènes, investigation et traitement – 2ème partie. Forum Med Suisse 2009 ; 9 : 121-124.
- Soni S, et al. : 2018 BASHH UK national guideline for the management of infection with Mycoplasma genitalium, draft, download from www.bashhguidelines.org/media/1182/bashh-mgen-guideline-2018_draft-for-consultation.pdf, dernière consultation 16.11.2018.
- Horner P, et al. : 2016 European guideline on the management of non-gonococcal urethritis. International Journal of STD & AIDS 2016 ; 27 : 928-937.
- Jensen JS, Cusini M, Gomberg M, Moi H : 2016 European guideline on Mycoplasma genitalium infections. J Eur Acad Dermatol Venereol 2016 ; 30 : 1650-1656.
- Lau A, et al : L’efficacité de l’azithromycine pour le traitement du mycoplasme génital : une revue systématique et une méta-analyse. Clin Infect Dis 2015 ; 61 : 1389-1399.
- Bignell C, Unemo M : 2012 European guideline on the diagnosis and treatment of gonorrhoea in adults. Int J STD AIDS 2013 ; 24 : 85-92.
- Lanjouw E, et al : 2015 European guideline on the management of Chlamydia trachomatis infections. Int J STD AIDS 2016 ; 27 : 333-348.
- Toutos Trellu L, et al : Gonorrhée : nouvelles recommandations sur le diagnostic et le traitement. Forum Med Suisse 2014 ; 14(20) : 407-409.
- Horner P, et al. : 2016 European guideline on the management of non-gonococcal urethritis. International Journal of STD & AIDS 2016 ; 27(11) : 928-937.
- Kovari H, et al. : Decreased Susceptibility of Neisseria gonorrhoeae isolates from Switzerland to Cefixime and Ceftriaxone : antimicrobial susceptibilty data from 1990 and 2000 to 2012. BMC Infectious Diseases 2013 ; 13 : 603.
- European Centre for Disease Prevention and Control : Rapid Risk Assessment : Extensively drug-resistant (XDR) Neisseria gonorrhoeae in the United Kingdom and Australia, date de publication 7 mai 2018, www.ecdc.europa.eu, dernière consultation 07.11.2018.
DERMATOLOGIE PRATIQUE 2018 ; 28(6) : 4-7