Plusieurs études ont récemment permis d’élargir les indications de la thérapie de resynchronisation cardiaque. La volonté d’éviter les électrodes intravasculaires reliées à un dispositif sous-cutané a conduit au développement de DAI implantables par voie sous-cutanée et de stimulateurs cardiaques sans sonde insérés par cathéter. Alors que les premiers sont déjà utilisés dans la pratique clinique quotidienne après une sélection minutieuse des patients, les seconds ne sont utilisés que dans le cadre d’études. Des efforts sont en cours pour développer un système complet à deux ou trois chambres sans conducteurs électriques. Les complications infectieuses après l’implantation et le changement de dispositifs cardiaques sont un problème redouté. Les enveloppes de dispositifs recouvertes d’antibiotiques constituent une approche prometteuse pour réduire le taux d’infection. Des études supplémentaires sont toutefois nécessaires sur ce point, ainsi que sur l’administration systémique d’antibiotiques péri-interventionnels.
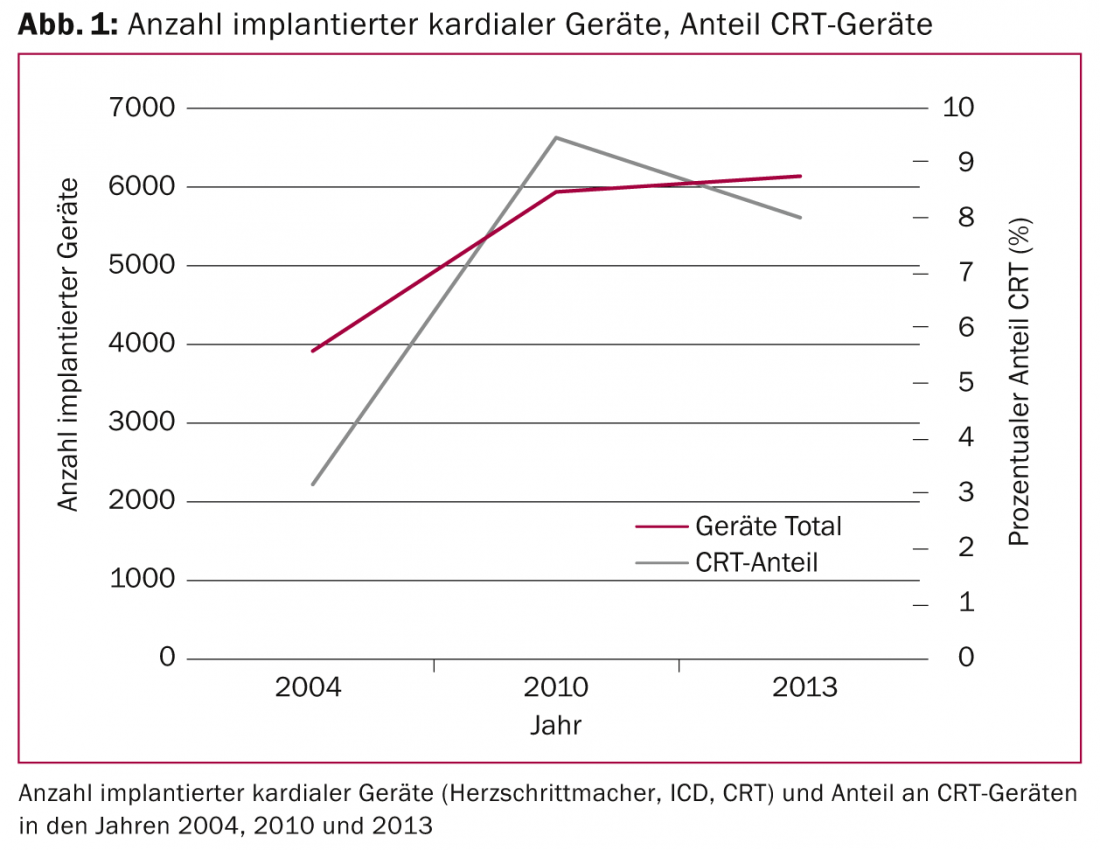
Les indications d’implantation de dispositifs cardiaques (stimulateurs conventionnels, défibrillateurs implantables [ICD] et systèmes de stimulation biventriculaires) se sont élargies au cours de la dernière décennie grâce à de nouvelles découvertes, notamment dans le domaine de la thérapie de resynchronisation cardiaque (CRT). Alors qu’en 2004, à peine 4000 dispositifs cardiaques ont été implantés en Suisse, cette proportion est passée à un peu plus de 6000 dispositifs en 2013. La proportion d’appareils CRT a triplé entre 2004 et 2010 (Fig. 1) .
L’introduction du DAI sous-cutané et la démonstration de la faisabilité/sécurité du pacing sans sonde (“leadless pacing”) ont constitué une étape technique importante. Cependant, alors que ces nouvelles technologies commencent à peine à entrer dans la routine clinique, la réalisation d’examens RM chez des patients utilisant des appareils non compatibles avec la RM ou la prévention des infections liées aux appareils constituent des défis fréquents dans la pratique clinique quotidienne, qui seront brièvement abordés dans cet article de synthèse.
Sélection des patients pour le traitement de resynchronisation cardiaque
Dans le domaine de la TRC, de nombreuses études intéressantes ont été menées et publiées ces dernières années. L’étude CARE-HF extension a montré une réduction relative significative du risque de mortalité globale de 40% (réduction absolue de 38,1 à 24,7%) à trois ans grâce à la CRT chez des patients souffrant d’insuffisance cardiaque sévère (NYHA III/IV) traitée de manière optimale, avec une FEVG ≤35% et un complexe QRS élargi. Chez les patients souffrant d’une insuffisance cardiaque légère (NYHA I/II) et d’une indication de DAI en prévention primaire, l’ajout d’une CRT dans l’étude REVERSE n’a pas entraîné de réduction du critère d’évaluation composite primaire, mais a permis de constater une réduction des hospitalisations liées à l’insuffisance cardiaque ainsi qu’une influence favorable sur la géométrie du ventricule gauche avec une augmentation significative de la fraction d’éjection. La mortalité annuelle dans le suivi à 5 ans récemment publié était étonnamment faible (2,9%), ce qui explique au moins en partie l’absence d’impact du traitement sur ce critère chez les 610 patients inclus . L’étude RAFT similaire a comparé le traitement par CRT-ICD au traitement par DAI seul et a constaté une réduction significative du critère d’évaluation principal, composé de la mortalité totale et de l’hospitalisation liée à l’insuffisance cardiaque, chez les patients souffrant d’insuffisance cardiaque NYHA II/III. Pris ensemble, ces deux travaux suggèrent que les patients souffrant d’insuffisance cardiaque légère peuvent également bénéficier d’une CRT. Une extension supplémentaire de la CRT pourrait également résulter à l’avenir des résultats positifs de l’étude Block-HF récemment publiée, dans laquelle les patients ayant une indication de stimulation cardiaque pour trouble du rythme lent ont bénéficié d’une CRT par rapport à un traitement conventionnel par stimulateur cardiaque, indépendamment de leur classe NYHA, lorsque la fonction de pompe ventriculaire gauche était inférieure à 50%.
Le fait que les patients présentant une largeur de QRS <120 ms puissent présenter une dyssynchronie à l’échocardiographie et que certaines études monocentriques aient démontré un bénéfice en termes de symptômes d’insuffisance cardiaque chez ces patients grâce à la CRT a conduit à l’idée d’étendre le concept de CRT aux patients présentant un QRS relativement étroit. Cependant, les deux études multicentriques, randomisées et contrôlées LESSER-EARTH et EchoCRT ont montré non seulement l’absence d’avantage de survie d’une CRT par rapport à un traitement par DAI seul, mais même une surmortalité dans le groupe CRT (EchoCRT), de sorte que la CRT est aujourd’hui une contre-indication chez les patients présentant un QRS <120 ms sans indication de stimulation cardiaque.
Le revers de la médaille de l’augmentation des indications de CRT est certainement le taux de complications plus élevé des appareils CRT par rapport aux appareils DAI. Dans une analyse multivariable, l’implantation d’un CRT-D est associée à un risque 2,2 fois plus élevé de complications dans les 45 jours suivant l’implantation par rapport à l’implantation d’un DAI simple chambre [1], et l’implantation d’un CRT-D est un facteur de risque indépendant de révision du dispositif par rapport à l’implantation d’un DAI seul.
Multisite LV pacing
Une réponse réduite à la CRT peut être observée avec une augmentation du pourcentage de cicatrice du VG, une cicatrice postéro-latérale ou une dyssynchronie mécanique extrême [2]. Les zones cicatricielles ont des propriétés de conduction électrique défavorables et une stimulation dans une zone cicatricielle myocardique n’est donc pas souhaitable. Les études TARGET et STARTER montrent qu’un placement ciblé de la sonde VG dans des segments myocardiques à excitation tardive détectés par échocardiographie peut avoir une influence favorable sur le pronostic [2]. Les sondes VG multipolaires avec plusieurs vecteurs de stimulation au choix peuvent présenter des avantages à cet égard, car des segments myocardiques viables et/ou des zones excitées tardivement peuvent être stimulés de manière ciblée par une programmation appropriée, même après l’implantation de la sonde VG (multipolaire). De plus, une éventuelle stimulation du nerf phrénique peut être contournée en modifiant le vecteur de stimulation. Les avantages théoriques sont convaincants et il reste à voir si les quelques données disponibles qui confirment ce concept seront consolidées dans des études de plus grande envergure.
peuvent.
ICD sous-cutané
Les systèmes de DAI transveineux développés dans les années 1980 nécessitent des électrodes de conception complexe, qui doivent remplir à la fois les fonctions de détection/pompage et de défibrillation. Il n’est donc pas surprenant que ces électrodes, malgré des technologies innovantes, soient sujettes à des défauts, comme nous l’ont montré les électrodes Medtronic SprintFidelis ou SJM Riata. Dans une étude monocentrique allemande portant sur 990 patients porteurs d’un DAI, 15% ont eu des problèmes d’électrodes au cours du suivi (médiane de 2,5 ans) [3], 56 défauts d’isolation, 12 ruptures d’électrodes et 31% d’autres problèmes tels que la “perte de capture”, des problèmes de sensing ou d’impédance. Bien que ces chiffres élevés n’aient pas été confirmés par une étude multicentrique dans laquelle le taux de révision des sondes sur 5 ans était de 2,5% [4], il ne fait aucun doute que le principal point faible d’un DAI réside dans la sonde. Il est donc tentant de pouvoir offrir une protection antitachycardique sans les difficultés associées aux sondes transveineuses ; cette approche a été rendue possible, au moins en partie, par l’introduction du S-ICD, qui se passe d’une sonde intraveineuse (Fig. 2) .
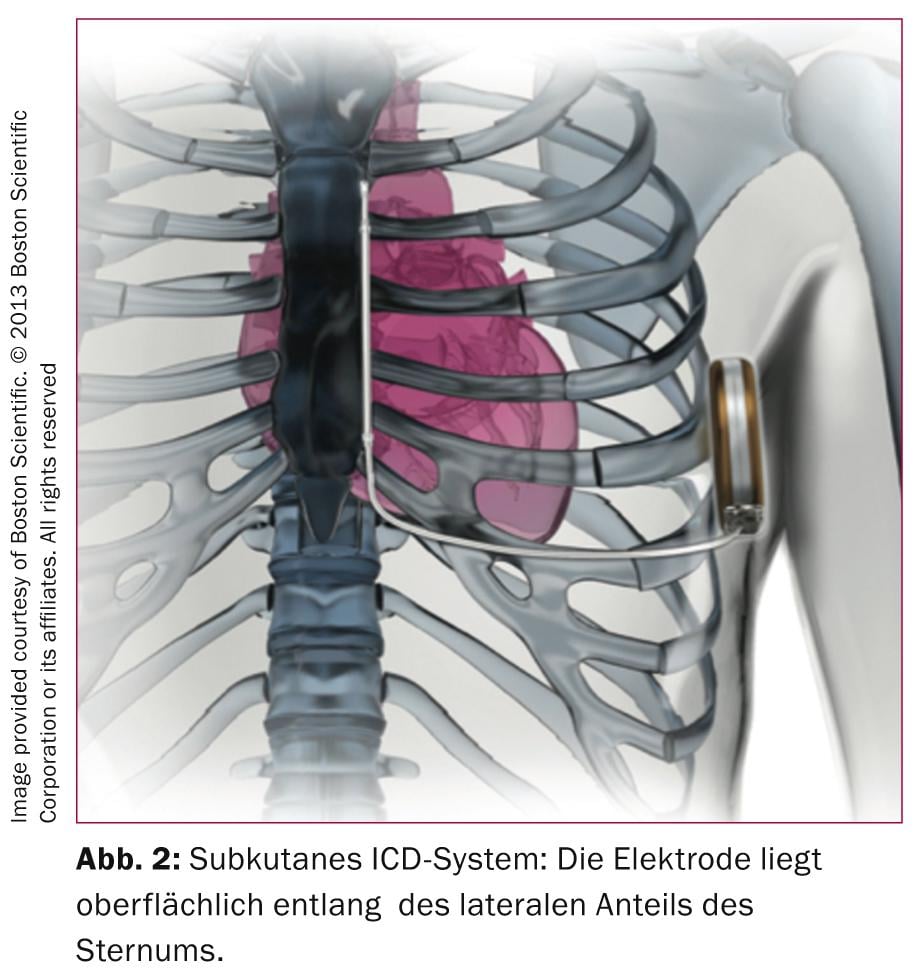
L’absence d’électrode intravasculaire présente des avantages lors de l’implantation du dispositif (réduction de la dose de rayons X) et permet d’éviter les problèmes d’électrodes futurs avec d’éventuelles extractions compliquées d’électrodes. L’inconvénient du S-ICD est qu’en l’absence de dérivation électrographique intracardiaque, la détection de la fibrillation ventriculaire peut être plus difficile, ce qui nécessite une analyse approfondie de l’ECG de surface avant l’implantation d’un S-ICD. Cependant, selon les données de registre les plus complètes publiées à ce jour [5], le taux de chocs inappropriés est de 7%, ce qui signifie que le taux de chocs DAI injustifiés est plutôt faible par rapport aux systèmes DAI conventionnels [6]. L’antitachypacing pour la surstimulation des tachycardies ventriculaires n’est pas possible avec les systèmes sous-cutanés (ou serait toléré par les patients), c’est pourquoi ces systèmes sont plutôt moins utilisés chez les patients atteints d’une maladie coronarienne ou d’une cardiomyopathie non ischémique et les principales indications sont les patients présentant des troubles des canaux ioniques, une cardiomyopathie hypertrophique ou les patients ayant subi une infection par DAI avec des systèmes transveineux. Enfin, un choc électrique plus puissant, en chargeant le condensateur à 80 J, est nécessaire pour mettre fin aux tachycardies ventriculaires/fibrillations, ce qui implique un dispositif plus important. Dans certains cas, il est donc nécessaire de peser de manière critique les avantages et les inconvénients avant d’implanter un S-ICD.
Pacing sans fil
De nombreuses complications liées à l’implantation de dispositifs sont dues au fait que les sondes doivent être introduites et ancrées dans le cœur par voie intravasculaire et qu’elles sont soumises à des contraintes mécaniques constantes tout au long de leur vie. Par conséquent, un moyen sans sonde de stimuler le cœur est très attrayant. Dans l’étude LEADLESS, le système Nanostim™ Leadless Pacemaker développé par la société Nanostim (rachetée par St. Jude Medical) a été testé pour la première fois sur 33 patients et a été jugé faisable et sûr. La société Medtronic a développé un système similaire (Micra™ Transcatheter Pacing System), qui peut également être ancré dans l’apex du ventricule droit via un cathéter orientable depuis l’aine. La batterie de ce système a une durée de vie prévue d’environ huit ans. Des efforts techniques sont en cours pour permettre la communication entre différents petits stimulateurs placés dans l’oreillette droite et les deux ventricules, ouvrant ainsi la voie à des systèmes à deux ou trois chambres sans aiguille. Si ces systèmes devaient être utilisés à grande échelle à l’avenir , ce dont nous sommes convaincus, cela modifierait fortement notre technique d’implantation, car de tels systèmes doivent être mis en place dans un laboratoire d’électrophysiologie/cathéter cardiaque par voie inguinale et les cathéters actuels, non encore disponibles sur le marché, ont aujourd’hui un diamètre compris entre 18 et 23 F. Dans des mains inexpérimentées, cela entraîne inévitablement des complications et pose de nouveaux défis à la logistique des hôpitaux.
L’imagerie par résonance magnétique chez les patients porteurs de dispositifs cardiaques
On estime que jusqu’à 75% des patients porteurs d’un stimulateur cardiaque recevront une indication d’examen IRM au cours de leur vie. Cette constatation est prise en compte par le nombre croissant de dispositifs compatibles RM proposés par différents fabricants, qui sont souvent implantés dans la vie quotidienne et volontiers. Malgré la popularité croissante de ces appareils, le problème d’un examen IRM souhaité se pose souvent dans la pratique clinique quotidienne pour les patients disposant déjà de systèmes non compatibles avec l’IRM. Dans ces cas, un examen IRM n’est généralement pas réalisable. Bien qu’il soit de plus en plus évident que les examens RM présentent relativement peu de complications, même chez ces patients, , la FDA américaine ainsi que les fabricants de dispositifs considèrent tous les DAI et la plupart des stimulateurs cardiaques comme des contre-indications à l’examen RM. Néanmoins, selon les dernières directives de l’ESC [7], après exclusion des patients avec des dispositifs récemment implantés ou des (fragments d’)électrodes non connectées laissées en place, un examen RM est acceptable en cas de nécessité absolue (pas d’autre méthode d’imagerie en coupes), après une évaluation minutieuse du rapport bénéfice/risque, même chez les patients sans dispositifs compatibles avec la RM et peut être réalisé à 1,5 Tesla avec un faible risque de complications, à condition qu’une préparation adéquate ait été effectuée.
Réduction du risque d’infection lors de l’implantation du dispositif
L’infection est probablement la complication la plus redoutée de l’implantation d’un dispositif et est associée à des coûts économiques élevés ainsi qu’à une mortalité accrue. Les facteurs de risque pour les infections de dispositifs sont les ré-interventions, la fièvre et/ou l’absence de prophylaxie antibiotique des infections [8]. Il est intéressant de noter que jusqu’à un tiers des loges ou des électrodes de DAI sont colonisées par des bactéries lors d’un changement de DAI [9], ce qui pourrait être lié au risque accru d’infection après réintervention. Le seul essai contrôlé randomisé comparant l’administration péri-interventionnelle d’antibiotiques contre un placebo avant l’implantation d’un stimulateur cardiaque a dû être arrêté prématurément après avoir recruté deux tiers des patients prévus en raison du net avantage de l’administration d’antibiotiques [10]. Une étude de registre prospective récemment publiée a montré qu’une administration supplémentaire d’antibiotiques postopératoires pendant quatre jours entraînait une nouvelle réduction significative des infections liées aux dispositifs, tant lors de la première opération que lors des réopérations [11]. En outre, il existe des données peu nombreuses mais prometteuses concernant une maille antibiotique absorbable récemment disponible ( Fig. 3) [12].

Auto-résorbée après neuf semaines et recouverte de minocycline et de rifampicine, cette maille a permis de réduire significativement le taux d’infection de 3 à 0,9% par rapport à un contrôle historique sur un échantillon de patients sélectionnés et est particulièrement efficace chez les patients à haut risque d’infection [12]. D’autres études sont nécessaires et en cours (étude CITADEL/CENTURION).
Perspectives
Les innovations techniques montrent une volonté croissante de s’affranchir des électrodes introduites par voie transcutanée, qu’il s’agisse du DAI sous-cutané ou du pacing sans sonde. En l’absence de chiffres d’implantation à grande échelle et de données sur le critère d’évaluation qui doivent d’abord confirmer les résultats préliminaires prometteurs, il reste à voir si et à quelle vitesse ces nouvelles technologies seront adoptées dans la pratique clinique quotidienne. En ce qui concerne la réduction du taux d’infection, en particulier après le changement d’appareil de tachydevices, nous avons besoin de toute urgence de nouvelles études qui examinent l’administration d’antibiotiques péri- et postopératoire. Des indications rétrospectives d’une antibiothérapie prolongée ont été publiées, et les données positives des enveloppes imprégnées d’antibiotiques soutiennent le concept d’une antibiothérapie prolongée pour la prévention des infections.
Dr. med. Dr. scient. med. Roman Brenner
Dr. med. David Altmann
Prof. Dr. med. Peter Ammann
Littérature :
- Lee DS, et al : Evaluation of early complications related to De Novo cardioverter defibrillator implantation insights from the Ontario ICD database. J Am Coll Cardiol 2010 ; 55(8) : 774-782.
- Leyva F, Nisam S, Auricchio A : 20 ans de thérapie de resynchronisation cardiaque. J Am Coll Cardiol 2014 ; 64(10) : 1047-1058.
- Kleemann T, et al : Annual rate of transvenous defibrillation lead defects in implantable cardioverter-defibrillators over a period of >10 years. Circulation 2007 ; 115(19) : 2474-2480.
- Eckstein J, et al. : Nécessité d’une révision chirurgicale des leads de défibrillateurs implantés à long terme : causes et gestion. Circulation 2008 ; 117(21) : 2727-2733.
- Lambiase PD, et al : Worldwide experience with a totally subcutaneous implantable defibrillator : early results from the EFFORTLESS S-ICD Registry. Eur Heart J 2014 ; 35(25) : 1657-1665.
- Poole JE, Gold MR : Qui doit recevoir le défibrillateur implanté sous-cutané : Le défibrillateur cardiaque implantable (DCI) sous-cutané doit être envisagé chez tous les patients DCI qui ne nécessitent pas de stimulation. Circ Arrhythm Electrophysiol 2013 ; 6(6) : 1236-1244 ; discussion 1244-1245.
- Brignole M, et al. : 2013 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy : the Task Force on cardiac pacing and resynchronization therapy of the European Society of Cardiology (ESC). Développé en collaboration avec l’Association européenne du rythme cardiaque (EHRA). Eur Heart J 2013 ; 34(29) : 2281-2329.
- Klug D, et al : Risk factors related to infections of implanted pacemakers and cardioverter-defibrillators : results of a large prospective study. Circulation 2007 ; 116(12) : 1349-1355.
- Kleemann T, et al : Prévalence de la colonisation bactérienne des poches du générateur chez les patients porteurs d’un défibrillateur cardiaque implantable ne présentant aucun signe d’infection lors du remplacement du générateur ou de la révision de la conduite. Europace 2010 ; 12(1) : 58-63.
- De Oliveira JC, et al : Efficacité de la prophylaxie antibiotique avant l’implantation de pacemakers et de défibrillateurs cardioverteurs : résultats d’un large essai prospectif, randomisé, en double aveugle, contrôlé par placebo. Circ Arrhythm Electrophysiol 2009 ; 2(1) : 29-34.
- Senaratne JM, et al : A 19-year study on pacemaker-related infections : a claim for using postoperative antibiotics. Pacing Clin Electrophysiol 2014 ; 37(8) : 947-954.
- Mittal S, et al : Cardiac implantable electronic device infections : incidence, risk factors, and the effect of the AigisRx antibacterial envelope. Rythme cardiaque 2014 ; 11(4) : 595-601.
CARDIOVASC 2015 ; 14(1) : 17-20