La carence en fer chez les patients cardio-rénaux n’est pas un problème mineur. L’insuffisance cardiaque chronique, par exemple, n’est pas seulement une maladie fréquente, elle est aussi souvent associée à une carence en fer. Cela a à son tour un impact sur les prévisions. En effet, les taux d’hospitalisation et de mortalité sont étroitement liés au statut en fer de ces patients. Une substitution en fer précoce et conforme aux directives est indiquée.
L’insuffisance cardiaque (IC) est principalement une maladie liée à l’âge et la raison la plus fréquente d’hospitalisation pour cause de maladie. Les limitations fonctionnelles du cœur vont souvent de pair avec une diminution de la fonction rénale – et vice versa. La raison en est la relation étroite entre le système nerveux sympathique et le système rénine-angiotensine-aldostérone. Ce dernier contrôle par exemple l’équilibre des fluides et des électrolytes du corps et influence donc également la pression artérielle. Le volume sanguin artériel effectif est quant à lui pertinent pour la perte de potassium par les reins. L’insuffisance rénale et l’insuffisance cardiaque chroniques sont toutes deux étroitement associées à une carence en fer, qui est elle-même un facteur pronostique défavorable en termes de performance, d’hospitalisation et de mortalité.
Physiopathologie de la carence en fer
La physiopathologie de la carence en fer dans l’insuffisance cardiaque est probablement multifactorielle. Il est donc important de ne pas négliger d’autres causes telles que les ulcères gastro-intestinaux ou les maladies malignes. Il peut y avoir des facteurs simples, comme la perte de sang due à un traitement antiplaquettaire ou anticoagulant, qui entraînent une perte de fer. La malabsorption peut également jouer un rôle. En outre, un œdème interstitiel intestinal peut entraîner une diminution de l’absorption orale du fer.
L’état inflammatoire chronique associé à l’insuffisance cardiaque entraîne des taux élevés de cytokines pro-inflammatoires telles que l’interleukine-6 (IL-6). L’inflammation induit la synthèse d’hepcidine, ce qui réduit la libération du fer stocké. Alors que la plupart des maladies inflammatoires chroniques sont associées à des taux d’hepcidine plus élevés, des études menées chez des patients atteints d’IH ont montré que l’IH avancée est associée à des taux d’hepcidine plus faibles et ne semble pas être corrélée à l’IL-6 dans ce groupe de patients. Cela peut être dû en partie à un taux élevé d’érythropoïétine associé à une HI avancée et à la suppression de l’hépicidine.
La carence en fer est largement sous-estimée, bien qu’elle puisse être détectée chez près d’un patient sur deux. Or, le fer est essentiel à la respiration cellulaire et aux performances physiques. En outre, il a été démontré que la carence en fer affecte directement la fonction des cardiomyocytes humains, affecte la respiration mitochondriale et réduit la contractilité et la relaxation. Celui-ci doit donc toujours être compensé tôt.
Substitution précoce
Pour le diagnostic de base, il convient d’utiliser un hémogramme avec ferritine, saturation de la transferrine (TSAT), CRP et taux de filtration glomérulaire. Chez un patient souffrant d’insuffisance cardiaque, des taux sériques de ferritine <100 μg/l, ou des taux compris entre 100 et 300 μg/l, ainsi que TSAT <20%, constituent déjà une carence en fer nécessitant un traitement. Étant donné qu’une substitution orale du fer doit être effectuée pendant plusieurs mois, que son absorption entérale est réduite et qu’elle n’a aucune influence sur les performances physiques, les lignes directrices de l’ESC préconisent d’envisager l’administration de fer-carboxymaltose par voie intraveineuse (fig. 1). Les réserves de fer peuvent ainsi être reconstituées de manière efficace, efficiente et contrôlée sur une courte période. Les symptômes sont améliorés et les taux d’hospitalisation et de mortalité sont réduits. Un tableau similaire est observé chez les patients cardio-rénaux. Aux stades III-IV, une carence en fer peut être diagnostiquée chez jusqu’à 70% des patients. Une étude a montré que le fer carboxymaltose permettait de reconstituer les réserves de fer et d’augmenter les taux de TSAT beaucoup plus rapidement que le fer oral.
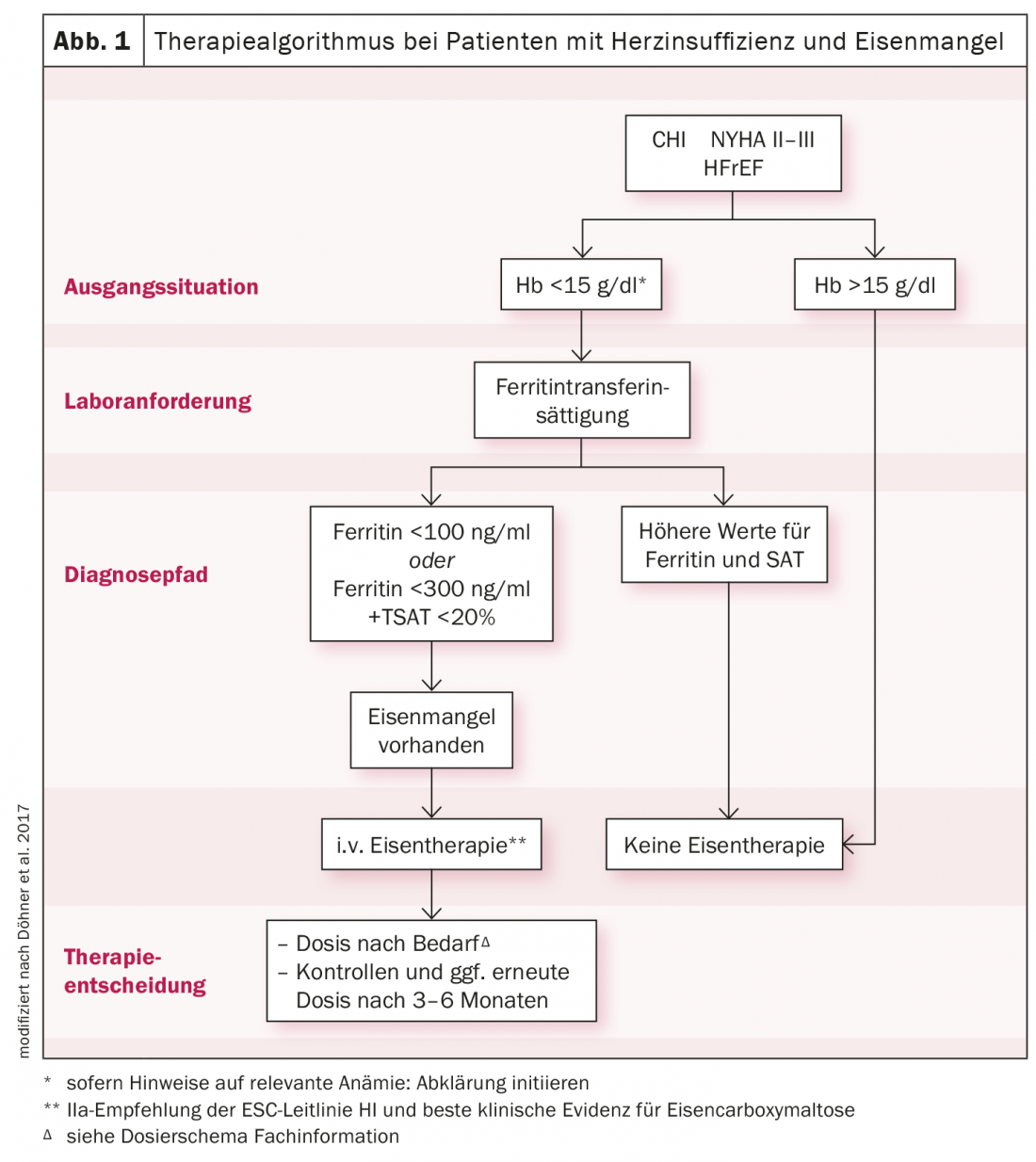
Le fer-carboxymaltose rapidement efficace
Le fer-carboxymaltose présente une grande stabilité de complexe, ce qui permet de l’administrer à des doses élevées (jusqu’à 1000 mg/application et semaine) et en peu de temps (1000 mg en au moins 15 minutes avec un suivi d’au moins 30 minutes). Comme le composé complexe est exempt de dextran, aucun anticorps anti-dextran n’est lié. Il n’y a donc pas de risque accru de réactions anaphylactiques induites par le dextran.
Littérature complémentaire :
- Klip IT, et al : Am Heart J 2013 ; 165 : 575-582.
- Ponikowski P, et al : Eur J Heart Fail 2016 ; 18 : 891-975.
- Okonko DO, et al : J Am Coll Cardio 2011 ; 58 : 1241-1251.
- Jankowska EA, et al : Eur Heart J 2013 ; 34 : 816-826
- Hastka J, et al. : Lignes directrices sur la carence en fer et l’anémie ferriprive 2018.
- Hoes MF, et al : Eur J Heart Fail 2018 ; 20 : 910-919
- Cappellini MD, et al : Am J Hematol 2017 ; 92 : 1068-1078.
- Lewis GD, et al : JAMA 2017 ; 317 : 1958-1966.
- Laufs U, et al. : DGK 2016 ; 1 : 1-65.
- Anker SD, et al : Eur J Heart Fail 2018 ; 20 : 125-133.
- Qunibi W, et al : Nephrol Dial Transplant 2011 ; 26 : 1599-1607.
- Geisser P : Port J Nephrol Hypert 2009 ; 23 : 11-16.
- Neiser S, et al : Int J Mol Sci 2016 ; 17 : 1185.
- Doehner W, et al. : Dtsch Med Wochenschr 2017 ; 142 : 752-757.
- Ronco C, et al : J Am Coll Cardiol 2008 ; 52 (19) : 1527-1539.
- Kovesdy CP : Rev Endocr Metab Discord 2017 ; 18 (1) : 41-47.
- Dunn JD, et al : Am J Manag Care 2015 ; 21 (15 Suppl) : s307-s315.
- Bushinsky DA, et al : Kidney Int 2015 ; 88 (6) : 1427-1433.
CARDIOVASC 2021 ; 20(1) : 18-19