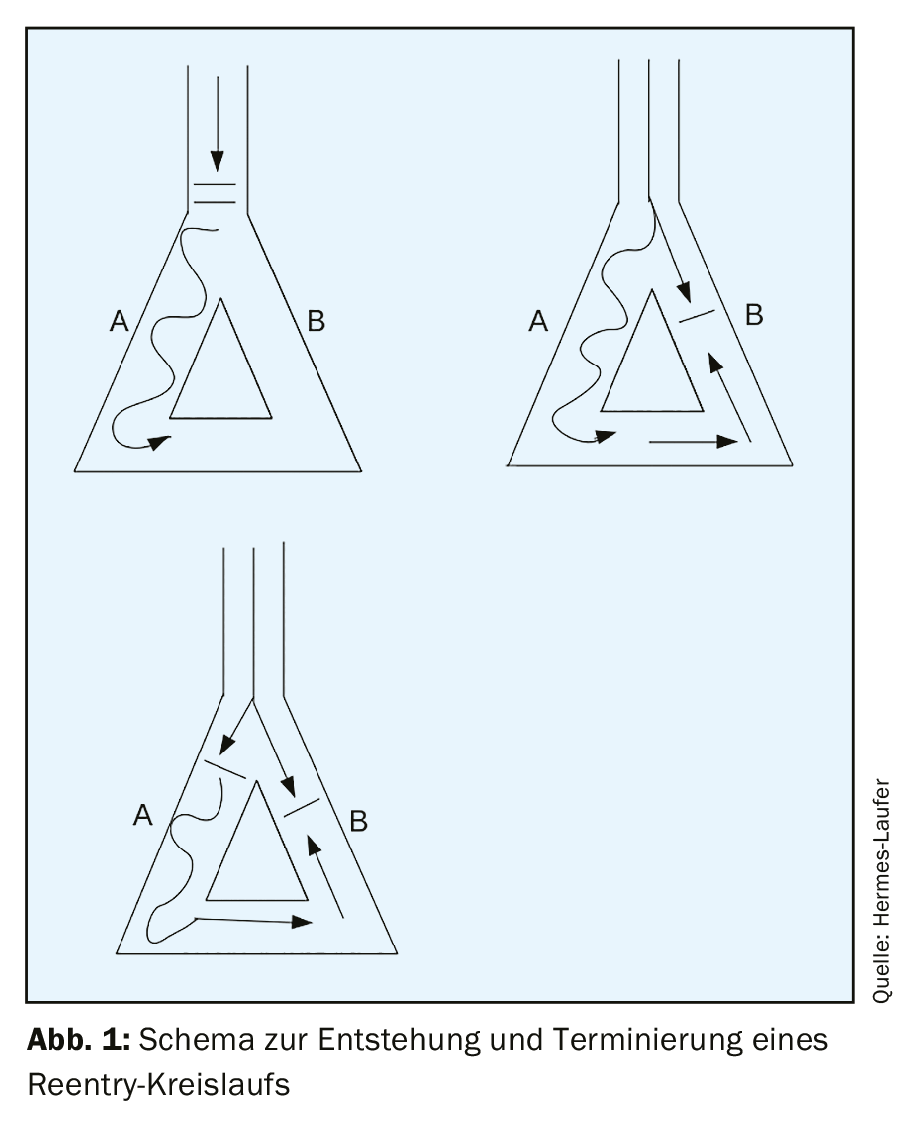
Les tachycardies à complexes étroits sont une manifestation clinique fréquente. La réentrée, en particulier, provoque des tachycardies persistantes. La condition préalable à l’apparition d’une tachycardie de réentrée est un substrat avec deux voies de conduction différentes, qui ont des vitesses de conduction et des périodes réfractaires différentes. Dans la plupart des cas, les tachycardies supraventriculaires ne sont pas associées à une cardiopathie structurelle.
Les tachycardies à complexes étroits régulières sont une manifestation clinique fréquente, avec une prévalence de 2,25/1000 patients [1]. Les trois mécanismes sous-jacents des tachycardies en général sont l’automatisme, la réentrée et l’activité déclenchée. De loin, le plus fréquent de ces trois mécanismes en cas de tachycardie persistante est le réentrée. L’automatisme est focal et plutôt rare (moins de 10% de toutes les tachycardies). L’activité déclenchée est une perturbation de la repolarisation – dans laquelle des dépolarisations ultérieures se produisent pendant la phase III ou la phase IV du potentiel d’action et, lorsque le seuil est atteint, un nouveau potentiel d’action se produit, entraînant une tachycardie. Parmi les tachycardies par réentrée supraventriculaire, on distingue les tachycardies par réentrée du nœud AV, les tachycardies par réentrée AV et les tachycardies par réentrée auriculaire focale avec une répartition de fréquence de 60%, 30% et 10% [2]. La condition préalable à l’apparition d’une tachycardie de réentrée est un substrat avec deux voies de conduction différentes, qui ont des vitesses de conduction et des périodes réfractaires différentes. Si un déclencheur, tel qu’une extrasystole, survient au moment où la voie de conduction avec la période réfractaire la plus longue est encore réfractaire, mais que la voie avec la période réfractaire la plus courte a déjà récupéré, un bloc unidirectionnel se produit initialement et peut ensuite conduire à une excitation circulaire si l’excitation arrive au moment où la deuxième voie de conduction est à nouveau conductrice (espace excitable). (Fig. 1). Dans la plupart des cas, les tachycardies supraventriculaires ne sont pas associées à une cardiopathie structurelle.
Diagnostic différentiel
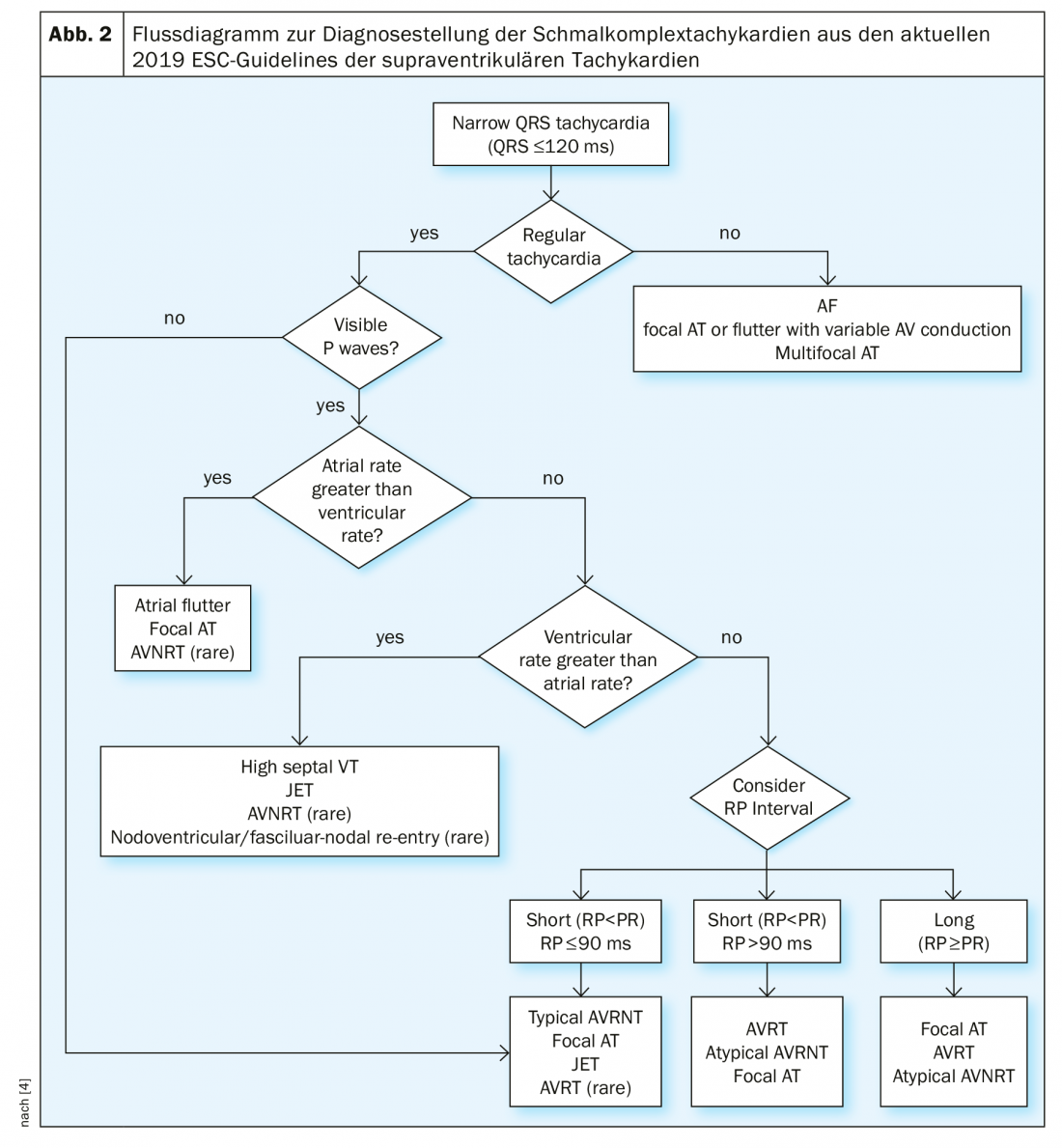
En cas de tachycardie à complexes étroits inexpliquée avec une durée de QRS <120 ms, le patient doit d’abord être évalué pour la stabilité hémodynamique et un ECG 12 dérivations doit être dérivé chaque fois que possible. Un monitoring est recommandé ainsi qu’une analyse de laboratoire incluant la numération sanguine, les électrolytes, la fonction rénale et la fonction thyroïdienne. Dans le 12 canaux, la régularité de la tachycardie et la présence d’ondes P doivent être vérifiées. Lorsque la fréquence ventriculaire est irrégulière, il s’agit généralement d’une fibrillation auriculaire, d’un flutter auriculaire à conduction variable ou d’une tachycardie auriculaire focale. En particulier, le début et la fin de la tachycardie sont d’une grande importance, avec par exemple la question d’un début et d’une fin soudains ou progressifs. Si des ondes P sont présentes, il faut vérifier si une onde P est associée à chaque complexe QRS, si l’espacement PR est plus grand que l’espacement RP (PR>RP ou RP>PR) et si la fréquence auriculaire est plus grande, plus petite ou égale à la fréquence ventriculaire. L’organigramme des lignes directrices actuelles de l’ESC (Fig. 2) donne un aperçu du diagnostic différentiel de la tachycardie à complexes étroits . Dans les cas incertains et en cas de stabilité hémodynamique, une manœuvre vagale diagnostique et/ou une administration intraveineuse d’adénos doivent être envisagées. Ainsi, en cas de flutter auriculaire, les ondes de flutter se manifestent et une AVNRT ou une AVRT se termine dans la plupart des cas par l’administration adéquate d’adénos. Si l’adénosine n’a pas d’effet sur la tachycardie à complexe étroit, soit elle a été injectée à une dose et/ou selon un mode d’administration inadéquats (injection trop lente ou sans écoulement de NaCl), soit il s’agit dans de rares cas d’une tachycardie ventriculaire hautement septale.
AVNRT
La forme la plus courante de tachycardie supraventriculaire paroxystique – la tachycardie par réentrée du nœud AV (TNR AV) – se caractérise par un début soudain et une fin tout aussi soudaine. Dans environ 95% des cas, il s’agit d’une AVNRT typique de type slow-fast, où la conduction antérograde emprunte la voie lente et la conduction rétrograde la voie rapide. Dans l’anamnèse, il faut demander s’il y a une augmentation de la diurèse pendant/après la tachycardie ainsi qu’une sensation de “battement dans la gorge” (frog sign), qui sont des symptômes typiques de l’AVNRT en raison de la contraction simultanée de l’oreillette et du ventricule avec les valves fermées et la sécrétion d’ANP associée. L’ECG de surface montre une tachycardie à complexe étroit régulière (sauf en cas d’image de bloc de branche préexistante) sans ondes P visibles ou avec des ondes P rétrogrades avec un intervalle RP très court, inférieur à 70 ms (fig. 3) [4]. Dans l’AVNRT atypique (environ 5% des AVNRT) de type fast-slow ou slow-slow, les ondes P rétrogrades sont souvent visibles avant le complexe QRS suivant, car l’excitation rétrograde passe par la voie lente.

L’AVNRT peut se manifester pendant l’enfance ou au début de l’âge adulte, mais aussi au cours de la quatrième ou de la cinquième décennie, voire plus tard [3,4]. La physiologie de la double conduction est innée, mais la probabilité de survenue d’une AVNRT se module avec l’âge, d’une part en raison de la fréquence variable des extrasystoles et d’autre part en raison de modifications structurelles des propriétés des deux voies de conduction liées à l’âge, ce qui peut également entraîner une manifestation tardive de l’AVNRT [3]. D’autres facteurs pouvant influencer la probabilité de manifestation d’une AVNRT par des déclencheurs accumulés sont les facteurs hormonaux, comme dans l’hyperthyroïdie, et la consommation excessive de caféine et d’alcool.
AVRT
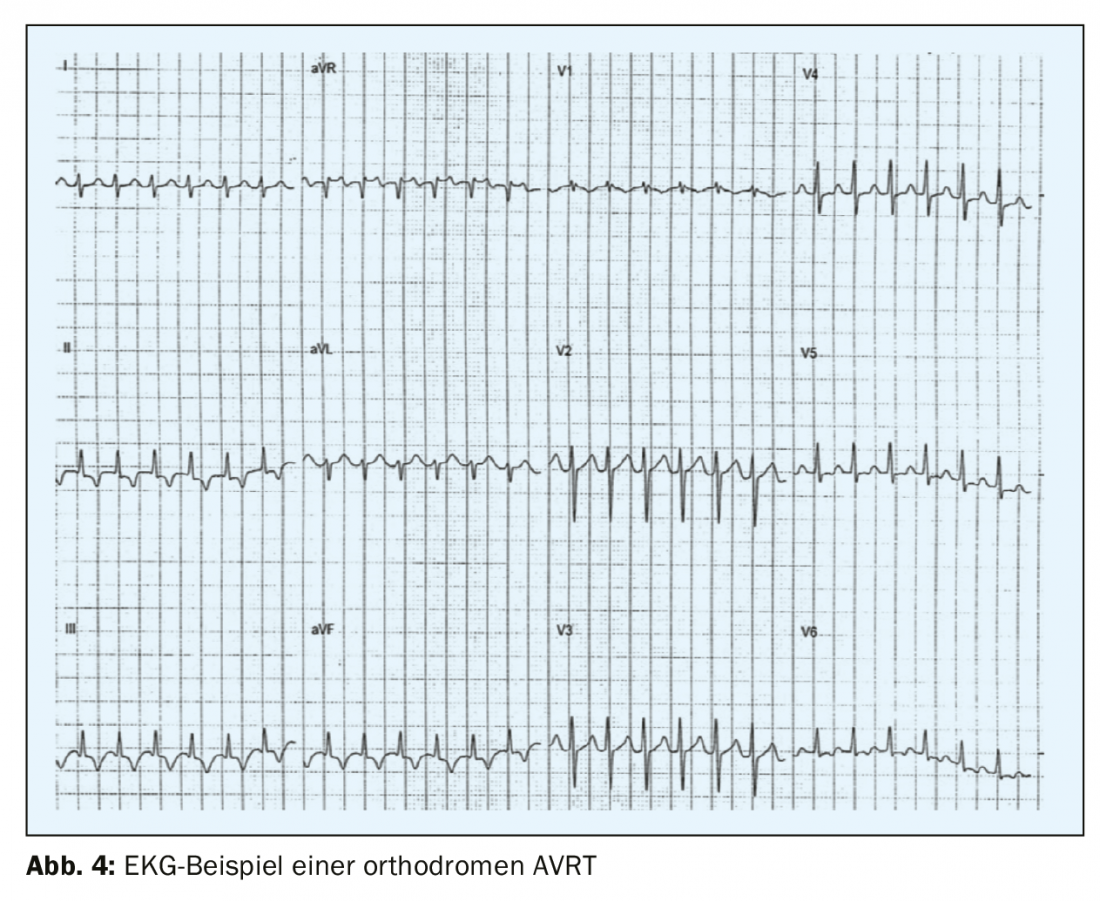
La deuxième forme la plus fréquente de tachycardie paroxystique supraventriculaire – l’AVRT – est due à une voie de conduction accessoire entre l’oreillette et le ventricule, qui se trouve en dehors du système de conduction spécifique. Le syndrome de préexcitation – ou syndrome de Wolff-Parkinson-White – a été décrit pour la première fois au début des années 1930 par les trois cardiologues qui lui ont donné son nom, Louis Wolff, John Parkinson et Paul Dudley White, et presque simultanément par Max Holzmann à Zurich. Le trajet accessoire le long de la valve mitrale est le plus souvent localisé sur la paroi libre gauche (environ 60-70% des trajets accessoires), suivi par les trajets septaux sur le canal mitral ou tricuspide (environ 25%) et seulement 15% sont localisés sur la paroi libre du VR [5]. Certains patients (<12%) ont de multiples voies de conduction accessoires, ce qui doit être envisagé par exemple chez les patients présentant une anomalie d’Ebstein [6]. Le syndrome de pré-excitation se caractérise par une voie accessoire manifeste, des troubles du rythme fréquents et une image typique de pré-excitation sur l’ECG, avec une onde delta typique, une onde montante ou descendante aplatie du complexe QRS et un complexe QRS élargi de plus de 120 ms. Dans la plupart des cas, les patients atteints du syndrome WPW ont un cœur structurellement normal et sont enfants ou adolescents lors de la première manifestation. Les hommes sont plus souvent touchés que les femmes. Dans l’AVRT orthodromique (>90% des AVRT et 20-30% de toutes les tachycardies supraventriculaires persistantes), la circulation va d’abord de l’oreillette au ventricule par le système de conduction normal et revient du ventricule à l’oreillette par la voie accessoire. L’ECG de crise montre une tachycardie à complexes étroits régulière avec une fréquence généralement comprise entre 160 et 220/min avec des ondes P rétrogrades avec un intervalle RP de >70 ms (RP<PR) (Fig. 4) .
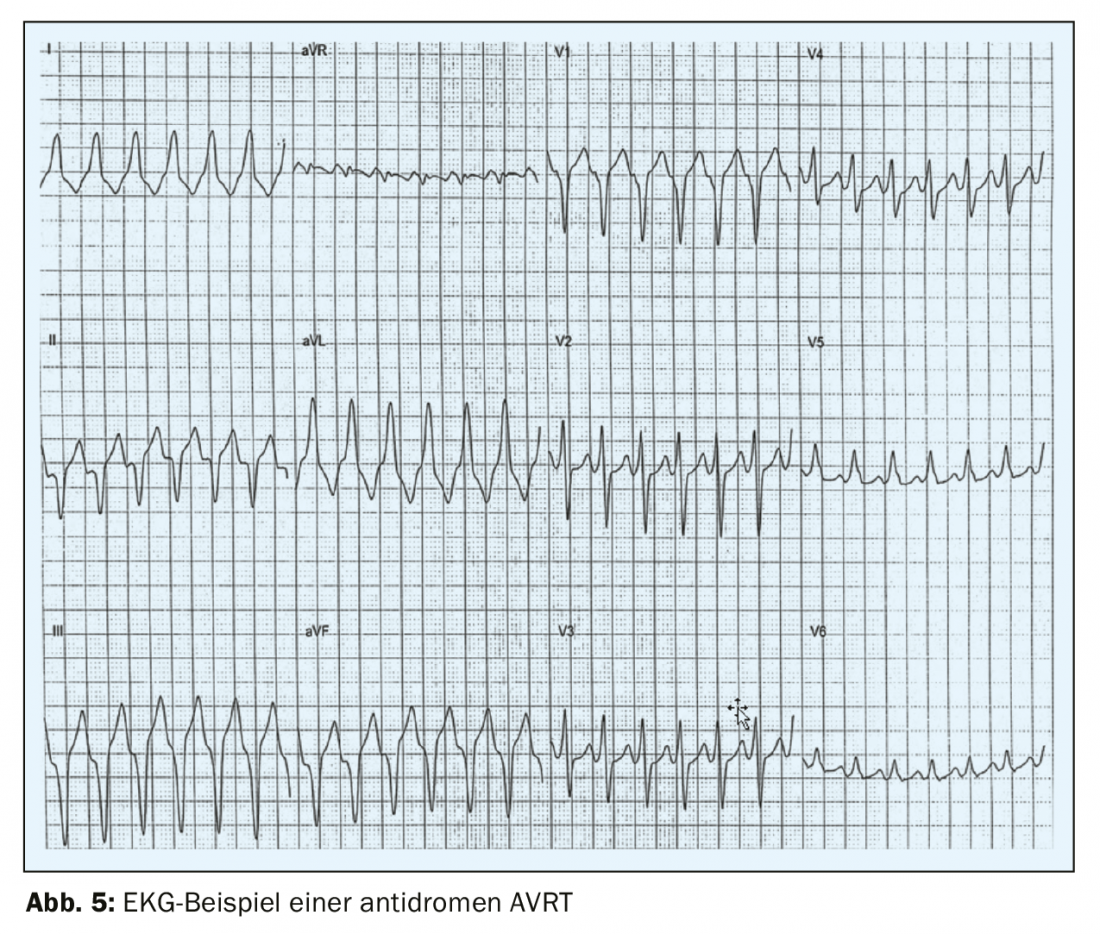
L’AVRT antidrome, beaucoup plus rare, ne se produit que chez 3 à 8% des patients atteints de WPW [7], l’excitation passant d’abord de l’oreillette au ventricule par la voie accessoire et revenant par le nœud AV. L’ECG de surface montre un large complexe QRS, ce qui rend l’AVRT antidrome difficile à distinguer de la tachycardie ventriculaire (Fig. 5). 50% des patients atteints du syndrome WPW présentent une fibrillation auriculaire paroxystique. [8,4]Le risque de fibrillation ventriculaire est très élevé en cas de conduction par la voie accessoire et de fréquence ventriculaire rapide, ce qui peut mettre la vie en danger et dégénérer en fibrillation ventriculaire. Sur l’ECG de surface, ce trouble du rythme se reconnaît à une fréquence rapide et irrégulière et à un large complexe QRS avec pré-excitation [9] (FBI – fast, broad, irregular). C’est la raison pour laquelle il est essentiel de toujours clarifier sur le plan rythmologique les résultats même fortuits d’un ECG de préexcitation chez les patients asymptomatiques et de les traiter dans la plupart des cas. Dans le cas du “WPW caché”, il existe une voie accessoire conductrice uniquement rétrograde – généralement sur la paroi libre du VG, mais la préexcitation n’est pas visible sur l’ECG de surface et la première manifestation est une AVRT orthodromique. Dans ce cas, comme la voie accessoire ne peut pas conduire de manière antérograde, les patients présentant un WPW concealed ne présentent pas de risque accru de mort subite d’origine cardiaque.
Tachycardie auriculaire
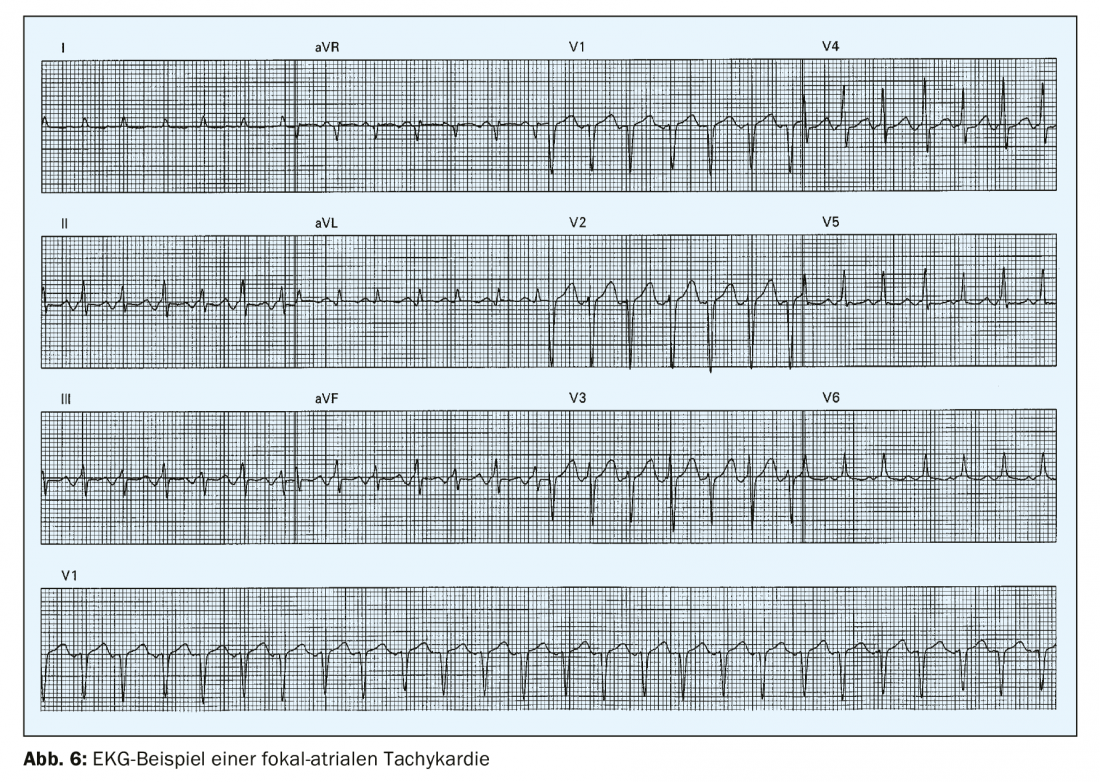
La tachycardie auriculaire focale est un rythme auriculaire organisé >100/min qui trouve son origine en dehors du nœud sinusal (Fig. 6). Elle est rare, avec une prévalence de 0,34% chez les jeunes adultes [4] et représente moins de 10% de toutes les TVC. Dans l’ECG de surface, on trouve des ondes P monomorphes avec une longueur de cycle stable. Le mécanisme déclencheur peut être, d’une part, un micro-retrait ou un automatisme. La tachycardie auriculaire focale trouve souvent son origine au niveau de la jonction veino-auriculaire, par exemple au niveau du sinus coronaire, de la crista terminalis ou du canal mitral ou tricuspide. La configuration de l’onde P sur l’ECG 12 dérivations peut fournir des informations sur l’origine de la tachycardie auriculaire focale.
Flutter auriculaire
Dans le cas du flutter auriculaire, il faut faire la distinction entre un flutter auriculaire typique (90%), dépendant de l’isthme, avec un macroréentrée tournant soit dans le sens inverse des aiguilles d’une montre, soit autour de l’isthme cavotricuspide (canal tricuspide), et un flutter atypique. Dans le flutter auriculaire typique, on distingue également le type I, avec un macroréentricule tournant dans le sens inverse des aiguilles d’une montre (counter-clockwise) autour de l’isthme cavotriscupidien, et le type II, avec un macroréentricule tournant dans le sens des aiguilles d’une montre (clockwise). Les ECG respectifs des flutters auriculaires typiques de type I et de type II peuvent être très différents – par exemple, les “ondes en dents de scie” typiques apparaissent dans le flutter de type I et peuvent être complètement absentes dans le flutter de type II, car elles sont souvent cachées dans le complexe QRS et les ondes T dans ce cas. Le flutter atypique peut avoir son origine dans l’oreillette droite ou gauche et est fréquemment observé chez les patients pré-opérés, les patients atteints de malformations cardiaques congénitales ou après des interventions telles que l’ablation de la fibrillation auriculaire, où il existe un substrat correspondant autour duquel le circuit de flutter tourne. Dans l’ECG de surface, le flutter typique se traduit par des ondes de flutter en dents de scie sur l’ECG, dont la fréquence est généralement d’environ 300/min et qui sont négatives dans les dérivations inférieures et positives en V1 dans le cas d’un flutter auriculaire typique dépendant de l’isthme dans le sens antihoraire. La conduction AV est souvent de 2:1, mais peut être de 3-4:1, 1:1 ou variable. C’est pourquoi, en cas de TSV régulière avec une fréquence d’environ 150/min, il faut toujours penser à un flutter auriculaire, que les ondes de flutter soient visibles ou non sur l’ECG de surface, pour établir le diagnostic différentiel. Le nœud AV passe physiologiquement en bloc 2:1 ou plus en cas de flutter auriculaire, en raison de sa période réfractaire et de sa propriété de conduction décrémentielle. Cliniquement, le flutter auriculaire est souvent associé à la fibrillation auriculaire et les patients doivent être dépistés.
Une discussion sur la fibrillation auriculaire dépasserait le cadre de cet article, nous nous contenterons de mentionner qu’une tachycardie irrégulière avec arythmie absolue sans ondes P claires est une fibrillation auriculaire pour laquelle une documentation ECG doit être recherchée pour la prise en charge ultérieure.
Gestion
Gestion de l’AVNRT : dans le cadre du traitement aigu, les patients hémodynamiquement instables doivent bénéficier d’une cardioversion synchronisée, ce qui est extrêmement rare en pratique (indication de classe IB). Les manœuvres vagales, telles que la manœuvre de Valsalva avec compression abdominale, le massage unilatéral du sinus carotidien ou la consommation rapide d’eau froide, peuvent souvent mettre fin à la tachycardie de réentrée (indication de classe IB). Le massage du sinus carotidien doit toujours être précédé d’une auscultation afin d’identifier les sténoses carotidiennes et il doit généralement être pratiqué avec retenue chez les patients âgés souffrant d’athérosclérose. Si les manœuvres vagales échouent, que le patient est stable et qu’il n’y a pas de contre-indications, 6-18 mg d’adénosine doivent être administrés rapidement par voie i.v. avec NaCl-flush (indication de classe IB). L’administration de médicaments antiarythmiques tels que les bêtabloquants iv ou le vérapamil ou le diltiazem figure certes comme option thérapeutique dans les directives actuelles (indication de classe IIa), mais elle peut entraîner des hypotensions et un bloc AV transitoire et n’est que très rarement nécessaire dans la pratique actuelle. L’étalon-or pour le traitement à long terme de l’AVNRT typique et atypique est l’ablation par cathéter, qui entraîne une guérison dans 97% des cas et des complications graves dans seulement 0,3% des cas [10], comme un bloc AV et la nécessité d’un stimulateur cardiaque. Le taux de complications dépend de l’expérience des électrophysiologistes. Il n’y a pas de limite d’âge pour l’ablation par cathéter, les seniors d’âge avancé présentant des comorbidités devraient également être soumis à une ablation par cathéter.
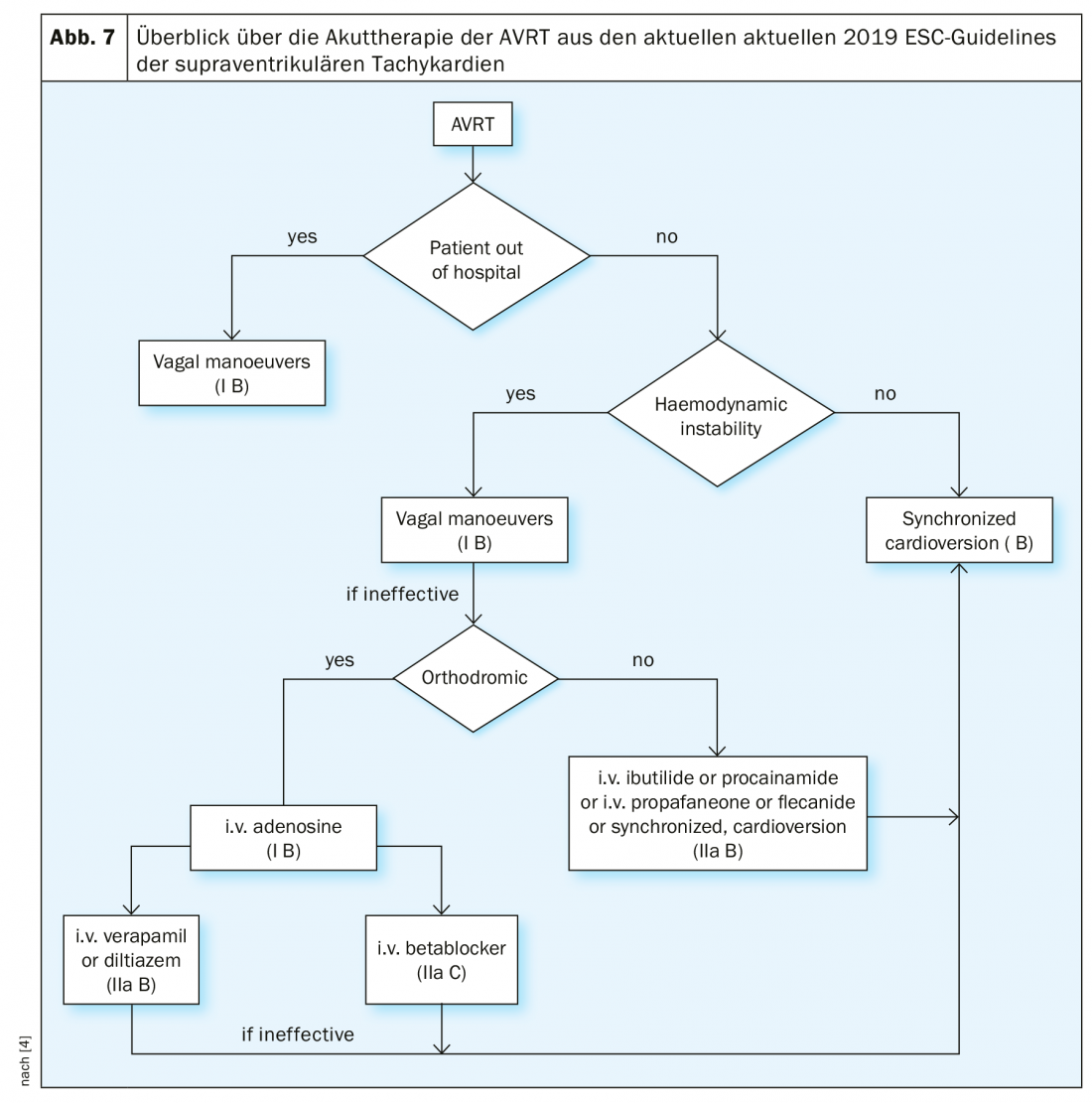
Gestion de l’AVRT : dans le cadre du traitement aigu, les patients hémodynamiquement instables doivent bénéficier d’une cardioversion synchronisée (indication de classe IB). Les manœuvres vagales, comme l’AVNRT, sont également indiquées et peuvent permettre de terminer la tachycardie (indication de classe IB). En ce qui concerne le traitement médicamenteux, il convient de faire la distinction entre l’AVRT orthodromique et l’AVRT antidrogue.
En cas d’AVRT orthodromique, l’adénosine 6-18 mg iv doit être administrée (indication de classe IB), ce qui est encore plus efficace pour l’AVRT que pour l’AVNRT. Dans le cas de l’AVRT antidrogue, les médicaments chronotropes négatifs doivent être évités. Les options thérapeutiques, outre la cardioversion synchronisée, sont ici la flécaïnide, la procaïnamide ou la propafénone – comme dans le cas de la fibrillation auriculaire avec préexcitation. L’organigramme issu des lignes directrices actuelles sur les SVT donne un aperçu du traitement aigu de l’AVRT (figure 7).
Après le traitement aigu, le gold standard est, comme pour l’AVNRT, l’ablation de la voie de conduction accessoire. Le taux de complications de l’ablation dépend de la localisation de la voie accessoire. Les principales complications sont le bloc AV complet (0,17-2,7%) et la tamponnade péricardique (0,1-1,1%) [4]. Les voies accessoires gauches peuvent être ablatées par voie transseptale ou par voie aortique rétrograde. Si l’ablation par cathéter n’est pas souhaitée par le patient, il est possible d’utiliser des bêtabloquants, du diltiazem ou du vérapamil en cas de WPW confiné et des antiarythmiques de classe IC en cas de WPW manifeste “ouvert”. En cas de WPW ouvert, les antagonistes du calcium de type vérapamil (et les digitaliques) sont contre-indiqués car ils ralentissent la conduction via le nœud AV et favorisent ainsi la conduction rapide via la voie accessoire et donc une fréquence ventriculaire dangereusement rapide.
Prise en charge du flutter auriculaire : le contrôle de la fréquence par des médicaments n’est pas toujours facile à obtenir en cas de flutter auriculaire, des combinaisons de médicaments chronotropes négatifs (bêtabloquants, antagonistes du calcium, digoxine) peuvent éventuellement être utilisées avec prudence. L’anticoagulation doit être initiée selon les mêmes critères que pour la fibrillation auriculaire (score CHA2DS2-VASc ≥1 point). Il n’est pas rare qu’une cardioversion synchronisée soit nécessaire dans le cadre d’un traitement aigu, car le contrôle de la fréquence par les médicaments est insuffisant. L’amiodarone peut également être utilisée pour contrôler la fréquence, mais ne permet d’obtenir un contrôle du rythme que dans 29% des cas [11], c’est pourquoi la stratégie primaire de contrôle du rythme en cas de flutter auriculaire est la cardioversion synchronisée. La cardioversion du flutter auriculaire nécessite moins d’énergie que la cardioversion de la fibrillation auriculaire et est plus efficace. Chez les patients porteurs d’un stimulateur cardiaque et d’une sonde auriculaire, une hyperstimulation auriculaire peut entraîner la terminaison du flutter. L’adénosine ne doit être utilisée que pour confirmer le diagnostic et démasquer les flutters lorsque l’ECG n’est pas clair et peut provoquer une fibrillation auriculaire. Le gold standard du traitement à long terme est l’ablation par cathéter, qui permet d’obtenir 90% d’absence de récidive en cas de flutter auriculaire isthmique. L’ablation du flutter atypique est plus difficile, car il est souvent nécessaire de cartographier et d’ablater de multiples circuits électriques autour de substrats individuels. En cas de fibrillation auriculaire, il convient de rechercher, dans la mesure du possible, un contrôle du rythme qui tienne compte de la situation globale du patient. Toutes les mesures de contrôle du rythme et de la fréquence en cas de flutter et de fibrillation auriculaire doivent impérativement respecter les directives en matière d’anticoagulation.
Prise en charge de la tachycardie auriculaire focale : Dans le traitement aigu, les bêtabloquants ou les antagonistes du calcium peuvent être utilisés pour ralentir la fréquence ventriculaire [4]. L’adénosine peut entraîner une terminaison ou une bradycardie dans environ 50% des cas et n’est donc pas toujours utile pour le diagnostic et le traitement [12]. Une ablation par cathéter doit être effectuée chez les patients symptomatiques présentant des tachycardies auriculaires focales récurrentes.
Messages Take-Home
- Une cardioversion synchronisée doit être effectuée chez les patients hémodynamiquement instables, quelle que soit la forme de la TSV.
- Une documentation de la tachycardie par ECG 12 dérivations est d’une grande importance pour la gestion ultérieure et devrait toujours être recherchée.
- Les manœuvres vagales et l’adénosine (6-18 mg en bolus i.v.) sont indiquées en cas de stabilité hémodynamique, à la fois pour confirmer le diagnostic et pour
- Traitement aigu en l’absence de contre-indications.
- L’ablation par cathéter est un traitement sûr et efficace à long terme de l’AVNRT, de l’AVRT et du flutter auriculaire typique, avec des taux élevés de non-récidive et un faible taux de complications dans les centres spécialisés.
- En cas de tachycardie auriculaire, le traitement est d’abord médicamenteux, mais chez les patients symptomatiques présentant des récidives, l’indication d’une ablation par cathéter doit également être envisagée.
Littérature :
- Delacretaz E : Tachycardie supraventriculaire. New England Journal of Medicine, 2006 ; 354(10) : 1039-1051.
- Wellens HJ : Electrophysiologie, 25 ans de connaissances sur les mécanismes de l’arythmie supraventriculaire : SÉRIE HISTORIQUE NASPE. 2003 ; 26(9) : 1916-1922.
- Pentinga ML, et al. : Late onset atrioventricular nodal tachycardia. 1993 ; 38(3) : 293-298.
- Brugada J, et al. : 2019 ESC Guidelines for the management of patients with supraventricular tachycardiaThe Task Force for the management of patients with supraventricular tachycardia of the European Society of Cardiology (ESC). 2019.
- Jackman WM, et al. : Ablation par cathéter des voies auriculo-ventriculaires accessoires (syndrome de Wolff-Parkinson-White) par courant de radiofréquence. 1991 ; 324(23) : 1605-1611.
- Cappato R, et al : Radiofrequency current catheter ablation of accessory atrioventricular pathways in Ebstein’s anomaly. 1996 ; 94(3) : 376-383.
- Brembilla-Perrot B, et al. : Incidence et signification pronostique des tachycardies antidromiques spontanées et induites. 2013 ; 15(6) : 871-876.
- Gemma LW, et al. : Développement d’une réponse ventriculaire préexcitée rapide à une fibrillation auriculaire chez un patient avec préexcitation intermittente. 2013 ; 24(3) : 347-350.
- Etheridge SP, et al : Life-threatening event risk in children with Wolff-Parkinson-White syndrome : a multicenter international study. 2018 ; 4(4) : 433-444.
- Spector P, et al. : Meta-analysis of ablation of atrial flutter and supraventricular tachycardia. 2009 ; 104(5) : 671-677.
- Kafkas NV, et al. : Efficacité de conversion de l’ibutilide intraveineux par rapport à l’amiodarone intraveineuse chez les patients atteints de fibrillation auriculaire et de flutter auriculaire récidivants. 2007 ; 118(3) : 321-325.
- Eidher U, et al. : Efficacité et sécurité de l’ibutilide pour la conversion de la tachycardie auriculaire monomorphe. 2006 ; 29(4) : 358-362.
CARDIOVASC 2020 ; 19(2) : 6-11