
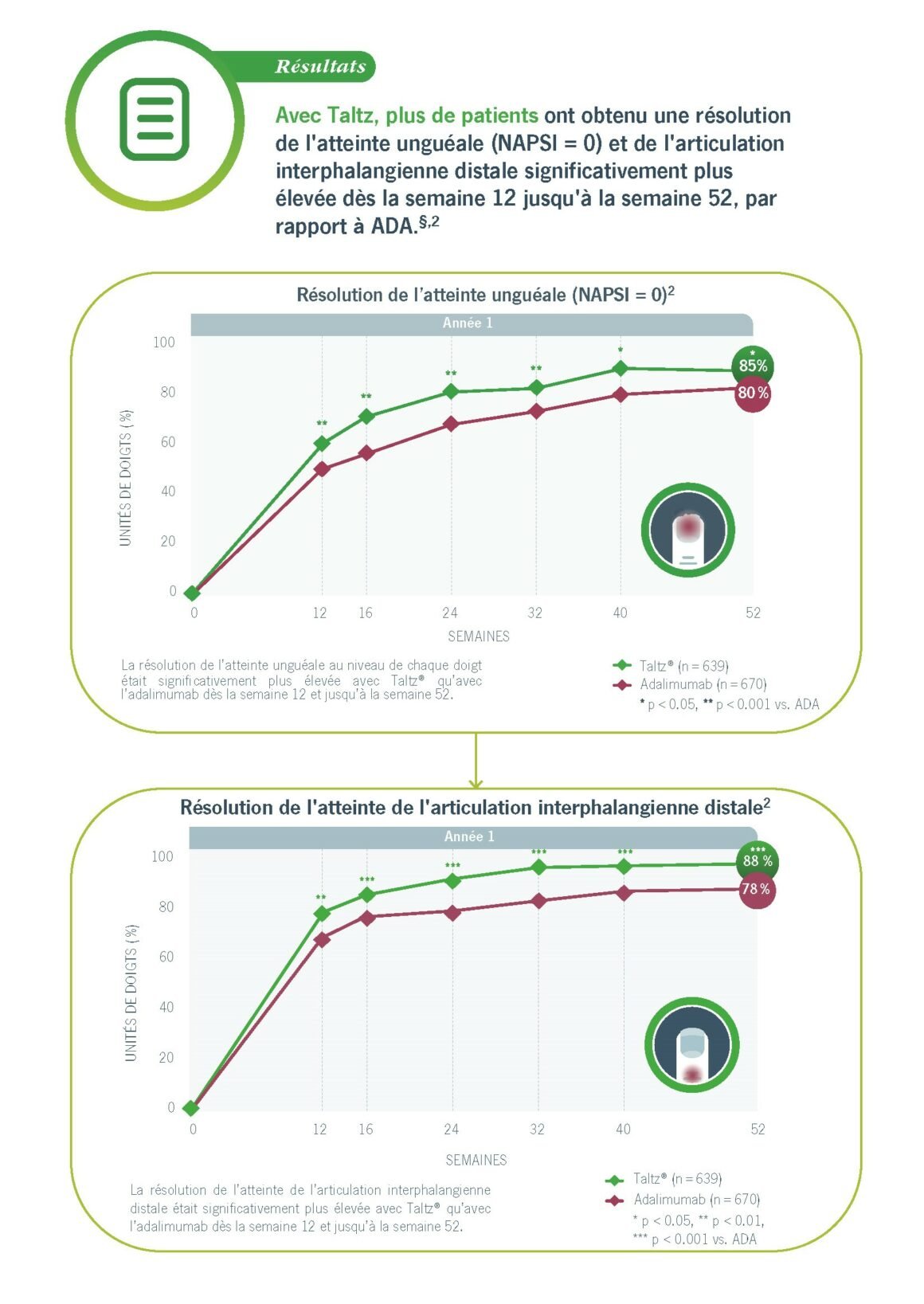
SPIRIT H2H: PLUS DE PATIENTS traités avec Taltz® ont montré une RÉSOLUTION DE L'ATTEINTE UNGUÉALE ET ARTICULAIRE À LA SEMAINE 12 vs. ADALIMUMAB, avec une amélioration continue jusqu'à la semaine 522
Objectif
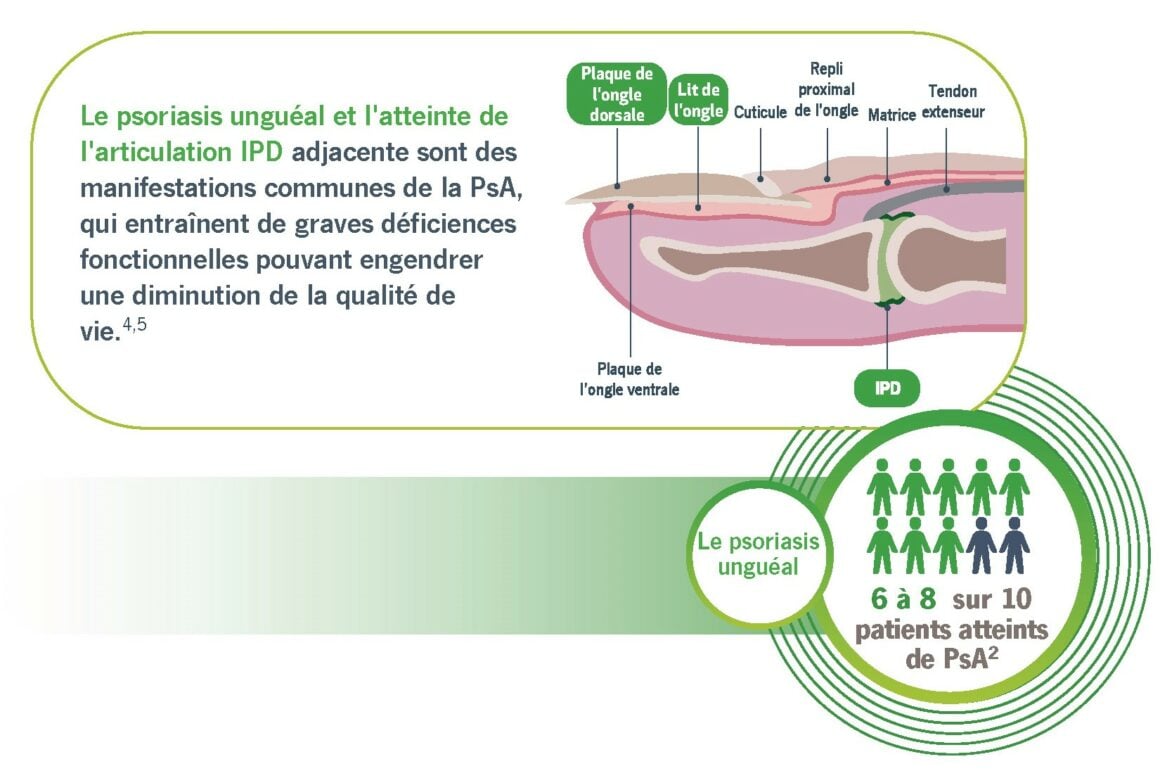
L’objectif de cette analyse post-hoc était d’évaluer l’effet de Taltz et ADA pour chaque doigt individuellement, dans l’amélioration de l’atteinte unguéale et articulaire, chez les patients souffrant d’arthrite psoriasique (PsA) avec atteinte concomitante de l’ongle et de l’articulation interphalangéale distale (IPD).2
Méthodes : SPIRIT-H2H Conception de l’étude3
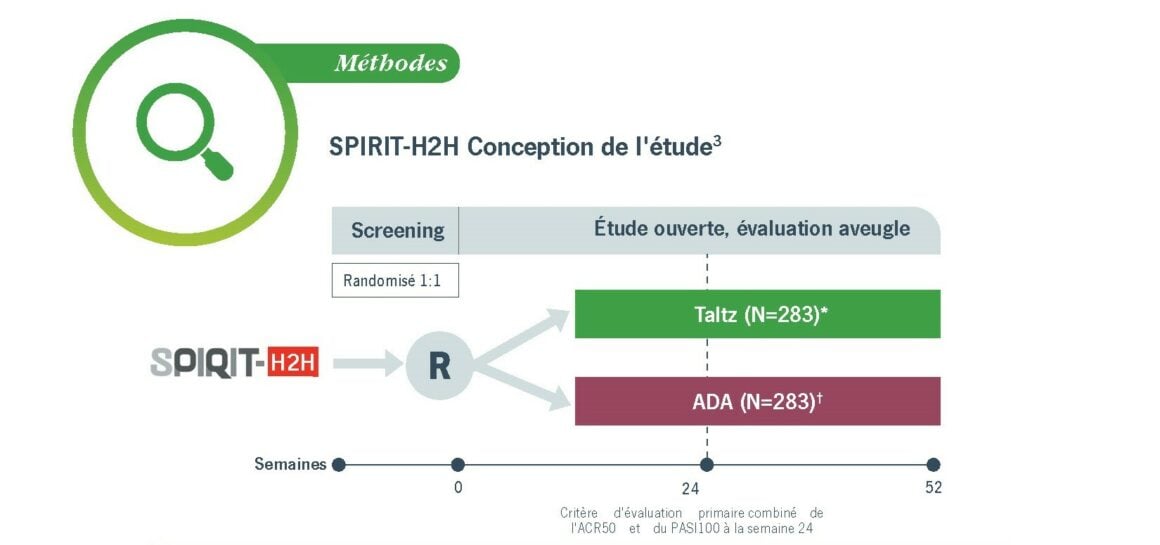
- Randomisation stratifiée en fonction de l’utilisation de csDMARD au début de l’étude et de l’atteinte modérée-à-sévère du psoriasis en plaque‡ au début de l’étude
- Dosage suivant l’indication, basé sur la présence ou l’absence d’un psoriasis modéré-à-sévère.
- Les patients SPIRIT-H2H ont été évalués pour la sensibilité et le gonflement des articulations au début de l’étude et aux semaines 4, 8, 12, 16, 24, 32, 40 et 52.2
- Les patients SPIRIT-H2H ont été évalués pour le psoriasis des ongles au début de l’étude et aux semaines 12, 16, 24, 32, 40 et 52.2
Ci-dessous une courte vidéo dans laquelle le professeur McGonagle explique les résultats
de l’analyse post-hoc :
Le lit et la matrice de l’ongle se sont tous deux significativement améliorées :
- Chez un pourcentage plus élevé de patients traités par Taltz, l’atteinte unguéale a disparu à la
semaine 24 par rapport à l’ADA et l’amélioration s’est poursuivie jusqu’à la semaine 52.2 - Chez les patients présentant une atteinte psoriasique unguéale et de l’arthrose IPD, Taltz s’est avéré plus efficace pour éliminer l’atteinte unguéale au niveau de chaque doigt.2
*Tous les patients ayant été traités par Taltz ont reçu une dose initiale de 160 mg, à la semaine 0. Les patients qui ont atteint le critère pour un psoriasis modéré-à-sévère ont reçu Taltz® Q2W des semaines 2 à 12 et Taltz® Q4W ensuite. Les patients ne présentant pas de psoriasis sévère ont reçu Taltz Q4W à partir de la semaine 4.
†Les patients ayant été traité à l’ADA et qui répondaient aux critères de psoriasis modéré-à-sévère ont reçu une dose initiale de 80 mg, suivie d’une dose initiale de Q2W 40 mg à la semaine 1. Les patients ayant été traités à l’ADA et qui ne répondaient pas aux critères du psoriasis modéré-à-sévère ont reçu une dose initiale de 40 mg, suivie d’une dose de Q2W 40 mg à partir de la semaine 2.
‡Le psoriasis en plaques modéré-à-sévère a été défini par un PASI ≥12, un sPGA ≥3 et une BSA ≥10%
§ Les données manquantes ont été imputées à l‘aide de la méthode NRI. Les différences significatives entre le traitement par Taltz et le traitement par ADA sont indiquées par P < 0,05, P < 0,01 et P < 0,001. Les effets indésirables les plus fréquemment rapportés ont été des infections des voies respiratoires supérieures (y compris la nasopharyngite et la pharyngite) (38.7 %)* et des réactions au site d’injection (19.2 %)**. La plupart des réactions étaient d’intensité légère à modérée. ** fréquence dans le psoriasis en plaques; la fréquence intégrée pour toutes les indications est de 36.6 % # Fréquence dans la spondylarthrite axiale; la fréquence intégrée pour toutes les indications est de 16.3 %.
INDICATIONS1
Psoriasis en plaques (PsO) : Taltz® est indiqué dans le traitement du psoriasis en plaques modéré à sévère chez les patients adultes qui n’ont pas répondu à d’autres traitements systémiques (y compris la ciclosporine ou le méthotrexate, ou la puvathérapie) ou qui ne peuvent pas les suivre en raison de contre-indications ou d’intolérance.
Arthrite psoriasique (PsA) : Taltz®, seul ou en association avec des antirhumatismaux modificateurs de la maladie (DMARD, disease-modifying anti-rheumatic drugs) conventionnels, est indiqué chez les patients adultes atteints d’arthrite psoriasique (PsA) active n’ayant pas suffisamment répondu à un traitement par un ou plusieurs DMARD ou ne l’ayant pas toléré.
Abbréviations
ACR50, American College of Rheumatology Amélioration de 50 % à la fois du nombre de tendons et du nombre d’articulations enflées ; ADA, adalimumab; BSA, body surface area; csDMARD, conventional synthetic disease-modifying anti-rheumatic drug; IPD, articulation Interphalangéale distale; MTX, methotrexate; NAPSI, Nail Psoriasis Severity Index; PASI100, Psoriasis Area and Severity Index 100; PsA, Arthrite psoriasique; PsO, Psoriasis; Q2W, toutes les deux semaines ; Q4W, toutes les quatre semaines ; sPGA, Static Physician’s Global Assessment.
Taltz® (ixekizumab) solution injectable
I: Traitement du psoriasis en plaques modéré à sévère chez les patients adultes et chez les enfants et les adolescents dès 6 ans ayant un poids corporel d’au moins 25 kg, qui n’ont pas répondu à d’autres traitements systémiques (y compris la ciclosporine ou le méthotrexate ou la puvathérapie) ou qui ne peuvent pas les suivre en raison de contre-indications ou d’intolérance. Seul ou en association avec des antirhumatismaux modificateurs de la maladie (DMARD) conventionnels, traitement de l’arthrite psoriasique active chez les patients adultes n’ayant pas suffisamment répondu à un traitement par un ou plusieurs DMARDs ou ne l’ayant pas toléré. Traitement de la spondylarthrite ankylosante active sévère chez les patients adultes n’ayant pas suffisamment répondu à une thérapie conventionnelle (par ex. anti-inflammatoires non stéroïdiens [AINS]) ou ne la tolérant pas. Traitement de la spondylarthrite axiale non radiographique active sévère chez les adultes qui ont répondu de manière inadéquate aux AINS. Les patients doivent présenter des signes objectifs d’inflammation comme indiqué par l’imagerie par résonance magnétique (IRM) et une élévation de la protéine C-réactive (CRP).
Po: Injection sous-cutanée. Psoriasis en plaques chez l’adulte : 160 mg à la semaine 0, suivie de 80 mg aux semaines 2, 4, 6, 8, 10 et 12, puis 80 mg toutes les 4 semaines. Chez les patients <100 kg, un schéma posologique alternatif avec 160 mg à la semaine 0 et dès la semaine 2, 80 mg toutes les 4 semaines peut être pris en considération. Psoriasis en plaques chez les enfants et les adolescents (dès 6 ans) : Poids > 50 kg : 160 mg à la semaine 0, suivie de 80 mg toutes les 4 semaines ; poids 25-50 kg : 80 mg à la semaine 0, suivie de 40 mg toutes les 4 semaines. Arthrite psoriasique : 160 mg à la semaine 0, suivie de 80 mg toutes les 4 semaines. Spondylarthrite ankylosante : 80 mg toutes les 4 semaines.
CI : Hypersensibilité sévère. Infections actives graves (p.ex. tuberculose active, sepsis, infection opportuniste grave).
Pr/MG: Prudence chez les patients atteints d’une infection chronique ou active ou ayant des antécédents d’infections récidivantes. En cas de réaction d’hypersensibilité grave, l’administration de Taltz doit être interrompue immédiatement et un traitement approprié instauré. Taltz n’est pas recommandé chez les patients atteints de maladie inflammatoire de l’intestin. Si un patient développe des signes et symptômes de maladie inflammatoire de l’intestin ou d’exacerbation d’une maladie inflammatoire de l’intestin préexistante, Taltz doit être interrompu et un traitement médical approprié doit être initié. Prudence en cas de comorbidité psychiatrique (p.ex. dépression). Prudence chez les patients atteints de axSpa et à risque de MACE. Taltz ne doit pas être utilisé avec des vaccins vivants. L’administration concomitante de Taltz avec d’autres médicaments biologiques n’est pas recommandée.
IA: La sécurité de Taltz en association avec d’autres agents immunomodulateurs ou de la photothérapie ainsi qu’avec des vaccins vivants n’a pas été étudiée.
G/A : Pendant la grossesse et chez les femmes en âge de procréer qui n’utilisent pas de contraception efficace, Taltz ne doit pas être administré, à moins d’une nécessité absolue. Les patientes doivent être informées d’utiliser des méthodes contraceptives efficaces et de ne pas allaiter pendant au moins 10 semaines après la dernière dose de Taltz. Il convient de décider soit d’arrêter l’allaitement, soit d’interrompre le traitement par Taltz en tenant compte du bénéfice de l’allaitement pour l’enfant et de celui du traitement pour la mère.
EI: Très fréquent: infection des voies respiratoires supérieures, réactions au site d’injection. Fréquent : infection fongique à dermatophytes (teigne), herpès simplex (mucocutané), candidose buccale, rhinite, grippe, conjonctivite, douleurs oropharyngées, nausées, diarrhée, enzymes hépatiques élevées, urticaire. Occasionnel : réactions anaphylactiques, candidose oesophagienne, neutropénie, thrombocytopénie, maladie de Crohn, colite ulcéreuse. EI qui ont été observés plus fréquemment que chez les adultes ou sont survenus spécifiquement chez les enfants et les adolescents: Très fréquent: réactions d’hypersensibilité. Fréquent : neutropénie, maladie de Crohn, dermatite, rash, eczéma, fièvre. Occasionnel : bronchospasme.
P: Taltz 80 mg 1 ou 2 stylo(s) prérempli(s) / 1 ou 2 seringue(s) préremplie(s). Catégorie de remise B. Pour de plus amples informations, consulter www.swissmedicinfo.ch.
Eli Lilly (Suisse) SA, ch. des Coquelicots 16, CP 580, 1214 Vernier (GE). V08-2023
Les spécialistes de la santé peuvent demander les références auprès de l’entreprise en tout temps.
RÉFERENCES :
- Taltz® Fachinformation, www.swissmedicinfo.ch.
- McGonagle D, et al. Association of the clinical components in the distal interphalangeal joint synovio-entheseal complex and subsequent response to ixekizumab or adalimumab in psoriatic arthritis. Rheumatology (Oxford). 2024 Feb 10:keae060. doi: 10.1093/rheumatology/keae060. Epub ahead of print. Erratum in: Rheumatology (Oxford). 2024 Mar 28;: PMID: 38341669.
- Smolen JS et al. Multicentre, randomised, open-label, parallel-group study evaluating the efficacy and safety of ixekizumab versus adalimumab in patients with psoriatic arthritis naïve to biological disease-modifying antirheumatic drug: final results by week 52. Ann Rheum Dis. 2020;79(10):1310-1319.
- Lai T.L. et al. Psoriatic nail involvement and its relationship with distal interphalangeal joint disease. Clin Rheumatol. 2016; 35(8):2031-2037. Epub 2016 Jun 1. PMID: 27251673.
- Krajewska-Włodarczyk M. et al. Distal interphalangeal joint extensor tendon enthesopathy in patients with nail psoriasis. Sci Rep. 2019; 9(1):3628.
Ce contenu a été développé, organisé et financé par Eli Lilly and Company.

© 2024 Eli Lilly (Suisse) SA,
Chemin des Coquelicots 16, P.O. 580, CH-1214 Vernier.
Tous droits réservés.
Destiné exclusivement aux professionnels de la santé de Suisse.
Pour plus d’informations sur nos produits Lilly & nos domaines thérapeutiques, veuillez contacter notre service d’information médicale :
Heures de service: Lundi-Vendredi, 08h30-15h00
Téléphone: +41 44 654 57 52
E-mail: ch_medinfo@lilly.com
PP-IX-CH-1037/04.2024

