Les lymphomes sont responsables de 3,8% de tous les nouveaux diagnostics de cancer. Selon la classification actuelle de l’OMS, il existe plus de 75 entités lymphatiques différentes, qui sont traitées différemment. Le traitement du lymphome diffus à grandes cellules B (DLBCL), du lymphome périphérique à cellules T et du lymphome hodgkinien classique a beaucoup évolué au cours des dernières années.
Selon les anciennes classifications, les lymphomes sont traditionnellement divisés en lymphomes hodgkiniens et non hodgkiniens. Cette classification est encore utilisée dans certaines statistiques et sert de base au recensement national de l’incidence (www.nkrs.ch/de/stat). Selon cette collecte de données, près de 1600 patients par an en Suisse sont atteints d’un lymphome non hodgkinien et environ 250 d’un lymphome hodgkinien. Les lymphomes sont responsables de 3,8% de tous les nouveaux diagnostics de cancer. La mortalité annuelle est d’un peu plus de 500 décès. Les lymphomes représentent donc 3,2% de tous les décès par cancer.
Classification actuelle de l’OMS et présentation clinique
L’Organisation mondiale de la santé (OMS) a déjà établi plusieurs classifications des lymphomes et a de plus en plus remplacé le terme de lymphome non hodgkinien par une dénomination claire et un sous-typage des différentes entités. La classification de 2016, actuellement en vigueur, comprend plus de 75 entités lymphatiques [1]. Elle s’oriente sur les différentes morphologies, la présentation clinique et, de plus en plus, sur les aspects moléculaires ou génétiques.
Cette classification est à mon avis très importante, car tant le diagnostic, le pronostic que le traitement diffèrent parfois fondamentalement. Les termes indolent et agressif doivent aujourd’hui être utilisés en premier lieu en fonction du comportement de croissance du lymphome concerné. Environ 50% des lymphomes sont des lymphomes à croissance lente et sont donc considérés comme indolents. Les 50% restants concernent des lymphomes à croissance rapide et donc plutôt agressifs dans leur évolution. Dans la présente compilation, j’aimerais aborder brièvement le traitement de certains lymphomes agressifs.
Traitement du lymphome diffus à grandes cellules B (DLBCL)
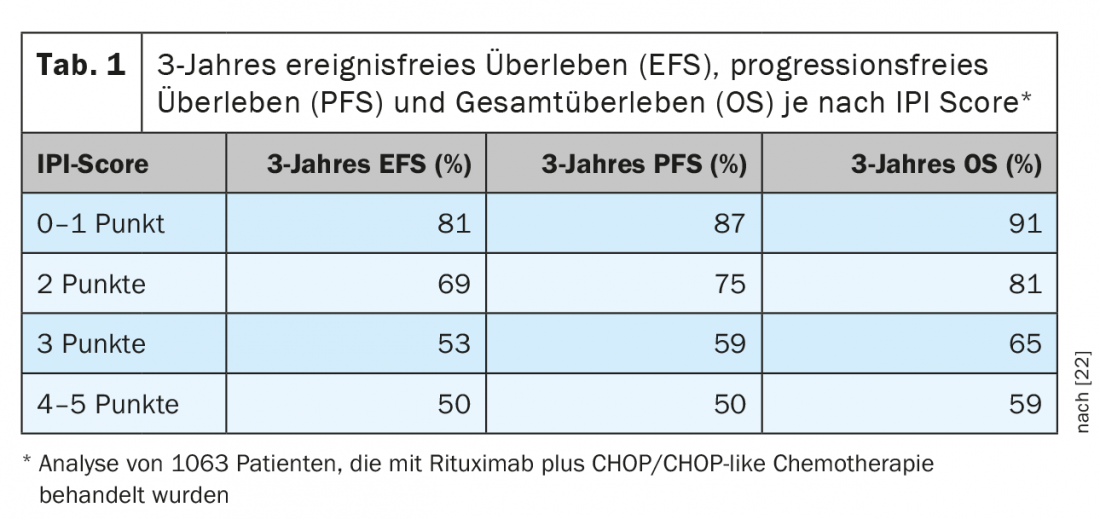
Les DLBCL représentent 25 à 30% de tous les lymphomes, ce qui en fait l’entité lymphomateuse la plus fréquente. Ils font partie des lymphomes à cellules B agressifs. Dans la plupart des cas, l’objectif du traitement devrait être le contrôle à long terme de la maladie ou la guérison. Cela n’est généralement obtenu qu’au moyen d’une immunochimiothérapie intensive, qui repose sur l’association d’un anticorps spécifique du CD20 et d’une polychimiothérapie. Un régime de type CHOP ou CHOP-like est typiquement utilisé. En ce qui concerne les prévisions, il existe désormais différents systèmes d’évaluation. La stratification du risque la plus longtemps utilisée, et qui reste en grande partie valable, repose sur l’“indice pronostique international (IPI)” (tableau 1) [2]. Pour les patients de moins de 60 ans, on utilise souvent l’indice pronostique international adapté, appelé “age-adjusted International Prognostic Index (aaIPI)”. Sur la base de cette classification, les patients atteints de DLBCL peuvent être répartis en quatre groupes. Alors que les personnes de plus de 60 ans ne font pas l’objet d’un sous-typage supplémentaire, il existe trois groupes chez les personnes de moins de 60 ans : Les patients précoces avec un pronostic favorable (aaIPI 0), les patients plus jeunes avec un pronostic défavorable (aaIPI 1 et/ou Bulk) et un troisième groupe de patients dits à haut risque (aaIPI ≥2).
Pour le traitement des patients âgés (>60 ans), six cycles de rituximab + CHOP sont souvent utilisés, principalement à des intervalles de 21 jours et rarement tous les 14 jours. La supériorité d’un régime de 14 jours constatée par le groupe d’étude allemand DSHNL [3] n’a pu être confirmée ni par le groupe d’étude anglais [4], ni par le groupe d’étude français [5], bien qu’il n’y ait pas de comparaison directe entre les études. L’avantage de huit cycles de R-CHOP par rapport à six cycles dans le régime de 21 jours n’a pas été testé de manière randomisée. Cependant, les analyses rétrospectives de l’étude randomisée de phase III GOYA [6], dans laquelle les centres avaient le choix entre six et huit cycles, n’ont pas montré de différence en termes d’efficacité. Ainsi, six cycles de R-CHOP tous les 21 jours sont souvent considérés comme la norme. De même, l’administration supplémentaire de deux fois l’immunothérapie en tant que septième et huitième cycle de traitement sous la forme de deux autres administrations de rituximab dans le cadre du “schéma 6 + 2” ne s’est pas révélée supérieure dans l’étude PETAL [7].
Chez les jeunes patients de moins de 60 ans, en l’absence de facteurs de risque et avec un pronostic favorable (aaIPI 0, pas de bulk), l’étude FLYER récemment publiée [8] a montré que quatre cycles de R-CHOP-21 permettaient d’obtenir une excellente survie sans progression (PFS) et une excellente survie globale (OS). Cela permet d’obtenir une réduction de la dose et une diminution significative de la morbidité liée au traitement, avec des taux de guérison élevés (PFS à 3 ans 96% vs. 93%). Pour le deuxième groupe de personnes de moins de 60 ans avec aaIPI 1 et/ou bulk, six cycles de R-CHOP-21 avec radiothérapie de consolidation du bulk initial sont considérés comme la norme. Dans l’étude MINT du DSHNHL [9], la survie sans événement à 6 ans (EFS) sous ce traitement était de 71%. Le groupe d’étude français GELA/LYSA a montré pour ce collectif une supériorité du schéma R-ACVBP [10] par rapport au R-CHOP-21. Ce résultat doit toutefois être remis en question, car contrairement à l’étude DSHNHL, aucune radiothérapie n’a été utilisée.
Les patients plus jeunes à haut risque (aaIPI ≥ 2) continuent malheureusement à présenter un risque de récidive plus élevé et donc des chances de guérison plus faibles. Le traitement optimal pour ce groupe de patients n’est pas défini de manière uniforme. Certains groupes d’étude utilisent le schéma R-CHOP-21 déjà mentionné [4]. D’autres centres d’étude, comme certains centres américains et européens, effectuent a priori une thérapie de consolidation à haute dose avec autogreffe de cellules souches dans la première ligne de traitement. Le DSHNHL a testé huit cycles de R-CHOEP-14 contre un concept de triple greffe dans le cadre de l’étude MEGA-CHOEP [11]. Une supériorité (EFS à 3 ans 69,5% vs 61,4%) du bras 8 x R-CHOEP-14 a été démontrée. Dans la zone d’application américaine, le régime R-DA-EPOCH est souvent utilisé à la place du régime R-CHOEP. En général, la plupart des centres favorisent un régime de traitement plus intensif en termes de dose qu’un schéma R-CHOP standard.
Le traitement des jeunes patients à haut risque, en particulier, montre que le traitement de première ligne du DLBCL est déterminant pour le pronostic. En cas de rechute de la maladie dans les 12 à 18 mois, le pronostic est souvent défavorable et seuls quelques patients peuvent encore obtenir des rémissions à long terme. Toutefois, si les patients n’ont pas eu de récidive dans les 18 à 24 mois suivant la fin du traitement, les contrôles à long terme de la maladie sont nettement plus fréquents, avec des taux de guérison élevés. Cela montre qu’une approche aussi curative que possible devrait être adoptée dans le cadre du traitement de première ligne. Ces dernières années, la biologie moléculaire nous a permis de mieux comprendre les mécanismes pathologiques sous-jacents à la maladie et plusieurs études ont étudié la valeur thérapeutique de différents inhibiteurs de signal, en se basant sur le régime R-CHOP déjà mentionné et établi. Ainsi, le bortezomib, un inhibiteur de protéase, a notamment été testé en Suisse [12]. Malheureusement, aucun avantage thérapeutique n’a été constaté dans la population globale. L’ajout de l’immunomodulateur lénalidomide au R-CHOP n’a pas non plus montré d’avantage significatif dans l’étude prospective randomisée ROBUST [13]. Des études sont en cours sur l’utilisation d’inhibiteurs de BTK (par exemple, l’ibrutinib) [14], ainsi que d’inhibiteurs de BCL2 (venetoclax) [15]. Les premières études de phase II ou les analyses de sous-groupes ont suggéré certains avantages pour ces deux dernières substances. Cependant, il n’a pas encore été prouvé que ces agents présentent une supériorité significative par rapport au standard actuel et, par conséquent, ni les inhibiteurs de BTK, ni les inhibiteurs de BCL2 ne font actuellement l’objet de notre routine quotidienne. Un nouveau concept thérapeutique s’est avéré efficace en cas de récidive, c’est-à-dire chez les patients âgés après deux traitements antérieurs et chez les patients plus jeunes en règle générale après deux traitements antérieurs, y compris la chimiothérapie. Thérapie à haute dose avec remplacement de cellules souches autologues, établir la technologie CAR T-cell [16]. Celle-ci est disponible en Suisse dans des centres spécialisés.
Traitement des lymphomes périphériques agressifs à cellules T (PTCL)
Les lymphomes à cellules T représentent environ 10% de tous les nouveaux cas de lymphomes dans le monde occidental. La classification histopathologique et moléculaire des différentes entités du lymphome à cellules T est complexe et, malheureusement, en raison de la rareté de la maladie, les données disponibles dans les grandes études randomisées sont souvent très limitées. Le pronostic des lymphomes à cellules T agressifs est généralement moins favorable que celui des lymphomes à cellules B agressifs. Seul le lymphome périphérique à cellules T dit “ALK+ (PTCL)” est souvent considéré comme ayant un pronostic plus favorable. Les autres sous-types de PTCL présentent généralement une évolution rapide de la maladie avec une réponse au traitement souvent de courte durée. La détection de l’antigène CD30 sur les cellules du lymphome est importante pour le traitement de la PTCL. Lorsqu’il est exprimé, l’étude ECHELON-2 montre qu’une amélioration significative de la PFS à 3 ans (57% vs 44%) et de l’OS peut être obtenue en combinant le brentuximab vedotin en tant qu’immunoconjugué et la chimiothérapie CHP [17]. L’étude a comparé ce traitement avec le régime standard courant CHOP. Les centres d’étude ont été libres d’appliquer le traitement pendant six ou huit cycles. Le brentuximab vedotin, comme la vincristine, un alcaloïde de la vinca, possède une neurotoxicité élevée, de sorte que dans le bras expérimental, l’ajout du brentuximab vedotin a nécessité l’arrêt de la vincristine. La chimiothérapie a donc été réduite de CHOP à CHP. Comme nous l’avons déjà mentionné, outre le bénéfice en termes de PFS, un bénéfice en termes d’OS a également été observé. En conséquence, ce traitement est actuellement considéré comme le gold standard pour les PTCL CD30-positifs en première ligne. Malheureusement, d’autres substances thérapeutiques telles que les inhibiteurs HDAC, les immunoconjugués, les anti-métabolites et les chimiothérapies classiques ont une durée d’action très limitée dans le PTCL. C’est pourquoi, après l’échec de traitements lourds, il ne reste souvent que des options palliatives à l’efficacité limitée.
Traitement du lymphome de Hodgkin classique (LHC)
Dans le traitement du lymphome hodgkinien classique, de nombreux collègues suivent les directives du groupe d’étude allemand sur le lymphome hodgkinien (GHSG). Selon la stratification du GHSG, les patients atteints de LHC sont classés en trois groupes de risque. La dernière génération d’études achevées et publiées comprend les études HD16-HD18 sur le traitement des patients à un stade précoce (HD16), intermédiaire (HD17) et avancé (HD18). L’étude HD16 a évalué la possibilité de renoncer à la radiothérapie de consolidation en cas de TEP négative après deux cycles d’ABVD (dite “TEP2 négative”). Selon les résultats de l’étude, la radiothérapie ne devrait pas être supprimée, car la PFS à 5 ans passe de 93,4% avec radiothérapie à 86% sans radiothérapie, ce qui signifie qu’il faut s’attendre à un résultat thérapeutique significativement moins bon en cas de suppression de la radiothérapie [18].
Au stade intermédiaire, une question similaire a été abordée dans le cadre de l’étude HD17 [19]. Pour les patients concernés, la chimiothérapie standard comprend deux cycles de BEACOPPPesc (BEACOPPesc), suivis de deux cycles d’ABVD. Après ces quatre cycles de traitement, un PET-CT est classiquement réalisé (appelé “PET4”). Dans l’étude HD17, la radiothérapie habituellement administrée a été supprimée en cas de PET4 négatif. En utilisant ce régime thérapeutique, la PFS à 5 ans a été de 97% dans le bras standard (avec radiothérapie) et de 95,1% dans le bras expérimental, c’est-à-dire en omettant la radiothérapie en cas de PET4 négatif. Par conséquent, le traitement sans radiothérapie n’était pas inférieur au traitement standard lorsque les résultats de la TEP le permettaient. Selon cette étude, il est donc possible de renoncer à la radiothérapie de consolidation en cas de PET4 négatif après quatre cycles de chimiothérapie.
Les données de l’étude HD18 sur le traitement des stades avancés du LHC ont déjà été présentées lors de plusieurs congrès [20]. Dans le cadre de l’étude, six cycles de BEACOPPesc ont été définis comme la norme thérapeutique du GHSG. Dans le bras expérimental, en cas de TEP2 négative, on a vérifié si deux cycles supplémentaires de BEACOPPesc – soit quatre au total et non six – étaient suffisants. L’étude a montré une PFS à 5 ans de 91,2% dans le bras standard avec six cycles de BEACOPPesc. Dans le bras guidé par le PET2, un résultat comparable de 91,8% a été obtenu. Ainsi, en cas de PET2 négatif, il est désormais possible de réduire la dose à un total de quatre cycles. Il s’agit d’un progrès important, notamment en raison du jeune âge fréquent des patients atteints de LHC. La réduction de la dose permet de lutter contre la morbidité associée au traitement et notamment contre l’infertilité due à la chimiothérapie. Il est à espérer que la nouvelle norme de traitement réduira le nombre de néoplasies secondaires au cours de la vie.
Le LHC est l’une des entités présentant les taux de réponse les plus élevés au traitement par inhibiteur de PD1. En ce qui concerne les récidives de LHC, je pense que la publication de l’étude KEYNOTE-204 est importante pour la pratique clinique quotidienne [21]. Cette étude a testé l’utilisation de l’inhibiteur PD1 pembrolizumab vs brentuximab vedotin chez des patients atteints de LHC en rechute dans le cadre d’une comparaison randomisée. Dans le cadre de l’analyse présentée à la réunion annuelle 2020 de l’ASCO, il a été fait état d’une supériorité du blocage de PD1, avec un taux de réponse plus élevé (65% contre 54%) et une PFS médiane plus longue de 13,2 contre 8,3 mois. De plus, le blocage de PD1 a montré une toxicité nettement plus faible, notamment une neurotoxicité, de sorte que, outre l’efficacité, la tolérance plaide en faveur d’une utilisation précoce de l’immunothérapie dans le traitement des récidives de LHC.
Messages Take-Home
- Dans le traitement des lymphomes agressifs à cellules B, l’utilisation de l’immunochimiothérapie permet d’obtenir des taux de guérison élevés.
- Le traitement des lymphomes agressifs à cellules B est stratifié en fonction du risque avec 4-6(8) cycles d’immunochimiothérapie (R-CHOP ou R-CHOP-like).
- Les lymphomes agressifs à cellules T ont généralement un pronostic nettement moins bon que les lymphomes agressifs à cellules B. Les lymphomes à cellules B sont plus fréquents et plus graves.
- L’utilisation de l’immunotoxine CD30 brentuximab vedotin en combinaison avec la chimiothérapie CHP est considérée comme la norme dans le PTCL CD30-positif.
- Le LHC est traité par chimiothérapie ou par chimiothérapie et radiothérapie en fonction du stade et du risque, et présente d’excellents taux de guérison. L’objectif des nouvelles approches thérapeutiques est souvent de réduire les doses afin d’éviter la morbidité liée au traitement tout en conservant des taux de guérison élevés.
Littérature :
- Swerdlow SH, et al : WHO classification of tumours of haematopoietic and lymphoid tissue. Révisé 4e éd. Lyon : IARC ; 201.
- The International Non-Hodgkin’s Lymphoma Prognostic Factors Project. Un modèle prédictif pour le lymphome non hodgkinien agressif. N Engl J Med 1993 ; 329 : 987-994.
- Pfreundschuh M, et al : Six versus eight cycles of bi-weekly CHOP-14 with or without rituximab in elderly patients with aggressive CD20+ B-cell lymphoma : a randomised controlled trial (RICOVER-60). Lancet Oncol 2008 ; 9 : 105-116.
- Cunningham D, et al : Rituximab plus cyclophosphamide, doxorubicine, vincristine, et prednisolone chez les patients atteints de lymphome non hodgkinien diffus à grandes cellules B nouvellement diagnostiqué : une comparaison de phase 3 de l’intensification de la dose avec des cycles de 14 jours versus 21 jours. Lancet 2013 ; 381 : 1817-1826.
- Delarue R, et al : Dose-dense rituximab-CHOP comparé au rituximab-CHOP standard chez les patients âgés atteints de lymphome diffus à grandes cellules B (the LNH03-6B study) : un essai randomisé de phase 3. Lancet Oncol 2013 ; 14 : 525-533.
- Sehn LH, et al : A randomized, open-label, phase III study of obinutuzumab or rituximab plus CHOP in patients with previously untreated diffuse large B-cell lymphoma : final analysis of GOYA. J Hematol Oncol. 2020 ; 13(1) : 71-79.
- Schmitz C, et al : Impact de la résection chirurgicale complète sur le résultat dans le lymphome non hodgkinien agressif traité par immunochimiothérapie. Cancer Med 2020 ; 9(22) : 8386-8396.
- Poeschel V, et. al. : Quatre versus six cycles de chimiothérapie CHOP en combinaison avec six applications de rituximab chez les patients atteints de lymphome agressif à cellules B avec un pronostic favorable (FLYER) : un essai randomisé, phase 3, non-infériorité. Lancet.2019 ; 394 (10216) : 2271-2281.
- Pfreundschuh M, et al : CHOP-like chemotherapy with or without rituximab in young patients with good-prognosis diffuse large-B-cell lymphoma : 6-year results of an open-label randomised study of the MabThera International Trial (MInT) Group. Lancet Oncol 2011 ; 12 : 1013-1022.
- Recher C et al. : Chimiothérapie intensive avec ACVBP plus rituximab versus CHOP standard plus rituximab pour le traitement du lymphome diffus à grandes cellules B (LNH03-2B) : An open-label randomised phase 3 trial. Lancet 2011 ; 378 : 1858-1867.
- Schmitz N, et al : Chimiothérapie conventionnelle (CHOEP-14) avec rituximab ou chimiothérapie à haute dose (MegaCHOEP) avec rituximab pour les jeunes patients à haut risque atteints de lymphome agressif à cellules B : Une étude de phase 3 randomisée, en ouvert (DSHNHL 2002-1). Lancet Oncol 2012 ; 13 : 1250-1259.
- Davies A, et al. : Profilage de l’expression génétique du bortézomib ajouté à la chimio-immunothérapie standard pour le lymphome diffus à grandes cellules B (REMoDL-B) : une étude de phase 3 randomisée en ouvert. Lancet Oncol. 2019 ; 20(5) : 649-662.
- Lue JK, O’Connor OA : Une perspective sur l’amélioration du régime R-CHOP : de Mega-CHOP à R-CHOP ROBUSTE, le PHOENIX n’a pas fini de se lever. Lancet Haematol 2020 ; 7(11) : e838-e850.
- Younes A, et al : Essai randomisé de phase III de l’ibrutinib et du rituximab plus cyclophosphamide, doxorubicine, vincristine, et prednisone dans le lymphome diffus à grandes cellules B du centre non germinal. J Clin Oncol 2019 ; 37(15) : 1285-1295.
- Morschhauser F, et al : A phase 2 study of venetoclax plus R-CHOP as first-line treatment for patients with diffuse large B-cell lymphoma. Blood 2021 ; 137(5) : 600-609.
- Schuster SJ, et al : Cellules T réceptrices d’antigènes chimériques dans les lymphomes réfractaires à cellules B. N Engl J Med 2017 ; 377 : 2545-2554.
- Horwitz S, et al : Groupe d’étude ECHELON-2. Brentuximab vedotin avec chimiothérapie pour le lymphome périphérique à cellules T CD30-positif (ECHELON-2) : un essai global, en double aveugle, randomisé, de phase 3. Lancet 2019 ; 393(10168) : 229-240.
- Fuchs M, et al : Positron emission tomography-guided treatment in early-stage favourable Hodgkin Lymphoma : Final results of the international, randomized phase III HD16 trial by the German Hodgkin Study Group. J Clin Oncol 37 2019 ; 31 : 2835-2845.
- Borchmann P, et al. : PET-guided omission of radiotherapy in early-stage unfavourable Hodgkin lymphoma (GHSG HD17) : a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol 2021 ; 22(2) : 223-234.
- Borchmann P, et al : PET-guided treatment in patients with advanced-stage Hodgkin’s lymphoma (HD18) : final results of an open-label, international, randomised phase 3 trial by the German Hodgkin Study Group. Lancet 2018 ; 390(10114) : 2790-2802.
- Kuruvilla J, et al : KEYNOTE-204 : Étude randomisée, en ouvert, de phase III, du pembrolizumab (pembro) versus brentuximab vedotin (BV) dans le lymphome hodgkinien classique en rechute ou réfractaire (LHC R/R). Présenté au 2020 American Society of Clinical Oncology (ASCO) Virtual Scientific Program. May 29-31, 2020. abstract 8005.
- Ziepert M, et al : Standard International prognostic index remains a valid predictor of outcome for patients with aggressive CD20+ B-cell lymphoma in the rituximab era. J Clin Oncol. 2010 ; 28 : 2373.
InFo ONKOLOGIE & HÉMATOLOGIE 2021 ; 9(2) : 10-13