Le succès du traitement de l’AVC dépend essentiellement du temps qui s’écoule entre le début des symptômes et la recanalisation du vaisseau obstrué. Pour cela, il est important que les symptômes suspects d’AVC soient rapidement identifiés et qu’une orientation immédiate vers un centre spécialisé soit effectuée. Le traitement standard de l’AVC aigu est la thrombolyse systémique par activateur du plasminogène recombinant (rtPA) dans les 4,5 heures suivant le début des symptômes, la revascularisation endovasculaire étant un complément à la thrombolyse systémique à recommander, en particulier pour les occlusions proximales.
L’accident vasculaire cérébral (AVC) est une urgence médicale qui se manifeste par l’apparition d’un déficit neurologique focal aigu, tel qu’un trouble de la parole, une hémiplégie ou une perte de vision d’apparition soudaine. Il est l’une des principales causes de mortalité et de morbidité dans le monde. 85% des accidents vasculaires cérébraux sont d’origine ischémique et résultent donc d’un trouble circonscrit de la circulation sanguine dans le cerveau. Il n’est pas possible de les différencier cliniquement avec certitude des 15% restants, qui sont causés par des hémorragies intracrâniennes, sans recourir au diagnostic par appareil. Comme les concepts thérapeutiques de l’AVC ischémique sont fondamentalement différents de ceux de l’AVC hémorragique, et que le concept “time is brain” s’applique essentiellement au premier, nous ne traiterons plus que de l’AVC ischémique dans la suite de cet article.
Concept de pénombre
Théorie : la notion de “time is brain” dans l’AVC ischémique repose en grande partie sur le concept de pénombre ischémique, tel que décrit par exemple par Astrup et al. 1981. La pénombre ischémique est définie comme une zone du cerveau fonctionnellement altérée, mais structurellement intacte, qui entoure généralement un noyau d’infarctus. Dans la pénombre ischémique, un approvisionnement encore rudimentaire des cellules en oxygène et en nutriments, par exemple via des vaisseaux collatéraux, est possible, de sorte que la mort cellulaire est au moins retardée. Ce qui est crucial dans la pénombre ischémique, c’est qu’elle peut évoluer vers un état de lésions permanentes et irréversibles en un temps relativement court. Cette fenêtre de temps permet de recanaliser un vaisseau obstrué et de sauver ainsi la zone du cerveau correspondante (penumbra).
Une expérience animale a montré que les troubles des fonctions neuronales surviennent lorsque la perfusion régionale descend en dessous d’une valeur d’environ 20 ml/100 g/min de sang et qu’ils sont réversibles lorsque la perfusion est rétablie. Si la circulation sanguine continue de baisser ou si cet état de diminution de la circulation sanguine persiste, la zone du cerveau concernée subit des dommages irréversibles [1]. Cette cascade d’ischémie consiste en une dépolarisation et une évacuation des acides aminés toxiques. L’afflux d’ions calcium et sodium provoque un œdème cytotoxique. Cela active les enzymes protéolytiques et libère des radicaux libres, ce qui provoque des dommages cellulaires supplémentaires. Ce processus peut s’étendre à la pénombre, ce qui peut entraîner une augmentation de la taille de l’infarctus [2].
Le concept de “time is brain” basé sur ces observations est également étayé par des estimations selon lesquelles chaque minute de non traitement d’un AVC entraîne potentiellement la mort de 1,9 millions de neurones et de 14 milliards de synapses [3].
Aujourd’hui, l’imagerie multimodale permet de déterminer en quelques minutes le tissu ischémique d’un patient victime d’un AVC. le noyau de l’infarctus et la pénombre (Fig. 1a-d, Fig. 2a-d). Cela est possible grâce à la tomodensitométrie (CT) et à l’imagerie par résonance magnétique (IRM). D’autres techniques d’imagerie comme le PET et le SPECT le permettraient également, mais elles ne sont pas disponibles suffisamment rapidement en situation d’urgence.
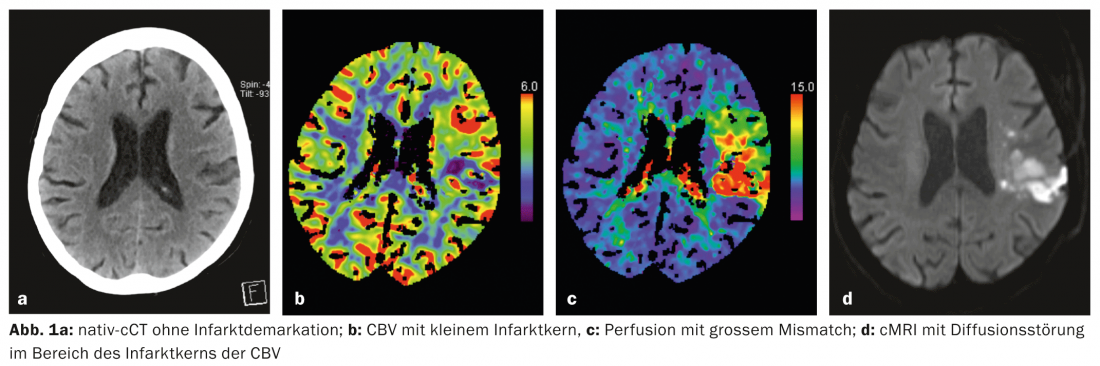
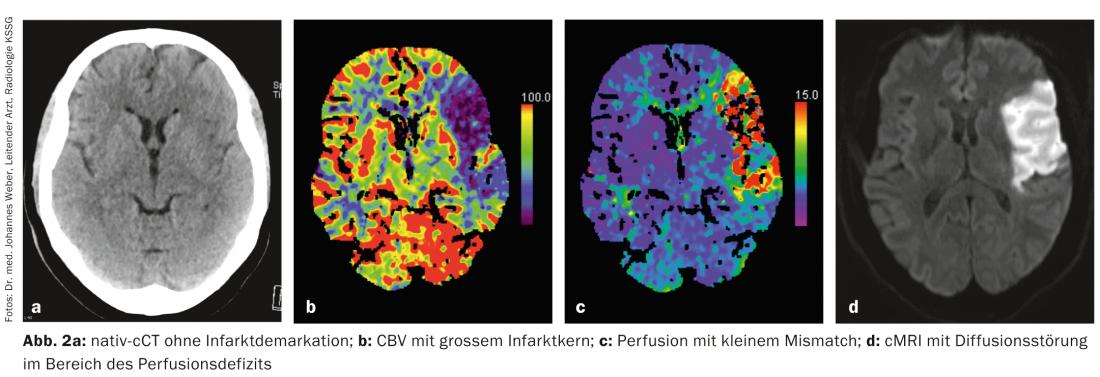
Pratique : En médecine de l’AVC, il faut faire tout ce qui peut empêcher l’extension de l’infarctus cérébral dans le sens d’un infarctus de la pénombre. Un élément essentiel du traitement de l’AVC est la recanalisation la plus rapide possible du vaisseau obstrué. Le seul traitement autorisé à cet effet est la thrombolyse systémique avec un activateur du plasminogène recombinant (altéplase ; rtPA) dans les 4,5 heures suivant le début des symptômes. Dans certains cas sélectionnés, une thrombectomie mécanique peut également être réalisée par angiographie interventionnelle.
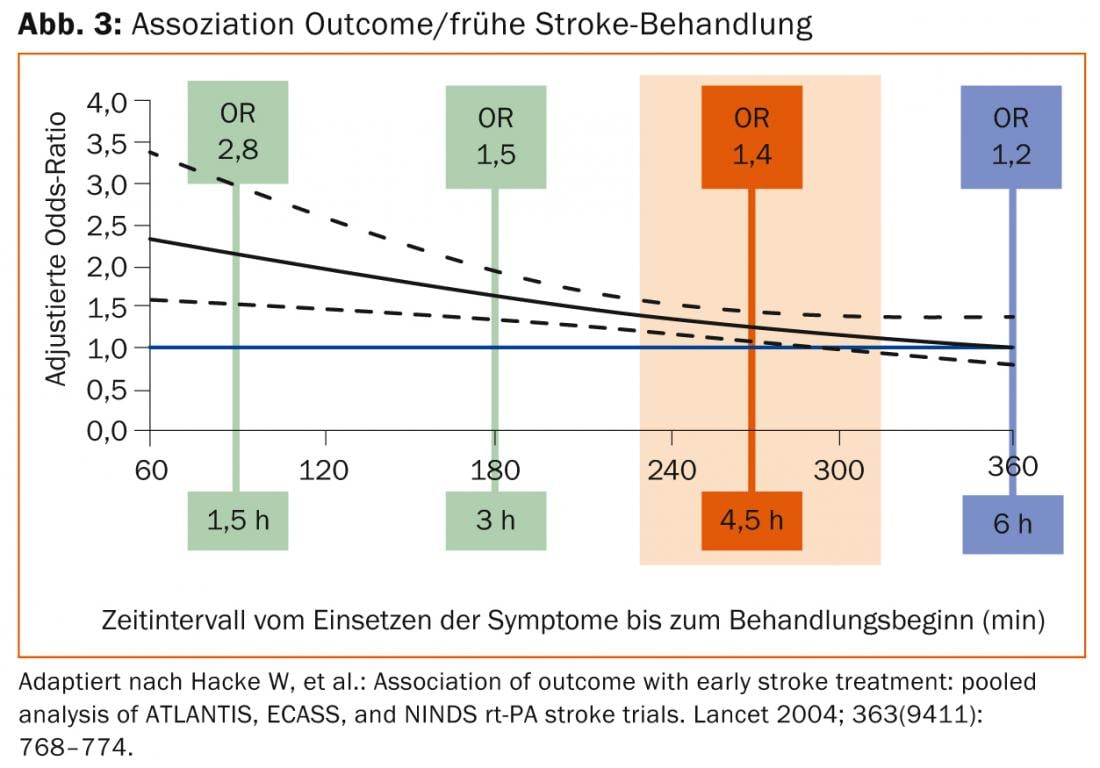
Conformément à la physiopathologie décrite, le succès de cette thérapie dépend clairement du temps. Le “number needed to treat” (NNT) pour un bon résultat est de 4,5 si le traitement par lyse est commencé dans les 90 premières minutes. Celle-ci passe à 9 si le début se situe entre 90 et 180 minutes et à 14,1 si le début se situe entre 180 et 270 minutes (figure 3).
D’autres mesures visant à réduire l’extension de l’infarctus sont une prophylaxie intensive des infections et une réduction agressive des températures corporelles élevées, un contrôle optimal du taux de glucose sanguin, de l’équilibre hydrique et électrolytique ainsi qu’un contrôle optimal de la pression artérielle et de la respiration.
Perte de temps dans le parcours de soins de l’AVC aigu
La chaîne de traitement de l’AVC est divisée en deux phases : la phase de préhospitalisation (du début des symptômes à l’entrée à l’hôpital) et la phase d’hospitalisation (de l’entrée à l’hôpital au début du traitement). C’est sans aucun doute dans la phase de préhospitalisation que l’on perd le plus de temps [4]. Le temps perdu entre l’apparition des symptômes et l’alerte des services de secours dépend du niveau de connaissance de la population sur les symptômes suspects d’AVC et sur la nécessité d’alerter immédiatement les services de secours. Un autre maillon important est le service d’urgence, où la reconnaissance de symptômes suspects d’AVC devrait déclencher un algorithme d’orientation prédéfini avec une orientation immédiate vers une clinique capable de proposer un traitement d’urgence de l’AVC (Stroke Units). Comme l’ont montré des études, un transfert direct vers un centre spécialisé avec une information préalable aussi précise que possible permet de commencer le traitement plus rapidement et d’obtenir ainsi un meilleur résultat [5].
Des échelles telles que la “Cincinnati Prehospital-Stroke Scale” permettent d’identifier les symptômes suspects d’un AVC. Cette échelle évalue trois paramètres cliniques simples (parésie faciale, parésie unilatérale du bras, aphasie) et a une sensibilité de 90% et une spécificité de 66% concernant la présence d’un AVC dans le territoire du courant antérieur [6].
Phase d’hospitalisation
Une fois arrivé à l’hôpital de destination, il convient d’établir rapidement un diagnostic à l’aide d’un laboratoire de base (en particulier l’hémogramme et la coagulation), des paramètres vitaux, d’une anamnèse axée sur les symptômes et d’examens cliniques standardisés (“National Institutes of Health Stroke Scale” [NIHSS]), d’un ECG et, surtout, d’une imagerie cérébrale. Les procédures de l’hôpital cible doivent être structurées de manière efficace afin que
- l’imagerie (scanner ou IRM) peut être réalisée au plus tard 25 minutes après l’arrivée (délai “porte à porte”).
- la thrombolyse systémique peut être effectuée au plus tard 60 minutes après l’arrivée (délai “Door-to-Needle”).
- le patient peut ensuite continuer à être surveillé et traité dans une stroke unit [7].
En cas d’occlusion proximale, la thrombolyse systémique présente de faibles taux de recanalisation, de sorte que la possibilité d’un traitement endovasculaire (par cathéter) doit être évaluée dans ces cas. En cas d’ischémie liée à une thrombose de l’artère basilaire, un tel traitement est même possible jusqu’à douze heures après le début des symptômes. La décision de savoir quels patients peuvent être soumis à ces traitements doit être prise au cas par cas par des spécialistes expérimentés de l’AVC.
Gain de temps en phase de préhospitalisation
Relations publiques : pour obtenir une orientation plus rapide des patients victimes d’un AVC vers une unité d’AVC, les campagnes d’information du grand public, qui doivent être menées à intervalles réguliers, ont fait leurs preuves, car sinon l’effet ne dure pas plus de cinq mois. L’expérience montre que les futures campagnes devraient se concentrer davantage sur des groupes cibles spécifiques tels que les personnes âgées, les minorités, les voisins des patients ayant survécu à un AVC, les étudiants en médecine et même les enfants en tant que futurs patients potentiels, membres de la famille ou futurs médecins [8].
Information préalable : tant la société allemande de neurologie que les sociétés savantes internationales recommandent d’informer à l’avance l’hôpital visé de l’arrivée du patient. Cela permet l’activation précoce de l’équipe d’urgence et la mise à disposition du scanner, ce qui peut réduire considérablement le temps nécessaire à la thérapie et augmenter le taux de thrombolyse.
Gain de temps pendant la phase d’hospitalisation
Des algorithmes d’action définis sont indispensables pour permettre un déroulement sans heurts et une coordination optimale entre les disciplines impliquées. Il s’agit entre autres de
- Déclenchement d’un “lysecall” par le neurologue de garde dès réception de la notification, afin d’informer toutes les parties concernées.
- Préparer la salle de choc, l’équipe Stroke (neurologue expérimenté et infirmiers diplômés), le scanner ainsi que le radiologue.
Télémédecine : afin de permettre aux hôpitaux géographiquement éloignés, ne disposant pas de l’expertise et des ressources humaines nécessaires, de thrombolyser un patient le plus rapidement possible, le concept de connexion télémédicale à un centre d’AVC a été développé, avec la possibilité d’interagir en direct et de transmettre les résultats.
Littérature :
- Heiss WD, et al. : Pénombre ischémique : preuve par l’imagerie fonctionnelle chez l’homme. J Cereb Blood Flow Metab. 2000 ; 20(9) : 1276-1293.
- Sitzer M, Steinmetz H : Manuel de neurologie. Urban&Fischer 2011 ; 121-122.
- Saver JL, et al : Time is brain – quantified. Accident vasculaire cérébral 2006 ; 37 : 263-266.
- Puolakka T, et al : Analyse séquentielle des retards de prétraitement dans la thrombolyse du stroke. Acad Emerg Med. 2010 ; 17(9) : 965-969.
- Pe’rez de la Ossa N, et al. : Influence de l’admission directe dans les centres d’AVC complets sur le résultat des patients victimes d’un AVC aigu traités par thrombolyse intraveineuse. J Neurolog 2009 ; 256(8) : 1270-1276.
- Kothari RU, et al : Cincinnati prehospital stroke scale : reproducibility and validity. Ann Emerg Med 1999 ; 33 : 373-378.
- National Institute of Neurological Disorders and Stroke. Actes d’un symposium national sur l’identification rapide et le traitement des accidents vasculaires cérébraux aigus 1996.
- Haass A, et al : Le temps c’est le cerveau. Neurologue 2013 ; Nov 27. [Epub ahead of print].
InFo Neurologie & Psychiatrie 2014 ; 12(2) : 4-6