Que visent les thérapies dites ciblées ? Et quels progrès ont été réalisés dans les différentes néoplasies hémato-oncologiques à cet égard ? Lors du 21e symposium Médecine en piste au cirque Knie, le professeur Markus G. Manz de l’Hôpital universitaire de Zurich a répondu aux questions les plus brûlantes.
Selon le professeur Markus G. Manz, de la clinique d’hématologie de l’hôpital universitaire de Zurich, les cancers dans le domaine de l’hémato-oncologie représentent environ 10% des néoplasies en Suisse. Il s’agit principalement de ce que l’on appelle les “maladies de la vieillesse”, c’est-à-dire des affections dont la fréquence augmente nettement avec l’âge.
“Même si l’on ne se base pas sur le scénario démographique le plus extrême, mais sur un scénario moyen, la population de plus de 65 ans va doubler d’ici 2030. En simplifiant à l’extrême, on peut donc s’attendre à un doublement des néoplasmes hémato-oncologiques, ce qui rendra d’autant plus nécessaire la mise au point de traitements appropriés”, a expliqué le professeur Manz.
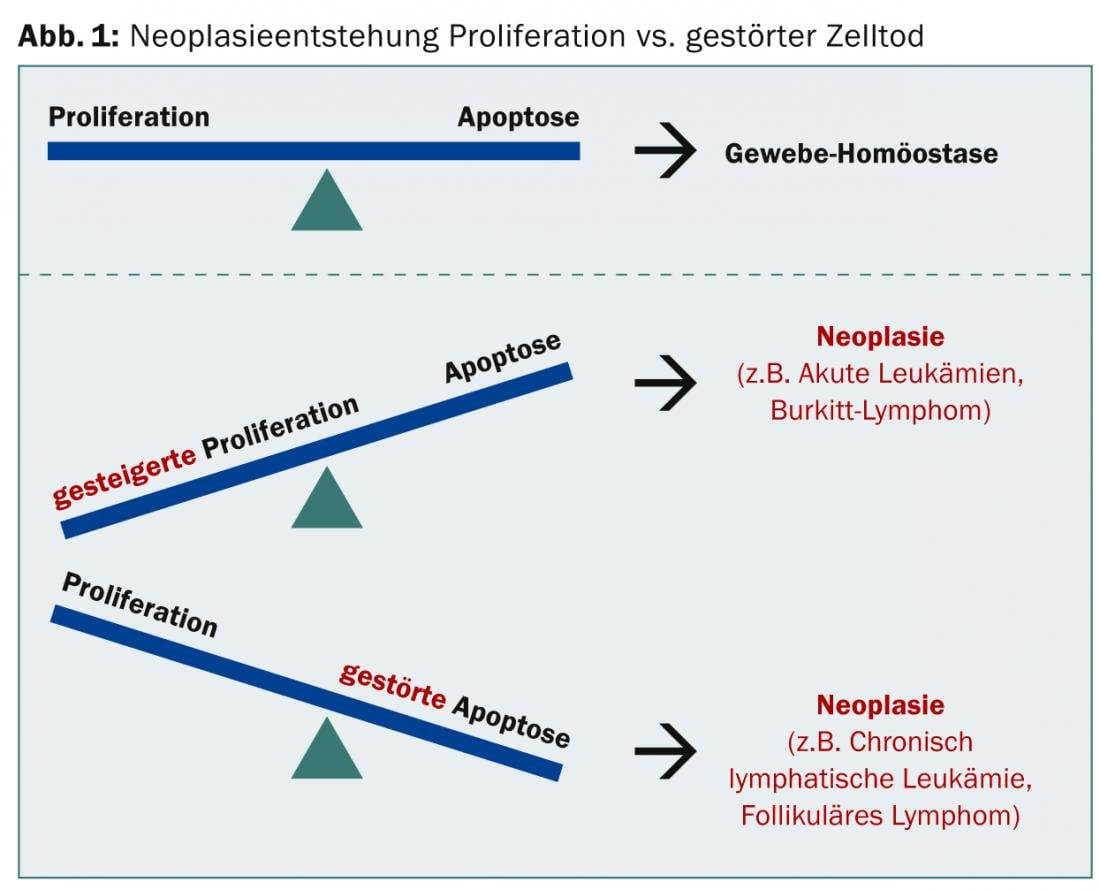
Dans le cas d’une néoplasie, soit la prolifération accrue, soit l’apoptose perturbée peut prédominer, mais dans tous les cas, l’équilibre tissulaire n’est plus assuré (Fig. 1).
L’idéal de la thérapie ciblée, quant à lui, est la plus grande sélectivité tumorale possible, elle ne doit s’attaquer qu’à la tumeur et non à l’ensemble du patient ou aux tissus sains. “La chimiothérapie classique dite non ciblée est en général dépendante du cycle cellulaire, c’est-à-dire qu’elle suit le principe : beaucoup de division – beaucoup d’effet”, a déclaré l’orateur. La thérapie ciblée, quant à elle, cible ce que l’on appelle les “tumor drivers”, qui sont essentiels pour la tumeur, et détruit ainsi la tumeur de manière efficace et, du moins en théorie, avec le moins d’effets secondaires possible.
Les deux cibles les plus courantes sont les enzymes/kinases (intracellulaires) et les antigènes à la surface des cellules. Les premiers sont inhibés par ce que l’on appelle des “petites molécules”, tandis que les autres sont attaqués par des anticorps avec ou sans “munitions” attachées.
Les kinases transfèrent un résidu phosphate et peuvent donc activer d’autres enzymes. Ils sont essentiels à la transmission des signaux dans la cellule. Dans le tissu tumoral, la kinase est toujours active, ce qui entraîne une division cellulaire massive. L’inhibiteur bloque la kinase et place ainsi la division cellulaire dans un état inactif. “L’exemple type d’un inhibiteur de kinases est l’imatinib. Le rituximab, quant à lui, est le représentant le plus connu des anticorps monoclonaux et a entraîné une véritable révolution dans tous les lymphomes avec expression de CD20, ce qui inclut pratiquement tous les lymphomes à cellules B”, explique le professeur Manz.
Quelles améliorations peuvent être apportées ?
En prenant l’exemple de la leucémie myéloïde chronique (LMC), le professeur Manz a montré que depuis la première introduction des inhibiteurs de tyrosine kinase vers 2001, l’efficacité du traitement a fortement augmenté et que la survie à long terme s’est par conséquent nettement améliorée. Environ 5% des patients atteints de LMC sous imatinib sont des “super-répondeurs” : c’est la première fois que la question d’une éventuelle guérison se pose [1,2]”, a déclaré le professeur Manz. “La conséquence de ce succès est une attente accrue dans le domaine de la LMC pour le futur proche : 100% de survie à long terme avec 0% de réduction de la qualité de vie”.
Le deuxième exemple qu’il a cité est l’évolution dans le domaine de la myélofibrose primaire (PMF) : la mutation dite JAK-2 (Janus kinase 2) est présente dans environ 50% des cas de PMF. Moins de dix ans après la découverte et l’identification de cette mutation, le premier inhibiteur de JAK a été approuvé. “Les données montrent que le ruxolitinib (Jakavi®), par rapport au meilleur traitement disponible, une amélioration du contrôle des symptômes et de la qualité de vie [3], ainsi qu’une meilleure survie globale par rapport au placebo [4]. Mais les inhibiteurs JAK-1&2 sont également actifs sur JAK-2 non muté. La cible sélective dans la tumeur n’est-elle pas pertinente ?
Le dernier sujet abordé était la leucémie lymphoïde chronique (LLC). Dans ce cas, il a été démontré que l’ajout d’un anticorps anti-CD20 à la chimiothérapie est plus efficace que la chimiothérapie seule. En outre, les anticorps anti-CD20 optimisés comme le GA101 (obinutuzumab) sont plus efficaces que ceux de première génération [5].
“Actuellement, des études sont également en cours pour évaluer l’efficacité de l’inhibition de la kinase dans la LLC [6]. Une large application de ce principe d’action dans les lymphomes B non hodgkiniens est très probable dans un avenir proche”, conclut le professeur Manz.
Source : 21e Symposium Medizin in der Manege, 5 juin 2014, Zurich
Littérature :
- Mahon FX, et al : Discontinuation of imatinib in patients with chronic myeloid leukaemia that have maintained complete molecular remission for at least 2 years : the prospective, multicentre Stop Imatinib (STIM) trial. Lancet Oncol 2010 Nov ; 11(11) : 1029-1035.
- Ross DM, et al. : Sécurité et efficacité de l’arrêt de l’imatinib pour les patients atteints de LMC avec une maladie résiduelle minimale stable et indétectable : résultats de l’étude TWISTER. Blood 2013 Jul 25 ; 122(4) : 515-522.
- Harrison C, et al : Inhibition JAK avec le ruxolitinib versus Meilleur Traitement Disponible pour la myélofibrose. N Engl J Med 2012 ; 366 : 787-798.
- Verstovsek S, et al : Long-Term Outcomes Of Ruxolitinib Therapy In Patients With Myelofibrosis : 3-Year Update From COMFORT-I. Blood 2013 ; 122(21) : 396.
- Goede V, et al : Obinutuzumab plus Chlorambucil chez les patients atteints de LLC et de conditions coexistantes. N Engl J Med 2014 ; 370 : 1101-1111.
- Byrd JC, et al : Ibrutinib versus ofatumumab in Previously Treated Chronic Lymphoid Leukemia. NEJM May 31 2014. DOI : 10.1056/NEJMoa1400376.
InFo ONKOLOGIE & HÄMATOLOGIE 2014 ; 2(6) : 33-34