Le traitement de la douleur chez les patients paraplégiques prend en compte différentes causes de douleur [1–4]. Les succès des traitements médicamenteux, neurochirurgicaux, interventionnels et autres approches thérapeutiques sont actuellement encore limités. Une approche thérapeutique multimodale est donc impérative.
Le syndrome paraplégique traumatique est relativement rare, avec une incidence de 3 cas pour 100 000 en Suisse [5]. Pourtant, dans ce groupe de patients, un nombre particulièrement élevé de patients souffrent de douleurs chroniques (prévalence de 81%). La symptomatologie de la douleur est très complexe chez les patients souffrant d’un syndrome médullaire traumatique, car différentes causes de douleur sont souvent présentes chez le même patient. Ainsi, 59% des patients rapportent des douleurs musculo-squelettiques, 41% des douleurs neuropathiques au niveau de la lésion ou 34% des douleurs neuropathiques en dessous du niveau de la lésion et 5% des douleurs viscérales. 58% des patients font état de douleurs sévères et atroces. Il ne semble pas y avoir de lien entre la présence de douleurs neuropathiques et l’étendue de la lésion, comme une lésion complète ou incomplète de la moelle épinière [6].
Classification des douleurs en cas de syndrome médullaire traumatique
Après avoir proposé pour la première fois en 2002 une classification uniforme de la douleur après lésion traumatique de la moelle épinière par la société internationale de la douleur (“International Association for the Study of Pain”, IASP), celle-ci a été actuellement révisée par l'”International Spinal Cord Society” et publiée comme nouvelle classification consensuelle de la douleur en cas de lésion de la moelle épinière. On distingue ainsi les syndromes douloureux nociceptifs, neuropathiques, les autres syndromes douloureux définis ainsi que les douleurs non attribuables (tableaux 1 et 2) [1]. Dans le cas des douleurs neuropathiques liées au syndrome médullaire traumatique, le niveau de lésion neurologique joue un rôle important. Celui-ci est défini comme le dermatome le plus caudal avec une sensibilité normale au toucher léger et à la sensation de pointe ou le myotome avec une fonction motrice normale. Selon la nouvelle classification mentionnée, les termes anglophones tels que at-level spinal cord injury pain (at-level SCIP) pour la douleur dans le dermatome du niveau de blessure neurologique, y compris les trois dermatomes sous-jacents, ainsi que le terme anglophone below-level spinal cord injury pain (below-level SCIP) sont également utilisés actuellement dans les pays germanophones.
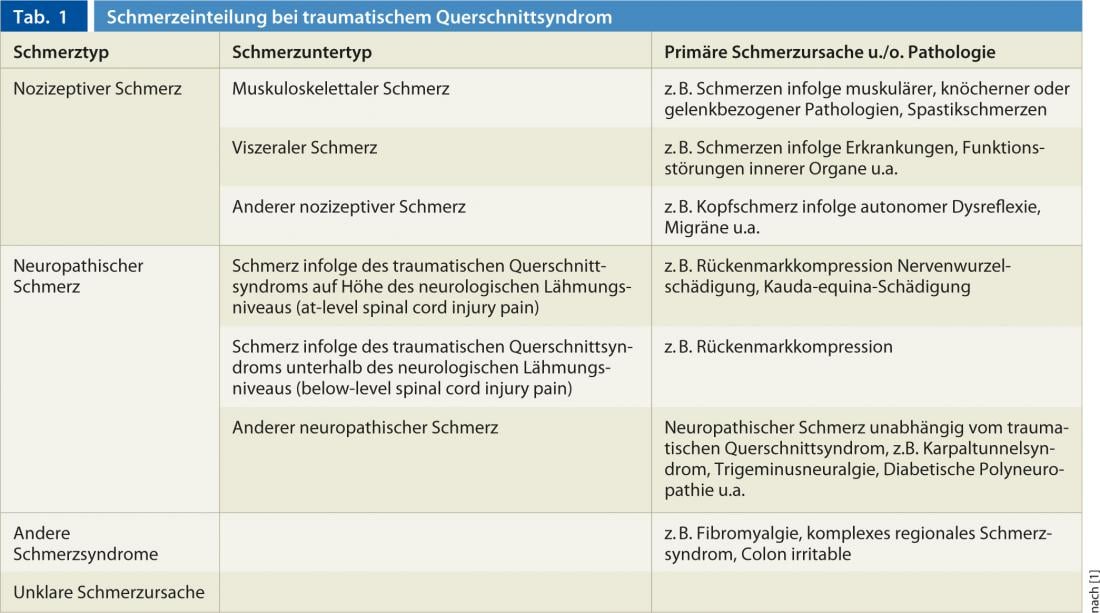

Alors que la SCIP at-level peut être d’origine neuropathique centrale en cas de lésion de la moelle épinière ou d’origine neuropathique périphérique en cas, par exemple, de lésion traumatique de la racine nerveuse au niveau de la lésion, la SCIP below-level est par définition une douleur neuropathique générée au niveau central suite à une lésion de la moelle épinière. Les douleurs neuropathiques du syndrome de la cauda equina constituent une forme particulière, car elles correspondent à une cause de douleur neuropathique périphérique en raison de la lésion de la racine nerveuse de la cauda epuina et sont donc classées par définition dans le groupe des SCIP at-level, même si l’extension de la douleur au-delà de trois segments se trouve en dessous du niveau de paralysie neurologique.
Rôle du diagnostic par appareil
La douleur neuropathique est définie par l’IASP comme une douleur causée par une lésion ou une maladie affectant le système somatosensoriel [7]. Dans ce cas, en plus des caractéristiques anamnestiques et cliniques susmentionnées, la lésion du système somatosensoriel expliquant la douleur neuropathique doit être prouvée par un appareil. Le diagnostic du syndrome médullaire traumatique est principalement établi sur la base de l’imagerie. La plupart du temps, on trouve des lésions dans la moelle épinière chez les patients présentant ou non une douleur chronique après un syndrome paraplégique traumatique. Dans ce cas, la neurophysiologie clinique n’a qu’une importance secondaire dans le diagnostic du SCIP at-level ou below-level, car les patients sans douleur présentent également des résultats neurophysiologiques pathologiques concernant la moelle épinière. Actuellement, on ne sait pas encore quels patients atteints d’un syndrome médullaire traumatique ressentent des douleurs et lesquels n’en ressentent pas. Dans certains cas, par exemple chez les patients présentant des douleurs en cas de lésion de la moelle épinière sans cause traumatique, comme dans le cas de la sclérose en plaques, de la myélopathie cervicale, de l’ischémie médullaire, etc., la neurophysiologie peut être utile pour étayer le diagnostic de douleur neuropathique après lésion de la moelle épinière.
Un travail récent montre que les méthodes neurophysiologiques récentes telles que les potentiels évoqués par laser (LEP) et les tests sensoriels quantitatifs (QST) présentent un taux de réussite plus élevé que la méthode traditionnelle des potentiels évoqués somesthésiques (SEP). Par exemple, le LEP (test fonctionnel de la voie spinothalamique) était pathologique dans sept cas sur huit, tandis que le QST a révélé des résultats pathologiques de la voie spinothalamique dans cinq cas sur huit, ainsi que des résultats pathologiques de la voie postérieure dans trois cas sur huit. La SEP, en tant que test fonctionnel de la corde postérieure, n’a été pathologique que dans deux cas sur huit et n’a donc qu’une valeur informative limitée [8].
Mécanismes d’apparition de la douleur neuropathique après une paraplégie
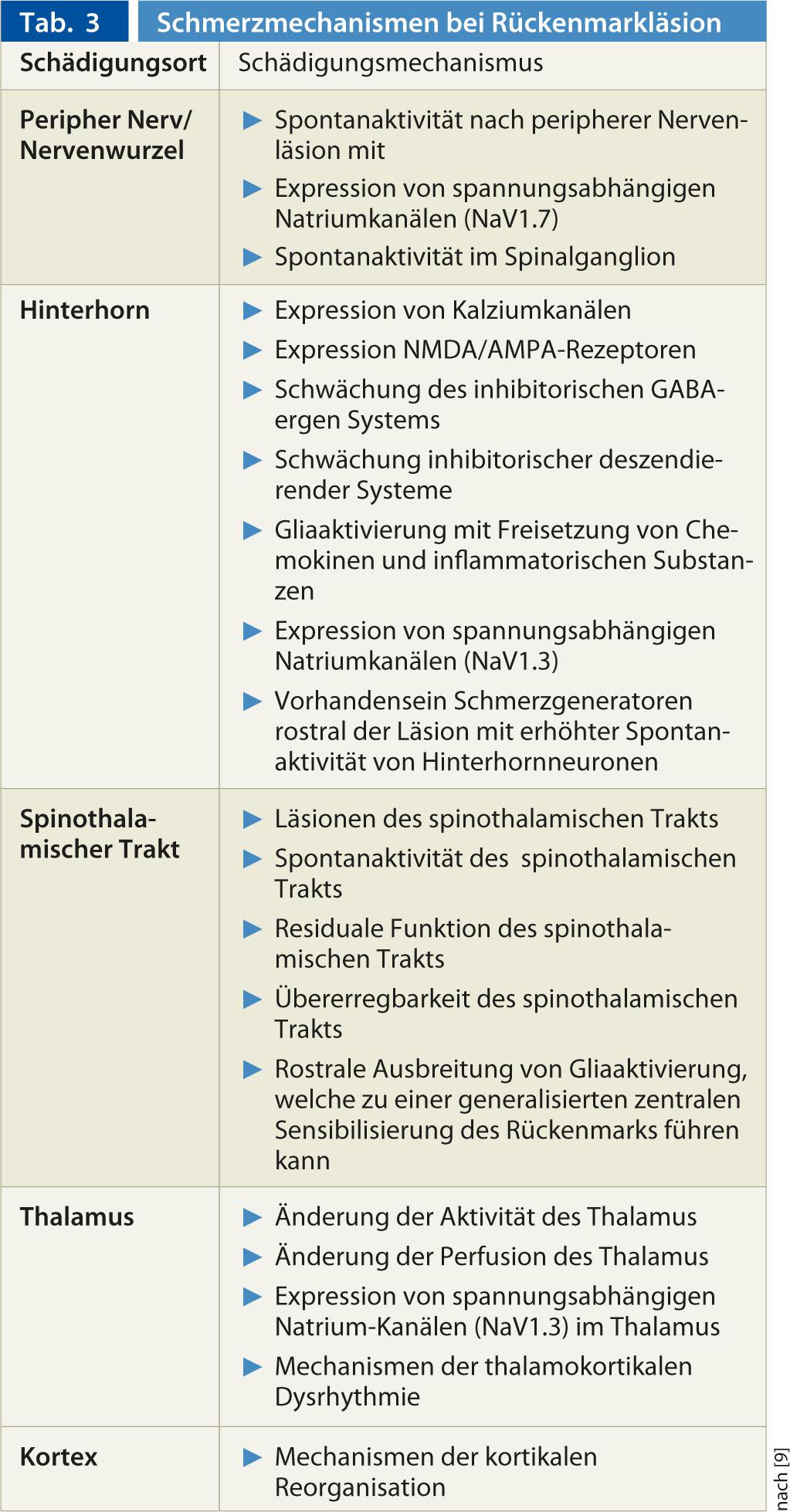
La dernière revue de Finnerup et al. 2012 [9] donne un bon aperçu des mécanismes de la douleur neuropathique en cas de lésion de la moelle épinière (tableau 3). En outre, les processus centraux peuvent également être influencés par des modifications des nerfs nociceptifs périphériques (par exemple, en cas de lésion des racines nerveuses au niveau de la lésion neurologique) : Après une telle lésion d’un nerf périphérique, différents mécanismes physiopathologiques peuvent se produire et entraîner des douleurs neuropathiques générées en périphérie. Une lésion nerveuse entraîne l’apparition d’une activité spontanée ectopique dans les fibres nerveuses ou le ganglion spinal. Cette activité spontanée est l’expression d’une augmentation de l’expression des canaux sodiques voltage-dépendants (par ex. NaV 1.7). L’activité spontanée continue peut encore entraîner une sensibilisation périphérique de la fibre nerveuse, par exemple par l’expression de récepteurs TRPV1 au niveau des terminaisons nerveuses libres.
Approches thérapeutiques de la douleur après un syndrome médullaire traumatique
Selon Siddall 2009 [10], la douleur est considérée comme un facteur important de souffrance, de moins bons résultats en matière de rééducation et de baisse de la qualité de vie chez les patients souffrant d’un syndrome médullaire traumatique. Selon les différentes causes possibles de douleur expliquées ci-dessus, le traitement de la douleur après un syndrome médullaire traumatique est toujours interdisciplinaire et multimodal. En ce qui concerne les douleurs nociceptives, les mesures impliquées sont principalement orthopédiques (p. ex. traitement des pathologies de l’épaule), physiothérapeutiques (p. ex. traitement des facteurs de douleur musculaires) et ergothérapeutiques (p. ex. adaptation de la position assise du fauteuil roulant), conformément à la pathologie musculo-squelettique. Outre le traitement oral de la spasticité, la mise en place d’une pompe intrathécale antispasmodique peut être nécessaire. En ce qui concerne les douleurs viscérales, des mesures internes sont indiquées.
L’expérience selon laquelle le traitement multimodal de la douleur avec des procédés somatiques, physiques et psychologiques ainsi que psychothérapeutiques est supérieur aux procédés monodisciplinaires en cas de syndromes douloureux chro¬niques sans paralysie médullaire devrait également être prise en compte dans le traitement des douleurs chroniques en cas de syndrome médullaire traumatique [11]. Des études prometteuses ont été menées sur la thérapie cognitivo-comportementale et la marche imaginaire, mais les données actuelles sont mitigées [10].
Approches thérapeutiques médicamenteuses
Les approches thérapeutiques médicamenteuses de la douleur neuropathique après un syndrome paraplégique traumatique ont été évaluées dans des lignes directrices internationales telles que la ligne directrice du groupe de travail sur la douleur neuropathique de la Société internationale de la douleur (NeuPSIG) [12] ou la ligne directrice de la Fédération européenne des sociétés neurologiques (EFNS) [13]. Les médicaments qui y sont mentionnés sont en principe également adaptés aux syndromes douloureux neuropathiques centraux qui n’ont pas d’origine traumatique, comme les lésions de la moelle épinière dues à la sclérose en plaques ou à l’ischémie médullaire. Le grand nombre de médicaments mentionnés dans Tableau 3 Les mécanismes mentionnés ci-dessus, qui se situent à différents niveaux et systèmes neuronaux, expliquent peut-être pourquoi la réponse des médicaments disponibles pour le traitement des douleurs neuropathiques en cas de syndrome paraplégique traumatique est limitée : aucun traitement n’est encore disponible pour un grand nombre de ces mécanismes.
Pour le traitement des douleurs neuropathiques d’origine centrale en cas de syndrome médullaire traumatique, les modulateurs des canaux calciques comme la gabapentine et la prégabaline ainsi que l’opioïde tramadol présentent des preuves positives d’efficacité. En ce qui concerne la prégabaline, le NNT est de 3,9 pour une réduction de la douleur de 30%. En revanche, les tricycliques n’étaient efficaces que dans un sous-groupe de dépression à la dose de 150 mg par jour. La lamotrigine a été efficace dans un sous-groupe présentant des lésions incomplètes de la moelle épinière et une allodynie. Les cannabinoïdes peuvent être utilisés dans la SEP, mais ils ne doivent être utilisés qu’après l’échec d’autres traitements en raison du risque potentiel de psychose (tableau 4). Si les médicaments susmentionnés ne permettent pas d’obtenir une réduction suffisante de la douleur, il est recommandé de recourir aux médicaments du 1. et pour le traitement des douleurs neuropathiques générées en périphérie [12]. Il s’agit notamment des opioïdes à forte puissance comme la MST, l’oxycontine et d’autres opioïdes. L’utilisation de ces groupes de médicaments peut également être utile en premier lieu, car dans le cas de la SCIP at-level, par exemple, les mécanismes de douleur neuropathique périphérique représentent également une poche de douleur non négligeable.

Approches thérapeutiques neurochirurgicales et interventionnelles
Malgré un grand nombre d’options thérapeutiques médicamenteuses, celles-ci sont souvent insatisfaisantes [13]. Seuls 30 à 40% environ des patients souffrant de douleurs neuropathiques présentent un équilibre médicamenteux satisfaisant [14]. Selon Dworkin et al. 2007 [15] Après avoir épuisé les méthodes thérapeutiques conservatrices individuelles ou combinées, des méthodes invasives peuvent être tentées. Les données actuelles concernant les approches thérapeutiques neurochirurgicales et interventionnelles sont rassemblées dans des revues récentes [9, 10]. Les preuves de toutes les procédures mentionnées sont limitées et nécessitent des centres expérimentés pour l’évaluation de ces procédures.
Les approches thérapeutiques neurochirurgicales telles que le Dorsal root entry zone lesioning (DREZ, suppression des cellules nerveuses hyperactives à l’intérieur de la corne postérieure, près du niveau de la lésion) et la cordectomie (section anatomique de la moelle épinière) n’ont fait l’objet que de petites études de cas et ne sont pratiquées que dans de rares cas isolés. L’utilisation d’un stimulateur de la moelle épinière (SCS) peut entraîner une amélioration, un effet plus important est attendu en cas de SCIP at-level et de lésions incomplètes. La stimulation cérébrale profonde (DBS) est très invasive et son effet à long terme est discutable. La stimulation transcrânienne du cortex moteur (rTMS) et la stimulation épidurale du cortex moteur (MCS) ont été réalisées dans des cas isolés avec SCIP avec des résultats variables.
Une nouvelle méthode thérapeutique pour les patients souffrant de douleurs neuropathiques, y compris les douleurs neuropathiques liées à un syndrome lésionnel médullaire traumatique, a été proposée par Martin et al. 2009 [16] décrit. Il s’agit d’une ablation thermique transcrânienne non invasive d’une zone circonscrite du thalamus centrolatéral à l’aide d’ultrasons focalisés de haute intensité, ce qui peut entraîner un soulagement de la douleur.
CONCLUSION POUR LA PRATIQUE
- La douleur chez les patients souffrant d’un syndrome médullaire traumatique peut avoir différentes causes.
- Des douleurs nociceptives telles que des douleurs musculo-squelettiques, des douleurs associées à la spasticité et des douleurs viscérales peuvent survenir.
- Les douleurs neuropathiques sont sous-tendues par de nombreux mécanismes au niveau de la moelle épinière, y compris au niveau du thalamus et du cortex.
- Les douleurs neuropathiques associées au syndrome médullaire traumatique peuvent se situer au niveau ou en dessous du niveau de la lésion neurologique (At-level spinal cord injury pain ou below-level spinal cord injury pain/SCIP).
- La multiplicité des différentes causes de la douleur rend souvent nécessaire une évaluation interdisciplinaire et un traitement multimodal de la douleur.
- Pour le traitement médicamenteux de la douleur neuropathique centrale, les modulateurs des canaux calciques et le tramadol sont disponibles avec un bon niveau de preuve. Les tricycliques et la lamotrigine ne sont utiles que pour les sous-groupes.
- Les thérapies interventionnelles ont été peu évaluées et réservées à des centres.
Bibliographie chez l’éditeur