Les thérapies oncologiques évoluent rapidement et un grand nombre de nouvelles substances sont disponibles. Il est important d’apprendre à les identifier, non seulement en termes d’utilisation, mais aussi en termes d’effets indésirables attendus. Conformément à la nature de nombreuses chimiothérapies classiques en oncologie, ce sont surtout les tissus à division rapide qui sont touchés par les effets indésirables. Mais ces dernières années, le système immunitaire a également pu être utilisé à des fins thérapeutiques contre les cellules malignes. Il s’agit d’un nouveau spectre d’effets secondaires qui se distingue clairement de la chimiothérapie classique en termes d’apparition et de présentation clinique.
Alopécie
L’alopécie est l’effet secondaire le plus fréquent de la chimiothérapie, qui survient dans environ la moitié des traitements. Dans ce cas, l’efluvium dystrophique anagène est plus fréquent, en raison de l’interruption brutale du cycle du follicule pileux due à l’effet toxique sur les kératinocytes à division rapide dans la matrice épithéliale du bulbe pileux. La sévérité de l’alopécie dépend de la dose de médicament, de la demi-vie de la substance active et de la durée du traitement complet. Les causes sont principalement les alkylants, les antracyclines, les antibiotiques antitumoraux et les inhibiteurs de la topo-isomérase [1]. Comme les cellules souches se divisent lentement, elles ne sont généralement pas affectées et l’alopécie est généralement réversible. Des exceptions peuvent être les thérapies à haute dose d’endoxan et de busulfan combinées à une irradiation du corps entier pour préparer une greffe de moelle osseuse.
Le refroidissement du cuir chevelu est une intervention préventive possible [2]. Dans le cadre d’une étude de faisabilité menée par le Centre du sein de Zurich, le refroidissement contrôlé du cuir chevelu à l’aide d’un système de casquettes réfrigérantes (Sysmex DigniCap®) pendant l’administration des cytostatiques a été étudié (Fig. 1).
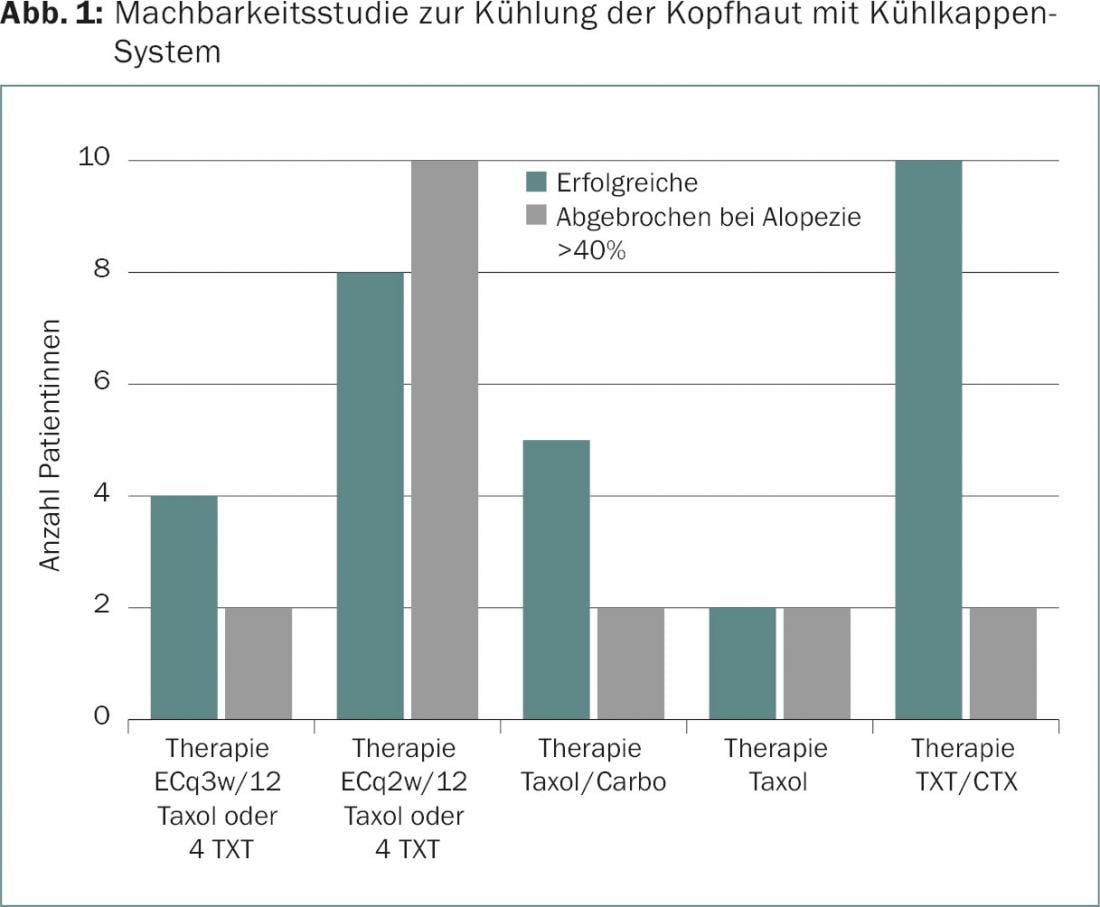
Son mode d’action repose d’une part sur la constriction des vaisseaux sanguins du cuir chevelu, ce qui réduit la quantité de médicaments qui parviennent à la racine des cheveux. De plus, l’absorption de substances actives toxiques par les cellules ciliées est réduite par les basses températures. Lors d’une analyse intermédiaire, les patientes ont présenté peu d’effets secondaires pertinents ou seulement des effets transitoires tels que des maux de tête, une sensation de froid, une lourdeur de la tête, des douleurs au cou et des rougeurs de la peau. Selon les études disponibles, la crainte que les métastases du cuir chevelu soient plus fréquentes avec un traitement de refroidissement du cuir chevelu n’est pas justifiée, car dans les périodes d’observation indiquées, les métastases ne sont pas plus fréquentes qu’avec une chimiothérapie sans un tel refroidissement du cuir chevelu [3]. En fonction de la composition de la chimiothérapie, les cheveux de la tête ont pu être conservés avec succès et de manière esthétique chez plus de la moitié des patientes.
Toxicité de la peau et des muqueuses
Les cytostatiques : Les antimétabolites (5-FU, MTX, pemetrexed) et les antibiotiques antitumoraux (DOX, IDA, EPR, BLE) en particulier, mais aussi les taxanes, provoquent une stomatite dose-dépendante. La plupart du temps, elle guérit spontanément, mais une aplasie peut entraîner des infections compliquées. Les facteurs de risque supplémentaires sont la parodontose, les caries, un mauvais état nutritionnel et une xérostomie consécutive à une radiothérapie. D’autres substances toxiques pour les muqueuses peuvent entraîner une cystite (cyclophosfamide, ifosfamide, plus rarement étopophos) ou une entérite (5-FU, capécitabine, irinotécan, méthotrexate, raltitrexet, plus rarement épiphyllotoxine, cytosine-arabinoside et cisplatine). Des substances comme l’antifolate pemetrexed (Alimta®), utilisé en monothérapie ou en association, produisent des effets secondaires cutanéo-muqueux (exanthème 30%, mucosite et diarrhée 5%) [4]. Bien que les effets secondaires cutanés soient souvent rapportés de manière non spécifique sous le nom de “skin-rash”, des résultats et des diagnostics spécifiques peuvent être observés. On observe ainsi des alopécies, une vascularite urticarienne, une pustulose exanthématique aiguë généralisée, une nécrolyse épidermique toxique, une dermatite de rappel radiologique et un pityriasis lichénoïde. Les modifications cutanées apparaissent généralement peu de temps après le début du traitement [5].
Inhibiteurs de l’EGFR : les inhibiteurs de l’EGFR tels que l’erlotinib, le gefitinib, le cetuximab ou le panitumumab sont utilisés avec succès depuis quelques années pour traiter un certain nombre de tumeurs solides. Des exanthèmes papulo-pustuleux caractéristiques, des paronychies, une xérodermie, un prurit et une alopécie sont présents chez 50 à 100 % des patients [6,7]. De même, l’association du lapatinib (Tyverb®; pan-HER TKI) et de la capécitabine (antifolate) entraîne régulièrement des modifications légères et parfois graves de la peau et des muqueuses. Cela comprend l’érythème (47%), le prurit, la paronychie et la stomatite, mais aussi les pustules, le syndrome mains-pieds (54%), les ampoules, la diarrhée (grade 3-4, jusqu’à 20%) et la pneumonie interstitielle, et nécessite une prise en charge proactive ainsi qu’une consultation dermatologique avec recherche d’une allergie médicamenteuse [8].
Inhibiteurs de CDK4/6 : une autre classe de substances prometteuses est celle des inhibiteurs de CDK4/6 (cycline-dependent kinase), qui sont utilisés dans le cancer du sein en combinaison avec des antihormones comme les inhibiteurs de l’aromatase et qui sont également utilisés dans une sous-forme de liposarcome [9]. Parmi la première génération de ces inhibiteurs, le flavopiridol est la substance la plus étudiée. Les toxicités sont similaires à celles des cytostatiques classiques, avec une inflammation au site de perfusion, des effets secondaires gastro-intestinaux et une neutropénie sévère.
Un inhibiteur récent en cours d’étude clinique est par exemple le palbociclib, qui a reçu l’approbation de la FDA depuis février 2015 en tant que traitement de première ligne du cancer du sein postménopausique avancé ER+/Her2 négatif en association avec le létrozole. Les effets secondaires ont été légers à modérés, la myélosuppression étant plus souvent dose-limitante.
Inhibiteur de m-TOR : toujours chez les patientes atteintes d’un cancer du sein, l’utilisation de l’inhibiteur de m-TOR évérolimus en association avec le létrozole (inhibiteur de l’aromatase) a par exemple été étudiée dans le cadre de l’étude Bolero 2 [10]. En formant un complexe avec la protéine mTOR (“mammalian Target of Rapamycin”), celle-ci est inactivée. mTOR fait partie des deux complexes protéiques mTORC1 et mTORC2 qui, par le biais de différentes voies de transduction du signal, favorisent notamment la transcription et la traduction de diverses protéines et, par conséquent, la prolifération des cellules tumorales, mais aussi des lymphocytes T. L’inhibition de mTOR empêche donc à la fois l’activation et la progression des cellules T de la phase G1 à la phase S du cycle cellulaire. La survie sans progression des patientes, en tant que critère d’évaluation principal, a montré un net avantage pour l’association des deux substances par rapport à la monothérapie par le létrozole. Cependant, un éventail d’effets secondaires sérieux a été constaté. Dans l’étude BOLERO, les stomatites (56%), les diarrhées (30%), les rashs (36%) et les pneumonies non infectieuses (12%) ont souvent nécessité un traitement et ont parfois entraîné l’arrêt du traitement. Les patientes doivent donc faire attention à leur hygiène buccale, utiliser une solution de rinçage buccal à titre préventif et signaler immédiatement toute difficulté respiratoire.
Immunothérapie – Inhibiteurs de points de contrôle : Avec une survie globale prolongée dans le mélanome métastatique grâce au traitement par l’inhibiteur de points de contrôle immunitaires ipilimumab (anti-CTLA4, Yervoy®), 2010 a vu le lancement de la classe de substances des inhibiteurs de points de contrôle, c’est-à-dire des anticorps qui bloquent les points de contrôle CTLA-4, PD-1 et PD-1L (fig. 2).
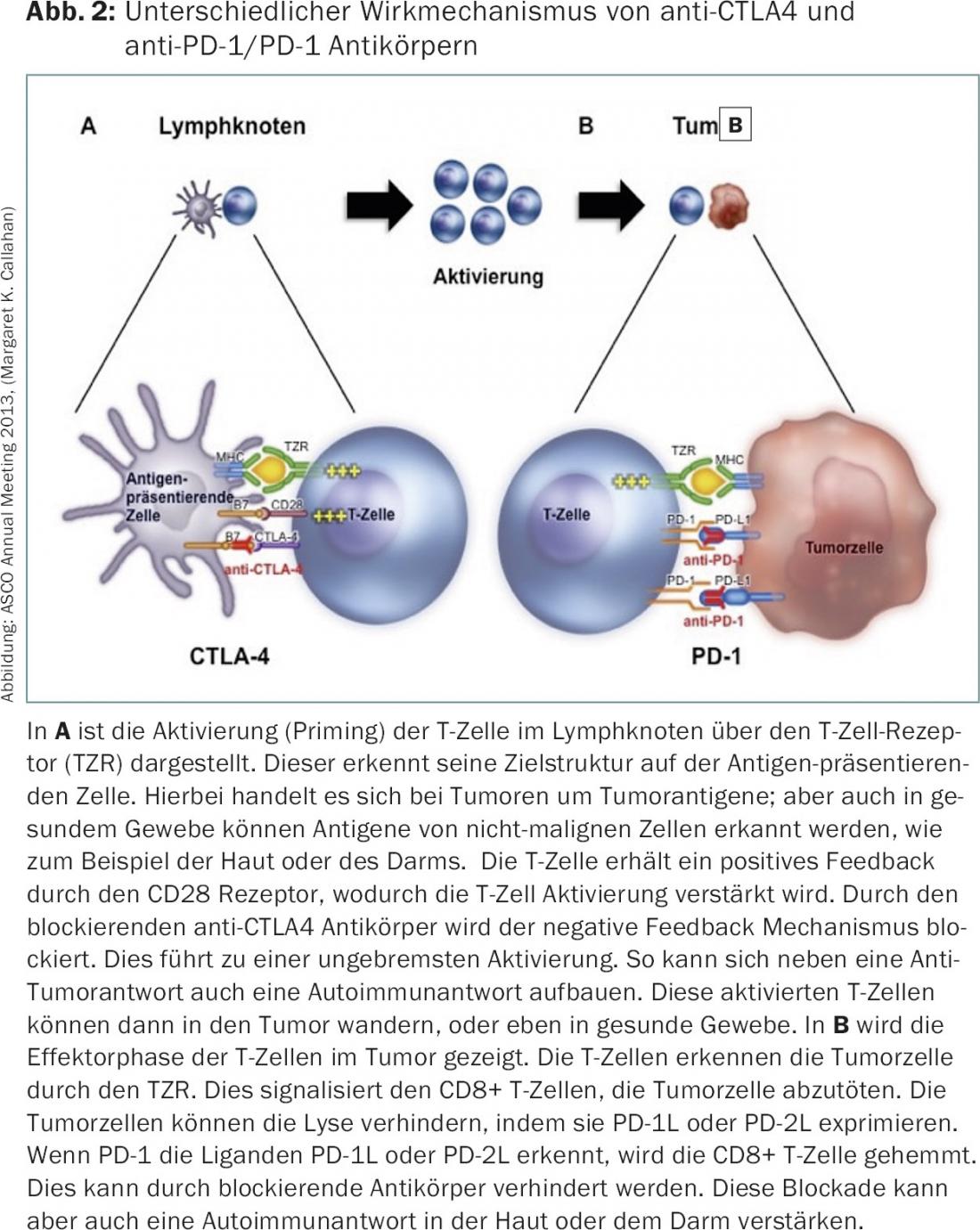
Les inhibiteurs de points de contrôle ont été utilisés jusqu’à présent pour traiter différentes tumeurs telles que les cancers bronchiques [11], les cancers des cellules rénales [12], les mélanomes [13], les tumeurs de la tête et du cou [14] et les cancers de la vessie [15]. Cependant, le développement initial a été fortement influencé par les nouveaux effets secondaires des inhibiteurs de points de contrôle et a failli empêcher leur succès. Environ 5 à 15% des patients ont présenté des effets secondaires graves, qui s’expliquent par l’activation du système immunitaire contre les tissus sains. Il en résulte une auto-immunité induite de manière iatrogène, qui affecte particulièrement la peau et le tractus gastro-intestinal. Les deux systèmes d’organes se distinguent également dans des conditions physiologiques par le fait qu’il existe une interaction intense entre le système immunitaire et le système d’organes. Pour ne pas laisser se développer l’auto-immunité, les points de contrôle sont très importants dans des conditions physiologiques. Il n’est donc pas surprenant que le blocage des checkpoints entraîne des effets secondaires dans ce domaine en particulier.
Les modifications immunologiques de la peau chez les patients recevant des inhibiteurs de points de contrôle [16] comprennent un prurit jusqu’à 30%, des exanthèmes morbilliformes (10-50%) et des dépigmentations de type vitiligo. Les exanthèmes légers peuvent être traités par des soins cutanés locaux et des stéroïdes locaux. Cependant, si des exanthèmes maculo-papuleux étendus et éventuellement des cloques apparaissent, en particulier sur les muqueuses, les inhibiteurs de point de contrôle doivent être immédiatement arrêtés et un traitement systémique par stéroïdes doit être instauré. En cas d’effets secondaires muco-cutanés graves, les inhibiteurs de point de contrôle ne doivent pas être réintroduits. La réduction de la dose n’est pas une mesure visant à améliorer la tolérance, car il n’existe pas de relation claire entre la dose et l’effet dans la classe de substances des inhibiteurs de points de contrôle. Cela est particulièrement vrai si le système immunitaire est déjà activé par des inhibiteurs de points de contrôle. C’est pourquoi, en cas d’effets secondaires graves, l’inhibiteur de point de contrôle doit être interrompu jusqu’à ce que les effets secondaires disparaissent. Ensuite, il faut soigneusement évaluer la possibilité de recommencer. Les lésions cutanées plus rares comprennent le prurigo nodulaire, l’exanthème lichénoïde, les éruptions papulo-pustuleuses, les ulcères, la photosensibilité et le rappel de radiation [17].
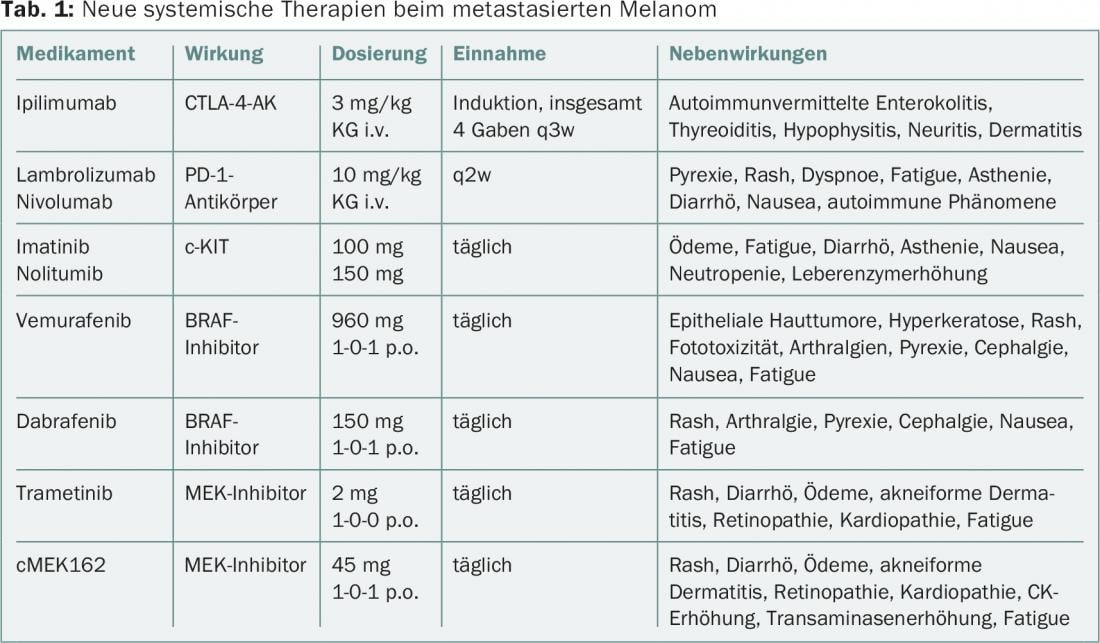
Dans le cas du mélanome, l’utilisation de médicaments dits “ciblés” a progressé rapidement, de sorte qu’en plus des inhibiteurs de points de contrôle, des thérapies combinées sont désormais testées [18]. Le tableau 1 donne un aperçu des traitements systémiques, de leurs effets et de leurs effets secondaires, y compris ceux sur la peau et les muqueuses. Les effets secondaires cutanés peuvent inclure, outre le rash, des dermatoses inflammatoires, des kératoses et des néoplasmes épidermoïdes bénins et malins.
En conclusion, en cas de doute sur l’apparition d’une toxicité cutanéo-muqueuse due aux inhibiteurs de point de contrôle, la dose suivante doit être omise. L’évolution clinique détermine ensuite les mesures à prendre. En cas de doute, il convient de prendre rapidement contact avec l’oncologue traitant. Dans ce cas, une saisie en temps réel des symptômes au moyen de systèmes électroniques et liés au patient (APPs) pourrait être utilisée de manière judicieuse à l’avenir [19].
Littérature :
- Chon SY, et al : Alopécie induite par la chimiothérapie. J Am Acad Dermatol. 2012 ; 67 : e37-47.
- Young A, et al : The use of scalp cooling for chemotherapy-induced hair loss. Br J Nurs. 2016 ; 25 : S22.
- van den Hurk CJ, et al : Scalp cooling for hair preservation and associated characteristics in 1411 chemotherapy patients – results of the Dutch Scalp Cooling Registry. Acta Oncol. 2012 ; 51(4) : 497-504.
- Trojan A, et al : Effets adverses de la chimiothérapie sur la peau et les membranes muqueuses. Review. Praxis (Berne 1994). 2002 ; 91(24) : 1078-87.
- Piérard-Franchimont C, et al : Revisiting cutaneous adverse reactions to pemetrexed. Oncol Lett. 2011 ; 2 : 769-772.
- Gerber PA, et al. : Traitement avec des inhibiteurs du récepteur du facteur de croissance épidermique. Spectre des effets secondaires cutanés Dermatologue. 2010 ; 61 : 654-61.
- Macdonald JB, et al : Effets indésirables cutanés des thérapies ciblées : Partie I : Inhibiteurs de la membrane cellulaire. J Am Acad Dermatol. 2015 ; 72 : 203-18.
- Bachelot T, et al : Lapatinib plus capécitabine chez les patients présentant des métastases cérébrales non précédemment traitées d’un cancer du sein métastatique HER2-positif (LANDSCAPE) : une étude monogroupe de phase 2. Lancet Oncol. 2013 ; 14(1) : 64-71.
- Finn RS, et al : Targeting the cyclin-dependent kinases (CDK) 4/6 in estrogen receptor-positive breast cancers. Breast Cancer Res. 2016 ; 18 : 17.
- Piccart M, et al : Everolimus plus exemestane pour le cancer du sein avancé hormone-receptor-positif, human epidermal growth factor receptor-2-négatif : overall survival results from BOLERO-2. Ann Oncol. 2014 ; 25(12) : 2357-62.
- Herzberg B, et al : Inhibiteurs de points de contrôle immunitaire dans le cancer du poumon non à petites cellules. Oncologist. 2016.
- Carlo MI, et al : Checkpoint inhibitors and other novel immunotherapies for advanced renal cell carcinoma. Nat Rev Urol. 2016 ; 13(7) : 420-31.
- Redman JM, et al : Advances in immunotherapy for melanoma. BMC Med. 2016 ; 14 : 20.
- Fuereder T. : Immunothérapie pour le carcinome spinocellulaire de la tête et du cou. Note de service. 2016 ; 9 : 66-69.
- Zhou TC, et al : Review of the PD-1/PD-L1 checkpoint in bladder cancer : From mediator of immune escape to target for treatment. Urol Oncol. 2016
- de Golian E, et al : Complications cutanées du traitement ciblé du mélanome. Curr Treat Options Oncol. 2016 ; 17 : 57.
- Macdonald JB, et al : Effets indésirables cutanés des thérapies ciblées : Partie II : Inhibiteurs des voies de signalisation moléculaire intracellulaire. J Am Acad Dermatol. 2015 ; 72 : 221-36.
- Trojan A, et al : Progrès dans le mélanome malin métastatique. Dermatologie Pratique 2014 ; Vol. 24, No. 3.
- Egbring M, et al : A Mobile App to Stabilize Daily Functional Activity of Breast Cancer Patients in Collaboration With the Physician : A Randomized Controlled Clinical Trial. J Med Internet Res. 2016 ; 18(9).
InFo ONKOLOGIE & HÉMATOLOGIE 2016 ; 4(7-8) : 19-22