Le traitement efficace des AVC se fait dans des centres dédiés (Stroke Units et Stroke Centers) par une équipe expérimentée et spécialisée. La norme de traitement en phase aiguë est la thrombolyse systémique et, en cas d’occlusion d’un vaisseau proximal, la thrombectomie endovasculaire. Le succès du traitement dépend fortement du temps. C’est pourquoi il est essentiel de détecter rapidement les symptômes d’un AVC et d’orienter rapidement le patient vers un hôpital disposant d’une expertise dans le traitement des soins aigus.
L’AVC ischémique se caractérise par l’apparition aiguë d’un déficit neurologique focal dû à une diminution circonscrite de l’irrigation sanguine du cerveau. Avec environ 150 événements pour 100 000 habitants par an, il s’agit de la troisième cause de décès dans les pays industrialisés et de la première cause d’invalidité permanente à l’âge adulte. Près de la moitié des survivants restent invalides et/ou ont besoin de soins. Il a été démontré que la prise en charge en urgence des patients victimes d’un AVC permet d’améliorer les chances de survie et de réduire les handicaps et les invalidités.
Physiopathologie : pénombre/noyau d’infarctus
Le métabolisme structurel est nécessaire au maintien de la structure cellulaire. Si ce seuil n’est pas atteint, des dommages irréversibles se produisent dans la cellule. En outre, le métabolisme fonctionnel fournit de l’énergie pour l’activité active de la fonction neuronale. Lorsque le seuil d’ischémie n’est pas atteint, le métabolisme fonctionnel s’arrête, ce qui entraîne une perturbation des fonctions neuronales électriques et des symptômes cliniques. Le dysfonctionnement est réversible en premier lieu si la circulation sanguine normale est rapidement rétablie. Normalement, le trouble de la circulation sanguine est plus prononcé au centre (noyau de l’infarctus) que dans la zone périphérique (pénombre), où une quantité résiduelle de sang circule via des collatérales. Au fil du temps, le noyau de l’infarctus s’agrandit progressivement aux dépens de la pénombre. La vitesse à laquelle ce processus se déroule est très variable et dépend principalement de la collatéralisation.
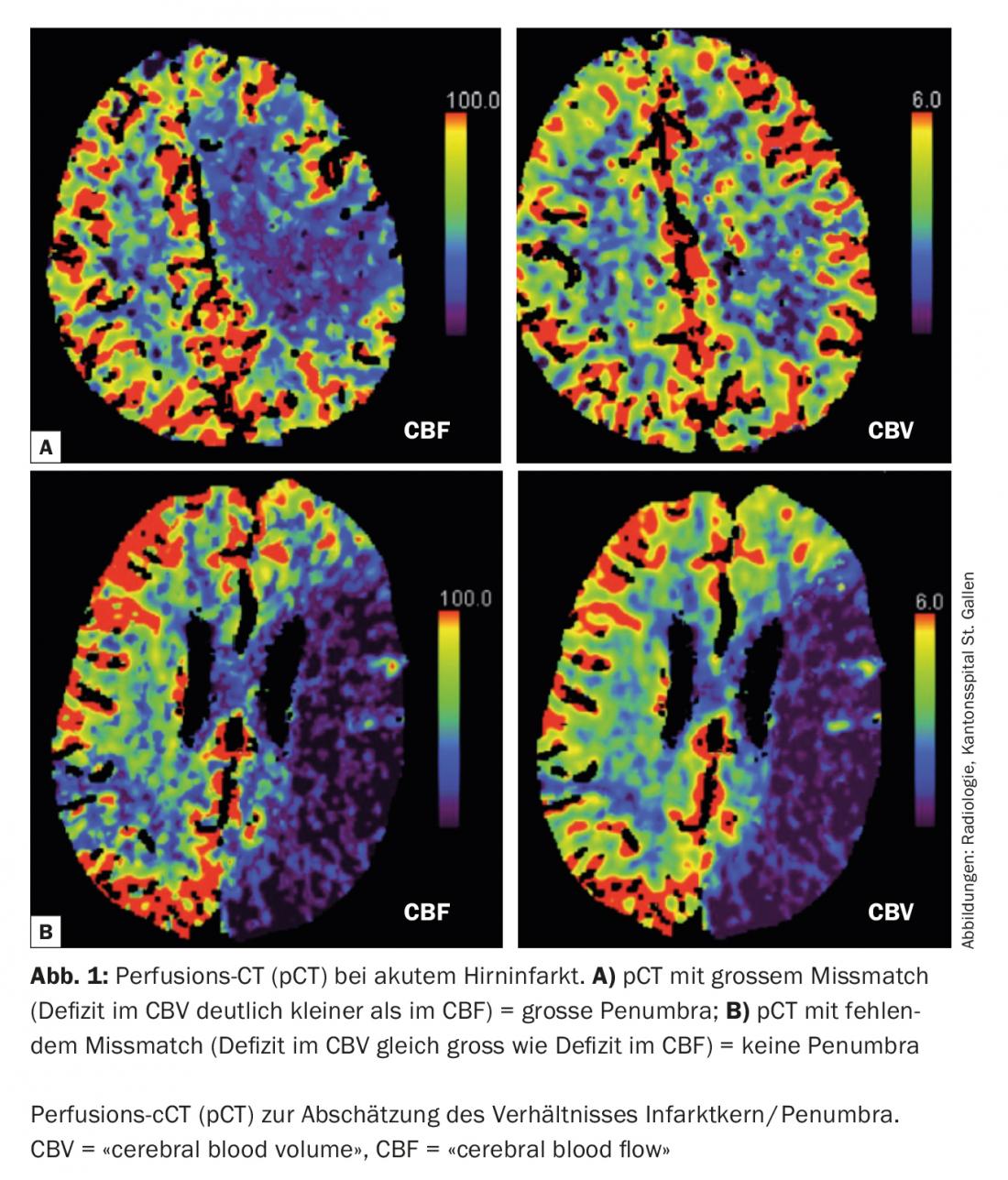
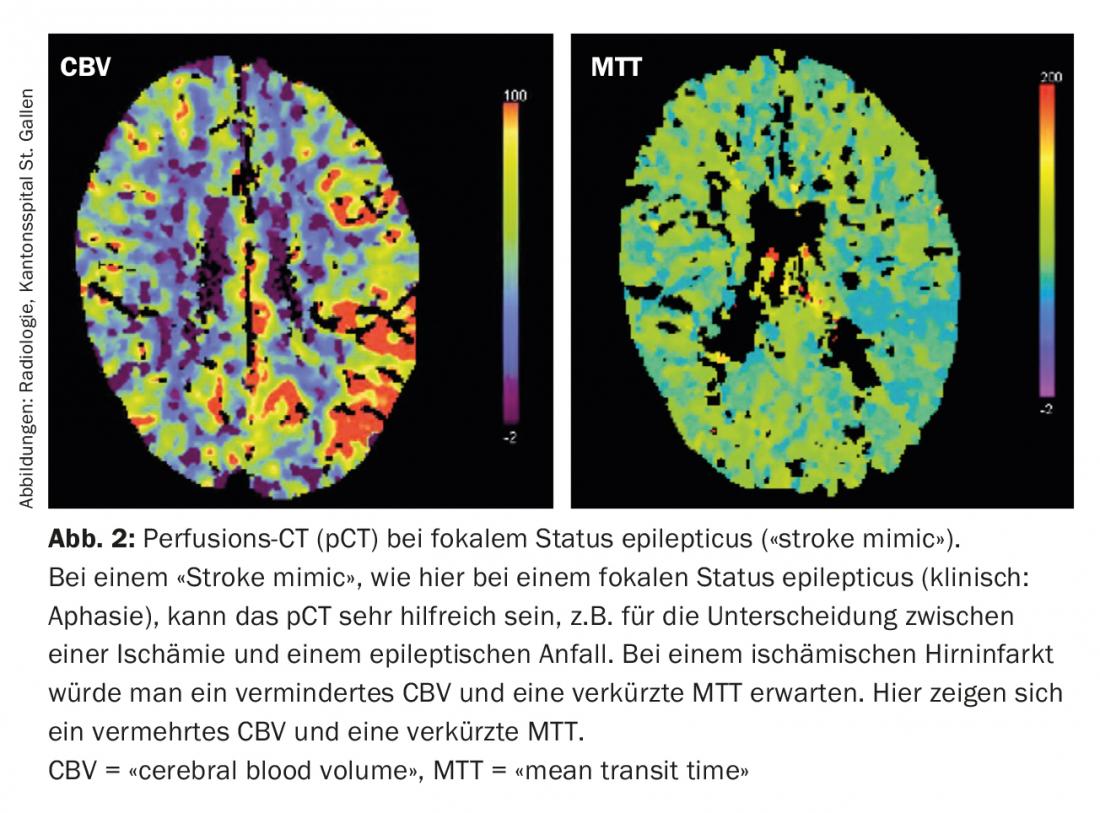
Aujourd’hui, en situation aiguë, il est possible d’estimer la taille de la pénombre et du noyau de l’infarctus à l’aide de l’imagerie multimodale (scanner, IRM) (fig. 1). Cette information est particulièrement importante pour la prise de décision concernant les limites de la zone à traiter. De plus, l’imagerie multimodale peut fournir des informations précieuses dans la délimitation de ce que l’on appelle les “Stroke mimics” (maladies qui simulent l’image d’un AVC ischémique) et ainsi éviter des traitements aigus non indiqués (fig. 2).
Classification clinique des accidents vasculaires cérébraux ischémiques
Les symptômes de l’infarctus cérébral ischémique sont divisés cliniquement (Classification Oxford Community Stroke Project) en syndromes de la circulation antérieure, respectivement postérieure, et en syndromes lacunaires. Dans la circulation antérieure, on distingue un “syndrome de circulation antérieure totale” (TACS, 16%) d’un “syndrome de circulation antérieure partielle” (PACS, 32%), selon l’étendue de la zone infarcie. Le “syndrome de circulation postérieure” (POCS, 21%) se distingue de celui-ci. En présence d’un hémisyndrome purement moteur, sensitif, sensorimoteur ou ataxique sans signes corticaux (aphasie, négligence), on parle de syndrome lacunaire (LACS, 31%) [2].
Étiologie de l’infarctus
Il existe plusieurs classifications étiologiques des AVC ischémiques, la plus connue étant la classification TOAST. Elle divise l’AVC en
- Macroangiopathie : cause d’origine athérosclérotique de l’AVC. En général, une sténose vasculaire symptomatique >50% des vaisseaux alimentant le cerveau.
- Cardiaque embolique : mise en évidence d’au moins une source d’embolie cardiaque pertinente (par exemple, fibrillation auriculaire).
- Microangiopathie : infarctus cérébral sous-cortical d’un diamètre <15 mm.
- Autre étiologie : par exemple, dissection vasculaire, troubles de la coagulation.
- Étiologie incertaine : lorsqu’aucune cause ou plusieurs causes concurrentes ne sont identifiées [3].
Une classification plus récente et plus nuancée est la classification ASCOD, proposée en 2009 [4] et présentée dans une version révisée en 2013 [5]. Elle recense et pondère toutes les causes possibles d’un AVC. On distingue cinq phénotypes A (“athéromatose”/macroangiopathie), S (“small-vessel disease”/microangiopathie), C (“cardiac”/cardiopathie), O (“other cause”/autre cause) et D (“dissection”/dissection), chacun avec trois degrés de causalité. Il s’agit de : 1. maladie présente et cause potentielle 2. maladie présente, mais causalité incertaine 3. maladie présente, causalité improbable, 0. maladie absente, 9. investigations insuffisantes pour permettre une classification. Une norme minimale de clarification est définie à cet effet. Les avantages par rapport à la classification TOAST sont les suivants : Pas de regroupement rigide, pas de groupe cryptogénique, pondération différenciée en trois niveaux.
Un autre concept étiologique récent est l’accident vasculaire cérébral (AVC) ischémique embolique cryptogénique, l'”Embolic Stroke of Undetermined Source” (ESUS). La définition opérationnelle comprend un diagnostic par imagerie avec exclusion des infarctus lacunaires. En outre, l’échographie, le CTA ou l’ARM doivent exclure toute sténose hémodynamiquement significative des vaisseaux alimentant le cerveau dans le territoire vasculaire de l’infarctus actuel. Le diagnostic cardiaque minimal pour exclure une fibrillation auriculaire est un monitoring Holter sur 24 heures [6]. Étant donné que la plupart des AVC répondant aux critères ESUS sont probablement de nature embolique et qu’aucune étude de prévention secondaire ciblée n’a encore été menée pour cette entité, deux grands essais randomisés sont en cours avec des anticoagulants oraux directs (dabigatran ou rivaroxaban) versus acide acétylsalicylique.
Thérapie aiguë
Phase de préhospitalisation : étant donné que le succès du traitement aigu des patients victimes d’un infarctus cérébral ischémique dépend très fortement de la latence entre le début des symptômes et le début du traitement (“time is brain”), la reconnaissance et la réaction rapides aux symptômes de l’AVC peuvent avoir une influence déterminante sur le résultat du traitement. Cela vaut aussi bien pour la population que pour le personnel médical. Les symptômes les plus fréquents de l’AVC aigu sont des syndromes hémiplégiques moteurs ou sensitifs soudains, des troubles de la parole, des déficiences du champ visuel ou une vision double, des troubles de la coordination et des vertiges. (Tab. 1). Si ces symptômes apparaissent, les services d’urgence doivent être alertés le plus rapidement possible (téléphone 144) et le transport à l’hôpital doit être effectué, de préférence dans un centre spécialisé ayant une mission de traitement aigu dans le cadre d’un réseau AVC.

Les principales raisons d’un retard dans la phase préhospitalière sont le manque de connaissances de la population et/ou le manque de reconnaissance des symptômes de l’AVC ainsi que la canalisation insuffisante du transport vers l’hôpital le plus proche avec la possibilité d’un traitement de l’AVC en urgence. En Suisse, la certification géographiquement bien répartie de 9 centres AVC et de 14 Stroke Units actuellement, avec la formation nécessaire de réseaux AVC, a permis une prise en charge plus étendue et plus spécialisée des patients victimes d’AVC. Malgré cela, il faut encore souvent bien plus d’une heure pour que le patient victime d’un AVC puisse bénéficier d’un traitement aigu.
Les mesures immédiates sur place comprennent : Une élévation du torse à 30° ou une position latérale de sécurité en cas de risque d’aspiration. Un monitoring du pouls et de la pression artérielle, sachant que les valeurs de pression artérielle hypertensive ne doivent pas être traitées tant que le seuil critique de pression artérielle (systolique >220 mmHg) n’est pas dépassé. Une détermination de la glycémie capillaire, le maintien de la liberté des voies respiratoires et une oxygénation supplémentaire (2-4 L d’oxygène via les lunettes nasales) doivent être recherchés. En outre, une ligne intraveineuse périphérique doit être mise en place. L’administration primaire d’aspirine n’est pas recommandée car, en phase de préhospitalisation, il est impossible de distinguer les différents sous-types d’AVC, qui sont à 80-85% ischémiques et à 15-20% hémorragiques.
Phase d’hospitalisation : l’objectif principal dans le traitement de l’AVC aigu est la revascularisation du vaisseau obstrué. Il existe aujourd’hui plusieurs options thérapeutiques dont l’efficacité a été scientifiquement prouvée.
Thrombolyse systémique : après le diagnostic aigu avec examen neurologique et imagerie craniocérébrale, une thrombolyse systémique avec administration intraveineuse d’activateur du plasminogène recombinant (rt-PA) est réalisée dans les 4,5 heures suivant le début des symptômes, après vérification des indications et des contre-indications. L’effet thérapeutique de la thrombolyse systémique a été confirmé de manière impressionnante dans plusieurs études randomisées et également dans une méta-analyse récente, mais comme mentionné précédemment, il est fortement dépendant du temps. Le “nombre de traitements nécessaires” (NNT) pour obtenir un bon résultat de traitement fonctionnel chez un patient de plus passe de 3 dans les 90 premières minutes à 7 entre 0 et 3 heures et à 14 entre 3 et 4,5 heures. Un bon résultat fonctionnel signifie que le patient est capable de mener une vie autonome après l’AVC et qu’il ne dépend pas de l’aide d’un tiers. L’effet s’étend à toutes les catégories d’âge et à tous les niveaux de gravité [7,8]. En cas d’occlusion d’un vaisseau cérébral majeur, des techniques complémentaires de recanalisation endovasculaire se sont imposées au cours des dernières années.
Thrombectomie : jusqu’en 2015, il n’existait aucune preuve convaincante de l’efficacité de cette procédure. Cela a changé avec la publication de cinq grandes études (MR CLEAN, ESCAPE, REVASCAT, SWIFT PRIME et EXTEND IA). Dans toutes les études, les patients présentant une occlusion proximale d’un vaisseau de la circulation cérébrale antérieure ont reçu soit une thrombectomie endovasculaire soit une thrombolyse systémique dans un délai allant jusqu’à 12 heures après le début des symptômes. Les patients ayant déjà subi un infarctus important et établi, des infarctus dans le territoire du courant postérieur et un handicap antérieur déjà important étaient exclus. Le critère d’évaluation principal était le résultat fonctionnel du traitement, mesuré par l’échelle de Rankin modifiée (mRS) à 90 jours. Plusieurs méta-analyses de ces données d’études ont été publiées entre-temps. Par conséquent, le “rapport de cotes” (OR) d’un bon résultat fonctionnel du traitement (mRS 0-2) est de 2,42 et le NNT de 5 [9], et même de 2,6 seulement pour une amélioration d’au moins un point sur le mRS. Tous les sous-groupes de patients en bénéficient [10]. Il est important de ne pas sélectionner des patients trop complexes à l’aide d’une procédure d’imagerie radiologique en coupe, y compris l’angiographie. Il convient de rechercher des signes précoces d’infarctus et de prouver l’occlusion d’un vaisseau proximal. La norme technique pour le traitement est ce que l’on appelle les “stentretrieurs”. La fenêtre de traitement s’étend généralement jusqu’à six heures après le début des symptômes, voire plus dans certains cas. Une question en suspens est de savoir si les patients doivent être traités uniquement sous sédation ou sous anesthésie générale.
Traitement dans une stroke unit : outre le traitement aigu médicamenteux et/ou endovasculaire, de nombreuses études ont montré que le traitement dans une stroke unit était à bien des égards supérieur à celui d’un service non spécialisé. La mortalité au cours de la première année après l’événement est inférieure de 18 à 46% en termes relatifs (3% en termes absolus) et la nécessité de soins est inférieure de 25% [11]. Cet effet est également démontré pour tous les groupes de patients. Une étude menée en Suisse a pu montrer qu’un traitement initial dans une unité de soins intensifs, suivi d’une prise en charge par une équipe spécialisée dans les AVC sans unité définie, est clairement inférieur au traitement dans une Stroke Unit clairement définie géographiquement et en termes de personnel, en ce qui concerne le résultat du traitement après trois mois [12]. Cela devrait être une motivation suffisante pour proposer ce concept à l’échelle nationale.
Littérature :
- Poeck et Hacke 2001, 11e édition, Springer-Verlag Berlin, Heidelberg, New York.
- Bamford J, et al : Classification et histoire naturelle des sous-types cliniquement identifiables d’infarctus cérébral. Lancet 1991 ; 337 : 1521-1526.
- Adams HP, et al : Classification du sous-type d’accident vasculaire cérébral ischémique aigu. Définitions à utiliser dans un essai clinique multicentrique. TOAST. Trial of Org 10172 in Acute Stroke Treatment. Stroke 1993 ; 24 ; 35-41.
- Amarenco P, et al : Une nouvelle approche du sous-typage de l’AVC : la classification A-S-C-O (phénotypique) de l’AVC. Cerebrovasc Dis 2009 ; 27 : 502-508.
- Amarenco P, et al : The ASCOD Phenotyping of Ischemic Stroke (Updated ASCO Phenotyping). Cerebrovasc Dis 2013 ; 36 : 1-5.
- Diener HC, et al. : Accident vasculaire cérébral ischémique cryptogénique : l’heure d’un changement de paradigme dans le diagnostic et le traitement ? Akt Neurol 2014 ; 41(01) : 35-39.
- Hacke W, et al : Thrombolysis with alteplase 3 to 4.5 hours after acute ischemic stroke. N Engl J Med. 2008 ; 359(13) : 1317-29.
- Emberson J, et al : Effect of treatment delay, age, and stroke severity on the effects of intravenous thrombolysis with alteplase for acute ischaemic stroke : a meta-analysis of individual patient data from randomised trials. Lancet 2014 ; 384(9958) : 1929-35.
- Sardar P, et al : Endovascular therapy for acute ischaemic stroke : a systematic review and meta-analysis of randomized trials. Eur Heart J. 2015 ; 36(35) : 2373-80.
- Goyal M, et al : Thrombectomie endovasculaire après un accident vasculaire cérébral ischémique : une méta-analyse des données de patients individuels issues de cinq essais randomisés. Lancet . 2016 ; 387(10029) : 1723-31.
- Collaboration des trialistes des unités d’AVC. Soins organisés en milieu hospitalier (unité de stroke) pour la stroke. Cochrane Database Syst Rev. 2007.
- Cereda C, et al : Les effets bénéfiques d’une unité d’AVC semi-intensive vont au-delà du moniteur. Cerebrovasc Dis 2015 ; 39 : 102-109.
InFo NEUROLOGIE & PSYCHIATRIE 2017 ; 15(1) : 8-11