Aujourd’hui, le psoriasis est considéré comme une maladie inflammatoire systémique dans laquelle les cytokines pro-inflammatoires jouent un rôle important. Plusieurs circuits inflammatoires sont impliqués dans la pathogenèse du psoriasis. Les cytokines de la famille de l’IL-23 et de l’IL-17 sont des cibles éprouvées, mais d’autres cibles thérapeutiques sont également à l’étude.
L’efficacité et la sécurité de l’immunothérapie systémique se sont considérablement améliorées ces dernières années grâce à l’introduction de nouveaux agents appartenant aux classes des inhibiteurs de l’IL-17 et de l’IL-23. “Ces dernières années, nous avons assisté à une croissance rapide du nombre de préparations”, explique le Dr Sylvie Haase, spécialiste des maladies de la peau et des maladies sexuelles dans un cabinet dermatologique collectif à Constance [2]. Une large gamme d’agents systémiques ciblant différentes cibles est désormais disponible et, avec la poursuite du décryptage des mécanismes moléculaires de la pathologie, cette tendance devrait se poursuivre à l’avenir (Fig. 1). Le défi consiste de plus en plus à orienter les patients vers les options thérapeutiques appropriées. Il s’avère que parmi les patients atteints de psoriasis modéré à sévère, certains répondent très bien à la première option de traitement systémique et restent sous le même traitement pendant des années, mais certains se révèlent réfractaires au traitement, a expliqué la conférencière.
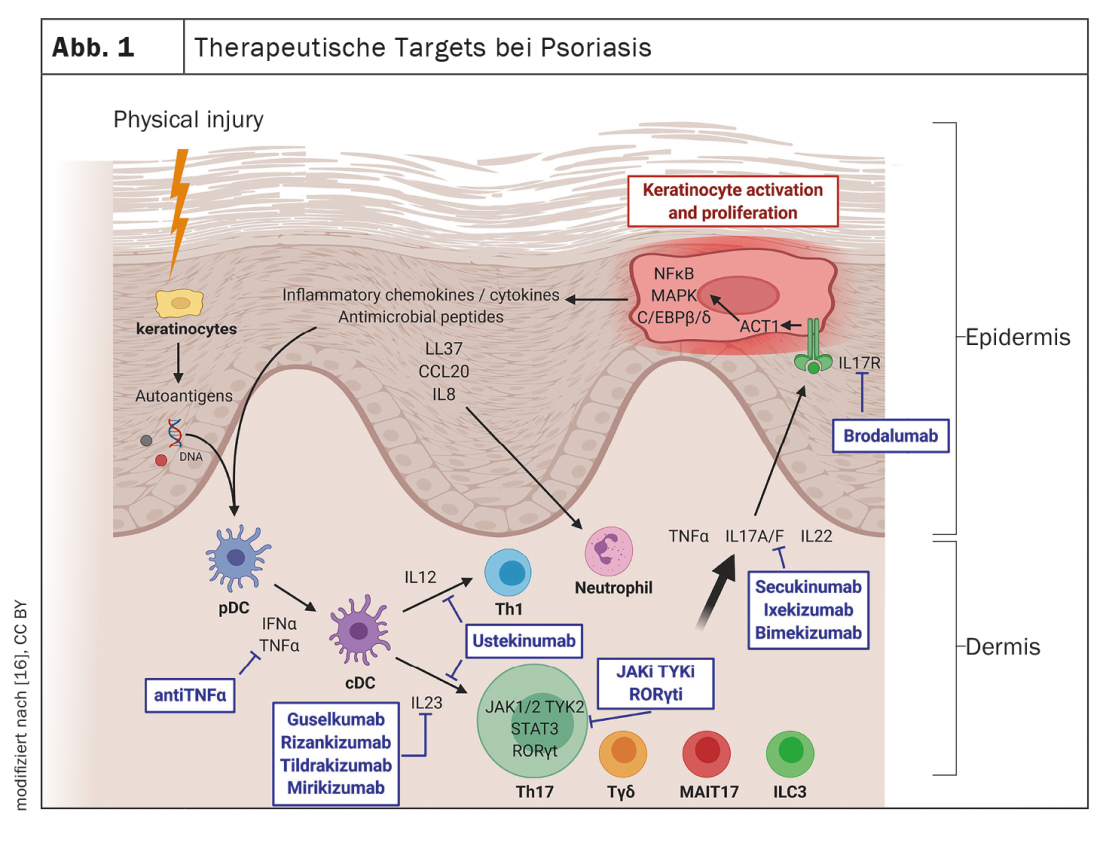
Analyses de la réponse aux médicaments biologiques : que peut-on en déduire ?
La caractéristique pathologique principale du psoriasis est une inflammation chronique de la peau qui conduit à une prolifération incontrôlée et à une différenciation dysfonctionnelle des kératinocytes. Au niveau moléculaire, le rôle physiopathologique central de l’axe TNF-α-IL-23-Th17 est très bien caractérisé. Les anticorps monoclonaux actuellement autorisés en Suisse pour le traitement du psoriasis sont dirigés contre les cytokines suivantes : TNF-α, interleukine (IL)-12/IL-23, IL-23, IL-17A, ou IL-17A/F [1]. Selon les méta-analyses en réseau, les groupes d’inhibiteurs de l’IL-17 (IL-17-i) et d’inhibiteurs de l’IL-23 (IL-23-i) présentent une efficacité supérieure en termes de PASI*-90 et de PASI-100 par rapport aux TNF-α-i [8]. En ce qui concerne l’IL-23-i, le Dr Haase explique : “L’effet est un peu plus lent que celui des inhibiteurs de l’IL-17, mais les préparations n’ont pas de spectre d’effets secondaires spécifiques”. En Suisse, les IL-17A-i sécukinumab et ixekizumab sont actuellement autorisés, ainsi que, plus récemment, l’IL17A/F-i bimekizumab et, pour les IL-23-i, guselkumab, risankizumab et tildrakizumab sont sur le marché.
* PASI = Indice d’étendue et de sévérité du psoriasis
Dans une étude de cohorte, une équipe de recherche danoise a analysé la réponse à différents médicaments biologiques [3]. Les résultats publiés en 2022 dans le Journal of the European Academy of Dermatology and Venereology montrent que sur un total de 3280 patients inclus (âge moyen de 45,0 ans, 37% de femmes), 6,3% ont été considérés comme super-répondeurs et 6,5% comme réfractaires au traitement. Ces derniers avaient un IMC moyen plus élevé par rapport aux autres patients (32,2 vs 29,4, p<0,0001), tandis que les super-répondeurs présentaient moins de comorbidités et un statut socio-économique plus élevé.
Le bimekizumab, inhibiteur de l’IL-17A/F, est un nouvel acteur
Le fait que l’IL-17A joue un rôle central dans la pathogenèse du psoriasis a été prouvé à plusieurs reprises par l’utilisation réussie des anticorps inhibiteurs correspondants. Mais l’IL-17F est également exprimée de manière excessive dans les tissus cutanés et synoviaux des personnes atteintes de psoriasis [4]. Le bimekizumab, un anticorps monoclonal IgG1 qui inhibe sélectivement l’interleukine IL-17F et IL-17A, est également disponible depuis peu en Suisse. Dans les trois études pivots, le bimékizumab a montré une bonne efficacité et a obtenu de meilleurs résultats que l’ustékinumab, un antagoniste de l’IL-12/IL-23, et l’adalimumab, un inhibiteur du TNF-α, sur les critères d’évaluation coprimaires PASI-90 et IGA# 0/1 à la semaine 16 [5–7]. Le profil d’innocuité du bimekizumab est caractérisé par les effets de classe connus de l’inhibition de l’IL-17, dont les effets secondaires fréquents incluent la candidose orale. Un nouveau nanobody trivalent contre l’IL-17A et l’IL-17F, actuellement à l’étude pour une utilisation dans le psoriasis, est le sonelokimab. Des résultats prometteurs ont été obtenus dans des études de phase I et II [4]. Les nanobodies sont des anticorps recombinants spécifiques d’un antigène qui ne sont constitués que du domaine variable nécessaire à la liaison à l’antigène et sont donc relativement petits.
# IGA=Investigator’s Global Assessment : patients avec IGA : 0 = peau sans apparence, 1 = symptômes cutanés légers
Plusieurs molécules administrées par voie orale ou topique sont également dans le pipeline.
La recherche de nouveaux agents antipsoriasiques est un domaine de recherche qui se développe rapidement. Cette année, la Food and Drug Administration (FDA) a accordé une nouvelle autorisation de mise sur le marché pour les agents systémiques suivants dans le psoriasis en plaques (tableau 1) :
- Le deucravacitinib (BMS-986165) est un inhibiteur de TYK2 hautement sélectif, sous forme orale, en prise unique quotidienne, pour le psoriasis en plaques modéré à sévère (approbation FDA 09.09.22) [9,10].
- Le roflumilast (ARQ-151) est un inhibiteur topique de la PDE-4 pour le traitement du psoriasis en plaques chez les patients ≥12 ans (approbation FDA 29.07.22) [11–13].
- Tapinarof-Crème 1% (Vtama) est un modulateur des récepteurs arylhydrocarbonés pour le traitement du psoriasis en plaques chez l’adulte (approbation FDA 24.05.22) [18,19].
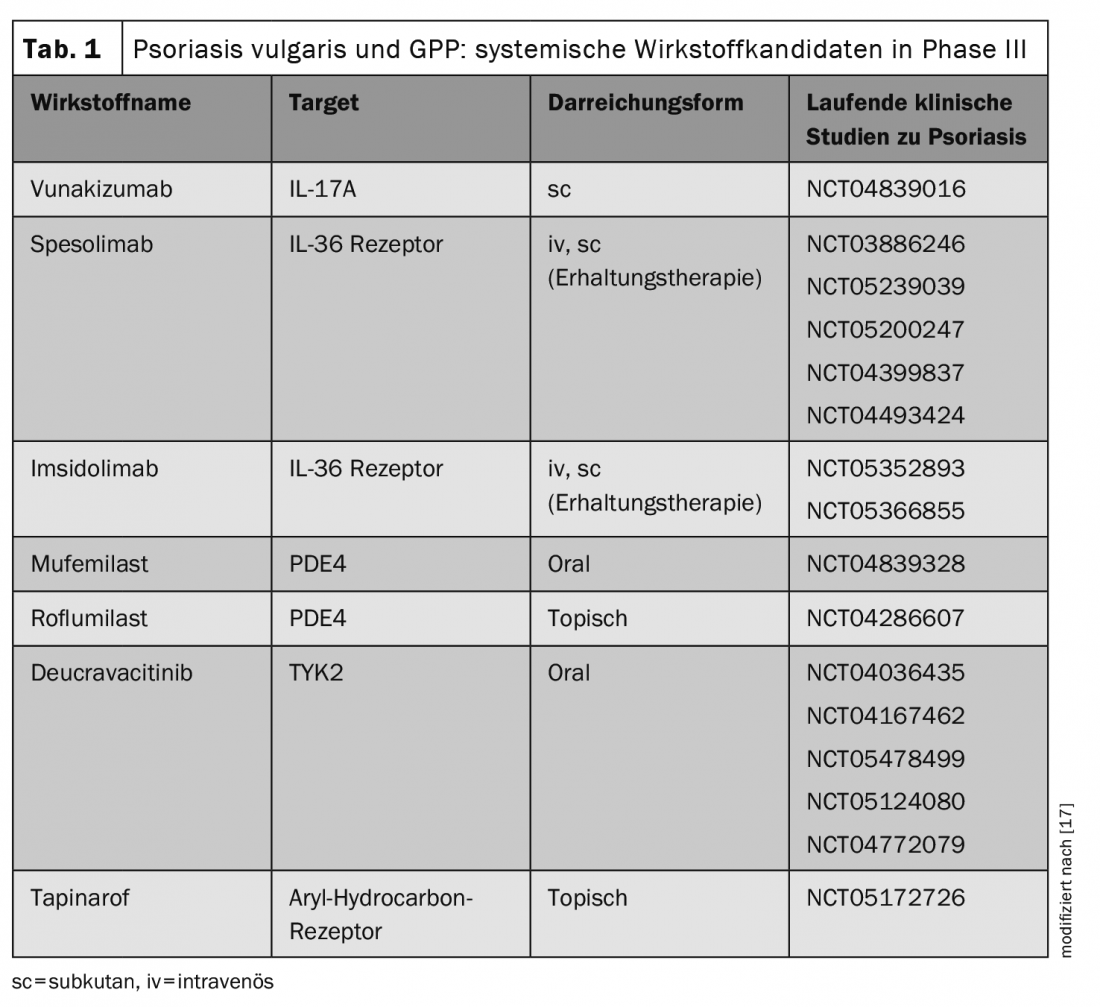
De plus, le spesolimab, un anticorps monoclonal humanisé contre IL36-R, a été approuvé par la FDA pour le traitement des flashes de psoriasis pustuleux généralisé (GPP) (approbation de la FDA 01.09.22). La décision d’autorisation de mise sur le marché est basée sur l’étude de phase II Effisayil-1 [14,15]. D’autres agents systémiques innovants sont actuellement en phase avancée de développement clinique (tableau 1) [17]. Il est donc possible que l’éventail des traitements s’élargisse également en Europe dans un avenir pas trop lointain avec d’autres médicaments de thérapie systémique. De nouvelles alternatives de traitement sont les bienvenues, en particulier pour les patients réfractaires. En ce qui concerne les profils d’effets secondaires, le Dr Haase indique que les effets connus de la classe de substances des inhibiteurs JAK comprennent une légère augmentation du nombre d’infections des voies respiratoires supérieures et d’herpès simplex, et que des exanthèmes acnéiques peuvent parfois apparaître. Des données à long terme sont nécessaires pour mieux comprendre les différences entre les différentes options de traitement et pour pouvoir faire un choix orienté vers le patient.
Congrès : Bodenseer Dermakonsil
Littérature :
- Lauffer F, et al. : Les cytokines de la famille IL-17 dans le psoriasis. JDDG ; 1610-0379/2020/1807
- “Psoriasis – y a-t-il du nouveau ?”, Dr. med. Sylvie Haase, 3ème Bodenseer Dermakonsil, 22.10.2022.
- Loft N, et al : Prévalence et caractérisation du psoriasis réfractaire au traitement et des super-répondeurs au traitement biologique : une étude nationale. J Eur Acad Dermatol Venereol 2022 ; 36(8) : 1284-1291.
- Iznardo H, Puig L : Double inhibition de l’IL-17A et de l’IL-17F dans la maladie psoriasique. Ther Adv Chronic Dis 2021 Aug 12;12:20406223211037846
- Warren RB, et al : Bimekizumab versus adalimumab dans le psoriasis en plaques. N Engl J Med 2021 ; 385 : 130-141.
- Reich K, et al. : Bimekizumab versus ustekinumab pour le traitement du psoriasis en plaques modéré à sévère (BE VIVID) : efficacité et sécurité issues d’un essai de 52 semaines, multicentrique, en double aveugle, comparateur actif et contrôlé par placebo de phase 3. Lancet 2021 ; 397 : 487-498.
- Gordon KB, et al : Bimekizumab efficacy and safety in moderate to severe plaque psoriasis (BE READY) : a multicentre, double-blind, placebo-controlled, randomised phase 3 trial. Lancet 2021 ; 397 : 475-486.
- Yasmeen N, et al : Targeted therapies for patients with moderate-to-severe psoriasis : a systematic review and network meta-analysis of PASI response at 1 year. J Dermatolog Treat 2022 ; 33(1) : 204-218.
- Boerner LK. Hybrid meeting divulges structures of drug candidates [Internet]. Nouvelles de la chimie et du génie. 2022. Disponible à partir de : https://cen.acs.org/acs-news/acs-meeting-news/Hybrid-meeting-divulges-st…,(dernière consultation 15.11.2022)
- Chimalakonda A, et al : Selectivity profile of the tyrosine kinase 2 inhibitor deucravacitinib compared to Janus kinase 1/2/3 inhibitors. Dermatol Ther (Heidelb) 2021 ; 11(5) : 1763-1776.
- Lebwohl MG, et al : Essai de la crème roflumilast pour le psoriasis en plaques chronique. N Eng J Med 2020 ; 383(3) : 229-239.
- Arcutis Biotherapeutics. La FDA approuve la crème ZORYVE (roflumilast) 0.3% d’Arcutis pour le traitement du psoriasis en plaques chez les personnes âgées de 12 ans et plus [Internet]. 2022. Disponible à partir de : www.arcutis.com/fda-approves-arcutis-zoryve-roflumilast-cream-0-3-for-th…,(dernière consultation 15.11.2022)
- Lebwohl M, et al. : Sécurité et efficacité de la crème roflumilast 0.3% à usage unique, un inhibiteur puissant de la phosphodiestérase-4 pour le traitement du psoriasis dans les essais DERMIS-1 et DERMIS-2 phase 3. Poster présenté au : 30th EADV Congress, Sept 29-Oct 2, 2021 ; virtual
- Boehringer Ingelheim. La FDA approuve la première option de traitement pour les flambées de psoriasis pustuleux généralisé chez les adultes [Internet]. 2022. Disponible à partir de : www.boehringer-ingelheim.us/press-release/fda-approves-first-treatment-o…,(dernière consultation 15.11.2022)
- Bachelez H, et al : Essai du spesolimab pour le psoriasis pustuleux généralisé. N Engl J Med 2021 ; 385(26) : 2431-2440.
- Bugaut H, Aractingi S : Le rôle majeur de l’axe IL17/23 dans le psoriasis soutient le développement de nouvelles thérapies ciblées. Front Immunol 2021;12:621956. www.frontiersin.org,(dernière consultation 15.11.2022)
- Drakos A, Vender RA : Review of the Clinical Trial Landscape in Psoriasis : An Update for Clinicians. Dermatol Ther (Heidelb) 2022, https://doi.org/10.1007/s13555-022-00840-9,(dernière consultation 15.11.2022)
- Keam SJ : Tapinarof cream 1% : première approbation. Drugs 2022 ; 82(11) : 1221-1228.
- Lebwohl MG, et al : Phase 3 trials of tapinarof cream for plaque psoriasis. N Engl J Med 2021 ; 385(24) : 2219-2229.











