Les tumeurs des cellules germinales sont globalement rares, mais ce sont en même temps les tumeurs les plus fréquentes chez les jeunes hommes. La prise en charge diffère selon le stade et le groupe pronostique. Le traitement adéquat et adapté au stade des tumeurs germinales métastatiques représente ici un défi.
La tumeur germinale est globalement une entité rare, mais en même temps la tumeur la plus fréquente chez l’homme jeune. Le traitement adéquat et adapté au stade des tumeurs germinales métastatiques constitue à cet égard un défi. Le traitement de première ligne des tumeurs métastatiques primaires et le traitement des récidives sont décrits plus en détail ci-dessous.
Introduction
Les tumeurs germinales représentent environ 2% de toutes les tumeurs malignes et constituent la néoplasie la plus fréquente chez les hommes âgés de 15 à 45 ans. En Suisse, environ 400 hommes en sont atteints chaque année et environ 14 en meurent chaque année. Grâce à l’application de concepts thérapeutiques adaptés au stade de la maladie, il est possible d’obtenir un taux de guérison de plus de 90%, tous stades confondus. Histologiquement, on distingue les séminomes des tumeurs germinales non séminomateuses. Alors que 95% des tumeurs testiculaires chez l’homme se produisent dans le testicule, environ 5% ont une localisation primaire extragonadique. Les facteurs de risque connus comprennent la cryptorchidie, les antécédents de cancer du testicule, les antécédents familiaux positifs, l’infertilité et le syndrome de Klinefelter.
Le symptôme le plus courant est une augmentation de volume ou un gonflement non douloureux du testicule. Dans de rares cas, les patients remarquent également des signes d’une maladie plus avancée, comme des douleurs dorsales, une dyspnée, une perte de poids ou des symptômes neurologiques. L’examen clinique avec palpation des testicules, l’échographie des deux testicules et le dosage complémentaire en laboratoire des marqueurs tumoraux HCG, AFP et LDH sont obligatoires. Les marqueurs tumoraux peuvent souvent déjà prouver la néoplasie et servent également au monitoring du traitement ainsi qu’au contrôle de l’évolution dans le cadre du suivi. Une tomodensitométrie du thorax, de l’abdomen et du bassin est toujours réalisée. L’imagerie de la tête et des os n’est obligatoirement recommandée qu’en cas de métastases étendues, notamment pulmonaires, de marqueurs tumoraux très élevés, de détection de symptômes cliniques ou en cas de récidive. Si le patient souhaite avoir un enfant, une analyse de sperme suivie d’une cryoconservation doit toujours être effectuée avant le début du traitement.
L’orchidectomie est souvent la première étape thérapeutique, et même déjà curative, dans le stade I localisé. En revanche, pour les tumeurs germinales avec une charge tumorale élevée, une constellation de marqueurs tumoraux très élevée ou en cas de métastases très symptomatiques, l’orchidectomie n’est pratiquée qu’après la fin du traitement systémique.
La classification correcte des stades de la tumeur est pertinente pour le choix du traitement et l’évaluation du pronostic, et optimise les chances de guérison. Dans ce contexte, le recours à la chimiothérapie, à la chirurgie et à la radiothérapie, le choix des médicaments nécessaires ainsi que la nature et la durée de leur utilisation sont précisément définis par des recommandations consensuelles et des lignes directrices internationales.
Dans le cas des tumeurs germinales gonadiques, la maladie est limitée aux testicules au stade I. Les tumeurs germinales gonadiques sont des tumeurs qui se développent dans les testicules. Souvent, dans ce cas, l’orchidectomie est suivie d’une surveillance exclusive (“Active Surveillanvce”) pour les séminomes et les non-séminomes. Toutefois, en présence de certains facteurs de risque, une chimiothérapie ou une radiothérapie adjuvante peuvent être nécessaires au stade localisé, et rarement une résection chirurgicale des ganglions lymphatiques rétropéritonéaux (RPLND).
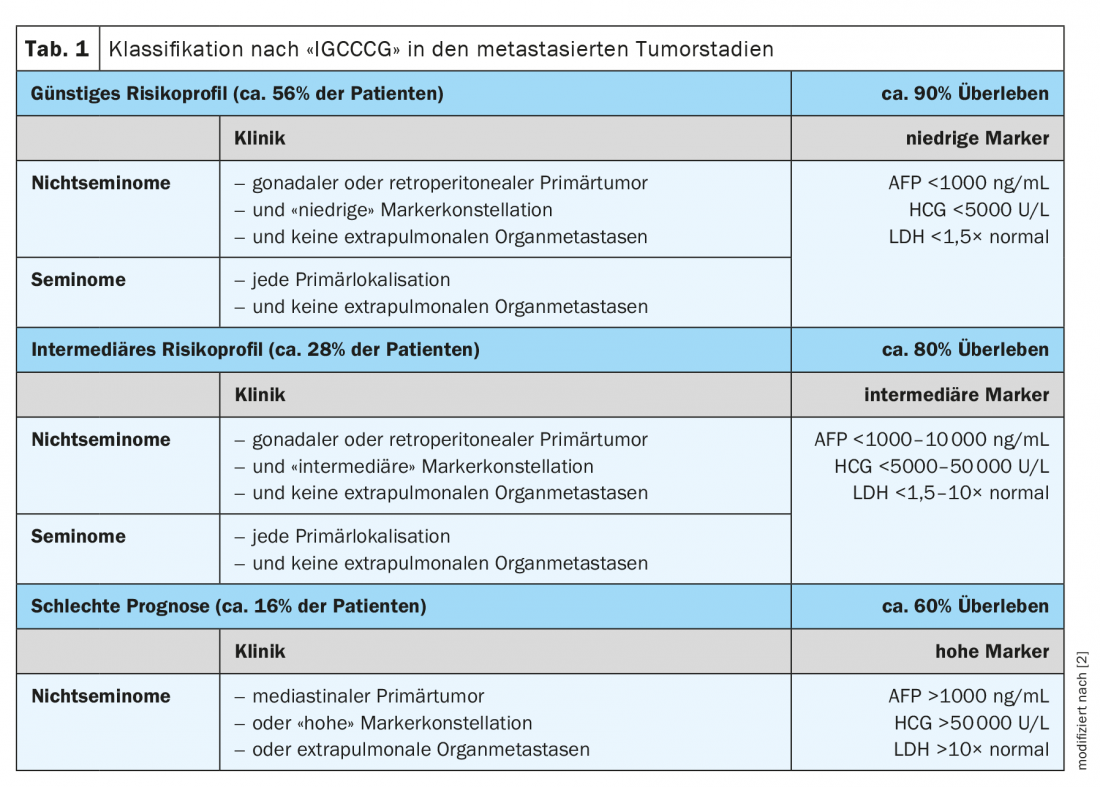
A partir du stade II, on parle de maladie métastatique. Tous les patients avec un stade tumoral >IIB et III nécessitent une chimiothérapie primaire et sont également classés dans un groupe de risque spécifique selon la classification de risque IGCCCG (International Germ Cell Cancer Colaborative Group) (tableau 1). Dans le cas des non-séminomes, la thérapie systémique est suivie d’une chimiothérapie si la tumeur résiduelle est inférieure à 10 %. >1 cm, une résection de la tumeur résiduelle (RTR) est obligatoire.
Environ 5 à 10 % de tous les patients et 30 % des patients déjà atteints de métastases primaires présentent une récidive au cours de l’évolution. Dans ce contexte clinique, tout comme dans la situation primaire, il est important d’adopter une approche orientée vers les facteurs pronostiques et adaptée aux risques.
La négligence des normes thérapeutiques peut entraîner un taux d’échec thérapeutique plus élevé, avec la nécessité de traitements de suivi, voire le décès, tant en traitement primaire qu’en traitement de la récidive. C’est pourquoi les patients, en particulier en situation métastatique et récidivante ou en présence de scénarios pathologiques rares (atteinte du SNC, récidives tardives, etc.), devraient être présentés à des cliniques disposant d’une grande expertise pour obtenir des conseils.
Traitement de première ligne au stade II
Dans le rare stade IIA d’un séminome, en dehors des essais cliniques, la radiothérapie (involved field Radiatio) reste la première option de traitement. Tous les stades de séminome à partir du stade IIB sont traités en premier lieu par trois cycles de chimiothérapie combinant les médicaments cisplatine, étoposide et -bléomycine (PEB) tous les 21 jours ou, en alternative, par quatre cycles de cisplatine/étoposide (PE) ( tableau 2). Une radiothérapie peut également être discutée [1,2].

Actuellement, les patients en Suisse peuvent également être inclus dans une étude clinique de phase III (SAKK 01/18). Les patients reçoivent ici une chimio-radiothérapie combinée (1 cycle de carbo-platine AUC 7 suivi d’une irradiation involved node de 24 Gy pour II A ou 1 cycle de PE suivi d’une radiothérapie involved node de 30 Gy pour II B). Autres études de phase II en Allemagne et en France
aux États-Unis étudient actuellement la chirurgie seule sans traitement adjuvant (PRIMETEST, NCT 02797626).
Les patients présentant une constellation normale de marqueurs tumoraux et des ganglions lymphatiques rétropéritonéaux suspects à l’imagerie (généralement de 1 à 2 cm de diamètre) représentent une sous-population particulière. Chez ces patients, il est recommandé d’effectuer un suivi par imagerie à court terme, 6 à 8 semaines plus tard, sous contrôle étroit et simultané des marqueurs. Une RPLND peut être envisagée chez les patients atteints de non-séminomes dont les ganglions lymphatiques (LK) sont inchangés alors que les marqueurs tumoraux restent normaux, afin d’exclure un tératome. Alternativement, un contrôle supplémentaire est effectué. Tous les patients dont les marqueurs tumoraux augmentent au cours de l’évolution et/ou dont les LK progressent rapidement en taille à l’imagerie doivent être mis sous chimiothérapie sans délai, conformément à la stratification des risques de tumeurs avancées [3].
Le traitement de tous les séminomes métastatiques à partir du stade IIC consiste en une chimiothérapie selon le schéma PEB (cisplatine, étoposide, bléomycine) [1,2]. La durée et l’intensité dépendent alors de la classification des risques IGCCCG. Si le groupe est de bon pronostic, les patients sont traités avec un total de trois cycles de PEB à 21 jours d’intervalle. Le groupe de pronostic intermédiaire ou mauvais est traité avec quatre cycles au même intervalle. En cas de contre-indication à la bléomycine, quatre cycles d’EP (cisplatine, étoposide) sont équivalents à trois administrations de PEB dans les groupes de bon pronostic. Dans les groupes de pronostic intermédiaire et faible, quatre cycles de PEI (cisplatine, étoposide, ifosfamide) sont appliqués au lieu de quatre cycles de PEB.
Les non-séminomes de stade II avec des marqueurs tumoraux élevés sont traités selon leur classification IGCCCG, conformément à l’algorithme de traitement des tumeurs de stade avancé [2].
Traitement de première ligne au stade III
Le traitement standard est conforme à la stratification des risques selon la classification des risques IGCCCG, indépendamment de l’histologie. Elle consiste en une chimiothérapie de trois (pour les groupes de bon pronostic) ou quatre cycles (pour les groupes de pronostic intermédiaire ou mauvais) de PEB à 21 jours d’intervalle (alternativement 4 cycles de PE en cas de bon pronostic ou 3 à 4 cycles de PEI en cas de pronostic intermédiaire/faible) [2].
Ces dernières années, des stratégies de chimiothérapie intensifiée ont été étudiées, en particulier pour les groupes au pronostic intermédiaire et mauvais. Dans ce contexte, une étude prospective randomisée (GETUG13) menée par un groupe de travail français a montré pour la première fois un avantage en termes de survie sans progression chez les patients présentant une chute inadéquate des marqueurs au cours du premier cycle, grâce à une intensification ultérieure du traitement [4].
Les données américaines pour le régime TIP avec paclitaxel, ifosfamide et cisplatine, utilisé jusqu’à présent uniquement dans le traitement de sauvetage, ont également montré de très bons résultats à long terme dans cette population de patients dans une étude de phase II, mais sans avantage significatif par rapport au traitement standard [5]. L’ajout de paclitaxel au PEB dans le groupe des patients à risque intermédiaire dans le cadre d’une étude EORTC a certes montré une amélioration significative de 12% de la survie sans progression, mais sans prolongation significative de la survie globale, tout en augmentant la toxicité [6].
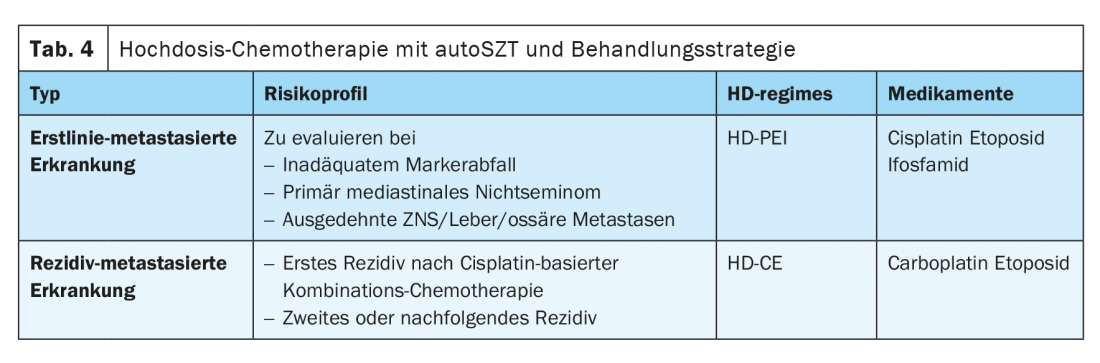
De nombreuses recherches ont également été menées sur la place de la chimiothérapie primaire à haute dose (HDCT) avec support de cellules souches autologues dans le traitement de première ligne, en particulier dans le groupe de patients présentant des caractéristiques de mauvais pronostic selon l’IGCCCG. Dans le cadre d’une étude multicentrique de phase II menée par le Deutsche Stu-diengruppe für Hodentumoren, une HDCT séquentielle avec cisplatine, étoposide et ifosfamide (HD-PEI) a été étudiée et a montré un taux de survie à long terme de 75%. Une étude randomisée de phase III menée aux États-Unis, comparant l’administration de quatre cycles de PEB contre deux cycles de PEB suivis de deux cycles de chimiothérapie à haute dose de carboplatine, d’étoposide et de cyclophosphamide (CEC), n’a pas montré d’avantage général en faveur de la HDCT. Seuls les patients dont les marqueurs tumoraux n’avaient pas diminué de manière adéquate au fil du temps ont davantage bénéficié du traitement dans le bras à haute dose. De même, l’étude randomisée de phase III publiée par l’EORTC, qui a comparé quatre cycles de PEB à l’administration séquentielle d’IPE à haute dose, n’a pas montré d’avantage statistiquement significatif en faveur de l’HDCT [7,8]. L’utilisation d’une HDCT en traitement primaire chez les patients présentant des facteurs pronostiques défavorables n’est donc toujours pas un standard à l’heure actuelle.
Une HDCT primaire peut néanmoins être utile dans certains cas, notamment chez les patients présentant une chute inadéquate des marqueurs après le premier cycle de traitement à dose conventionnelle, chez les patients présentant un non-séminome médiastinal primaire et chez les patients présentant des métastases du SNC ou des métastases hépatiques ou osseuses importantes. Cette procédure ne devrait être décidée qu’en concertation avec des centres expérimentés et les données devraient, si possible, être consignées dans un registre.
Résection tumorale résiduelle (RTR) après traitement de première ligne
La RTR n’est pas obligatoire chez les patients atteints de séminome et présentant des résidus tumoraux post-chimiothérapeutiques. En cas de résidus >3 cm, un PET-CT peut être discuté au plus tôt huit semaines après la fin de la chimiothérapie. Ce n’est que dans cette constellation que le PET constitue une indication valable. Chez les patients TEP positifs, l’examen doit d’abord être répété dans l’intervalle au moyen de contrôles d’évolution par scanner ou, le cas échéant, une biopsie doit être évaluée afin d’exclure avec certitude d’éventuels résultats faussement positifs alors que la constellation des marqueurs est normale [9].
Chez tous les patients non séminomateux présentant des résidus tumoraux >1 cm, une RTR doit être effectuée précocement, environ quatre à huit semaines maximum après la fin de la chimiothérapie, dans le but d’éliminer complètement tous les résidus tumoraux. Cette intervention, souvent complexe, ne devrait avoir lieu que dans un centre interdisciplinaire disposant de l’expertise nécessaire. En cas de détection de cellules tumorales vivantes dans le produit de résection, la marche à suivre n’est pas clairement définie. Il est possible de discuter d’un nouveau traitement avec deux cycles de chimiothérapie ou d’un suivi seul si le pourcentage de cellules tumorales vitales dans la pièce de résection est >10% [10].
Thérapie de sauvetage
Le traitement des patients atteints d’un séminome ou d’un non-séminome et d’une récidive à partir d’un stade I s’effectue de la même manière que les algorithmes de traitement des patients atteints d’une maladie métastatique primaire [1].
Les patients qui développent une récidive après une chimiothérapie primaire comprenant au moins trois cycles de traitement à base de cisplatine reçoivent un nouveau traitement chimiothérapeutique intensif. Celle-ci est complétée par une RTR subséquente chez les patients non atteints de séminome. Les options de traitement sont en principe la thérapie de sauvetage conventionnelle à base de cisplatine (CDCT) ou la chimiothérapie séquentielle à haute dose avec transplantation de cellules souches autologues (HDCT). Dans certains scénarios, une opération de sauvetage seule est également indiquée (par exemple, tératome en croissance) [11].
Le choix du traitement pour chaque patient dépend principalement du moment de la rechute de la maladie et de certains facteurs de risque. On distingue cinq catégories de pronostic en fonction des facteurs de risque. La PFS à 2 ans selon Kaplan-Meier est estimée à 75% pour les patients du groupe à très faible risque, 51% pour le groupe à faible risque, 40% pour le groupe à risque moyen, 26% pour le groupe à haut risque et 6% pour le groupe à très haut risque [12].
Traitement de rattrapage conventionnel contenant du cisplatine
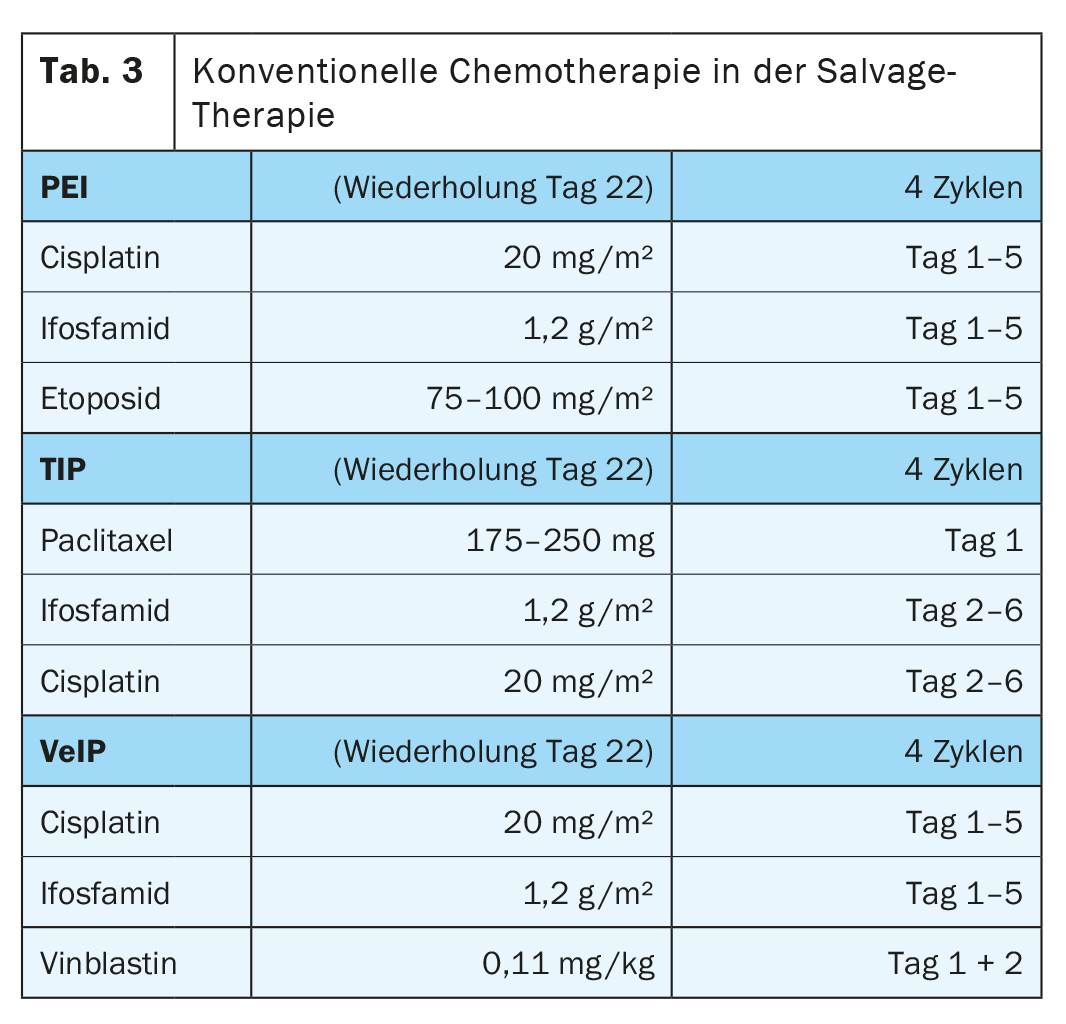
Les schémas associent le cisplatine (qui ne peut pas être remplacé par le carboplatine) et l’ifosfamide soit à l’étoposide (PEI), soit à la vinblastine (VeIP), soit au paclitaxel (TIP) sans supériorité claire d’une combinaison thérapeutique particulière (tableau 3). Le standard de la chimiothérapie combinée est l’administration de quatre cycles à 21 jours d’intervalle [3].
Chimiothérapie séquentielle à haute dose avec transfusion de cellules souches autologues (HDCT)
L’association de carboplatine et d’étoposide (CE) constitue la structure de base de la HDCT. Elle est aujourd’hui pratiquée dans presque tous les centres du monde sous la forme d’un traitement séquentiel de deux à trois cycles d’EC à haute dose. (tableau 4). Grâce à l’amélioration du traitement de soutien et à l’utilisation de cellules souches du sang périphérique autologues (PBSC), les temps de reconstitution hématopoïétique ont pu être réduits de manière significative, faisant ainsi passer la létalité liée au traitement, initialement élevée, de plus de 10% à moins de 3%.
La valeur d’une HDCT en tant que premier traitement de sauvetage est controversée et fait toujours l’objet de discussions actuelles. L’analyse de sous-groupe d’une étude rétrospective de près de 1 600 enregistrements de patients ayant reçu un traitement de sauvetage primaire a montré un avantage en faveur de la HDCT par rapport à la CDCT lors du premier traitement de la récidive. Ces résultats vont à l’encontre des données d’une étude prospective randomisée qui n’a pas démontré de bénéfice clair pour la HDCT en première récidive [13,14].
Une étude mondiale randomisée de phase III comparant le régime conventionnel avec TIP et la chimiothérapie séquentielle à haute dose (CE) (étude TIGER) est en train de valider de manière prospective les bénéfices de la HDCT en première récidive. Les patients peuvent également être inclus en Suisse.
En cas de deuxième récidive ou de récidive ultérieure, une HDCT permet également d’obtenir une rémission à long terme chez une petite partie des patients. Cependant, ici aussi, la petite taille et l’hétérogénéité des groupes de patients étudiés rendent difficile l’interprétation des résultats des études existantes [15].
Résection de tumeur résiduelle après traitement de sauvetage
La proportion de patients présentant une histologie vitale et indifférenciée est globalement plus élevée après une chimiothérapie de rechute. Après la fin du traitement systémique, une RTR doit donc être évaluée chez tous les patients ne présentant pas de séminome et dont les résidus sont détectables. Chez certains patients sans normalisation des marqueurs ou en cas de récidives multiples réfractaires à la chimiothérapie, une résection au sens d’une “chirurgie de desperation” peut encore exceptionnellement conduire à une rémission, en particulier en présence de manifestations tumorales singulières et bien résécables et d’une seule augmentation de l’AFP [3,16].
Récidives tardives
Les récidives qui surviennent au moins deux ans après la dernière chimiothérapie à base de cisplatine sont appelées récidives tardives. En cas de maladie résécable, l’ablation chirurgicale primaire est le traitement de choix. En cas de résultats non résécables et/ou de taux très élevés de marqueurs tumoraux (notamment HCG), il convient de commencer par une thérapie systémique (soit sous forme de CDCT, soit sous forme de HDCT) et de procéder à la résection une fois la chimiothérapie terminée. Plus souvent, les récidives tardives présentent des histologies défavorables dans la résection, avec transformation en sarcome ou en adénocarcinome, entre autres [16].
Atteinte du SNC
Les métastases du SNC sont rares. Ceux-ci peuvent survenir de manière synchrone au moment du diagnostic primaire ou en cas de récidive. Une récidive cérébrale isolée n’est observée que chez environ 2% des patients. Outre l’identification de facteurs pronostiques, une étude rétrospective a comparé les différentes modalités thérapeutiques, à savoir la chimiothérapie, la radiothérapie et la résection, et a examiné la survie des patients, tant au moment du diagnostic primaire qu’en cas de récidive. Il a ainsi été démontré qu’une fois le diagnostic posé, la chimiothérapie n’est pas obligatoirement suivie d’une radiothérapie et/ou d’une résection. En revanche, en situation de récidive, l’utilisation maximale de toutes les formes de traitement, y compris la TDHC, semble améliorer significativement la survie des patients [17].
Récidive après HDCT et autoSZT
Les patients présentant des récidives multiples ou des récidives après une chimiothérapie à haute dose ne sont que rarement guéris. Toutefois, l’utilisation bien coordonnée d’une chimiothérapie palliative, d’une résection tumorale palliative le cas échéant, ou encore d’une radiothérapie palliative permet souvent de soulager les symptômes et d’améliorer ainsi la qualité de vie.
Outre le paclitaxel, l’oxaliplatine et la gemcitabine sont également efficaces et sont utilisés soit individuellement, soit dans différentes combinaisons. Le schéma GOP, qui associe l’oxaliplatine à la gemcitabine et au paclitaxel, est particulièrement efficace et permet d’obtenir des rémissions à long terme chez certains patients, même en cas de récidive après une HDCT préalable. Une efficacité palliative a également été démontrée pour l’utilisation de l’étoposide oral. Malheureusement, il n’existe pas encore d’alternative efficace à la chimiothérapie, en particulier les inhibiteurs de tyrosine kinase et de points de contrôle n’ont pas montré d’efficacité dans les essais cliniques [2,3,18].
Messages Take-Home
- La tumeur des cellules germinales est la tumeur la plus fréquente chez l’homme jeune.
- Au stade métastatique, le pronostic est divisé en trois groupes : bon, intermédiaire et mauvais, en fonction du niveau des marqueurs et de l’atteinte viscérale.
- La chimiothérapie par PEB est le traitement standard des tumeurs à un stade avancé, le PE ou le PEI peuvent être utilisés comme alternative.
- Le nombre de cycles dans le traitement primaire dépend du groupe pronostique.
- Pour les non-séminomes, la résection de la tumeur résiduelle est obligatoire si les résidus sont >1 cm.
- En situation de sauvetage, on utilise soit la chimiothérapie conventionnelle, soit la chimiothérapie à haute dose avec support de cellules souches autologues.
- Les patients présentant des récidives du SNC et des récidives tardives constituent une forme particulière.
Littérature :
- Honecker F, et al : ESMO Consensus Conference on testicular germ cell cancer : diagnosis, treatment and follow-up. Ann Oncol. 2018 ; 29(8) : 1658-1686.
- Classification internationale consensuelle des cellules germinales : un système de stagnation basé sur des facteurs pronostiques pour les cancers métastatiques des cellules germinales. Groupe international de collaboration sur le cancer des cellules germinales. J Clin Oncol. 1997 ; 15 : 594-603.
- Lignes directrices d’Onkopedia sur les tumeurs germinales chez l’homme. www.onkopedia.com (dernier accès 03/2021)
- Fizazi K, et al : Chimiothérapie personnalisée basée sur le déclin des marqueurs tumoraux dans les tumeurs à cellules germinales à faible pronostic (GETUG 13) : une phase 3, multicentrique, essai randomisé. Lancet Oncol. 2014 ; 15 : 1442-1450.
- Feldman DR, et al : Efficacité du paclitaxel, de l’ifosfamide et du cisplatine pour le traitement de première ligne des patients atteints de tumeurs à cellules germinales à risque intermédiaire ou faible. J Clin Oncol. 2016 ; 34(21) : 2478-2483.
- de Wit R, et al : Étude randomisée de phase III comparant le paclitaxel-bleomycine, etoposide, et cisplatine (BEP) au BEP standard dans le cancer à cellules germinales de pronostic intermédiaire : étude intergroupe EORTC 30983. J Clin Oncol. 2012 ; 30(8) : 792-799.
- Motzer RJ, et al : Phase III essai randomisé de chimiothérapie à dose conventionnelle avec ou sans chimiothérapie à haute dose et sauvetage de cellules souches hématopoïétiques autologues comme traitement de première ligne pour les patients atteints de tumeurs germinales métastatiques de mauvais pronostic. J Clin Oncol. 2007 ; 25 : 247-256.
- Daugaard G, et al : A randomized phase III study comparing standard dose BEP with sequential high-dose cisplatin, etoposide, and ifosfamide (VIP) plus stem-cell support in males with poor-prognosis germ-cell cancer. Une étude intergroupe de l’EORTC, GTCSG, et Grupo Germinal (EORTC 30974). Ann Oncol. 2011 ; 22 : 1054-1061.
- Cathomas R, et al : Questioning the Value of Fluorodeoxyglucose Positron Emission Tomography for Residual Lesions After Chemotherapy for Metastatic Seminoma : Results of an International Global Germ Cell Cancer Group Registry. J Clin Oncol. 2018. DOI : 10.1200/JCO.18.00210.
- Heidenreich A : Residual tumour resection following inductive chemotherapy in advanced testicular cancer. Eur Urol. 2007 ; 51 : 299-301.
- Lorch A, et al : Chimiothérapie séquentielle versus chimiothérapie à haute dose unique chez les patients atteints de tumeurs germinales en rechute ou réfractaires : résultats à long terme d’un essai randomisé prospectif. J Clin Oncol. 2012 ; 30 : 800-805.
- Lorch A, et al : Facteurs pronostiques chez les patients atteints de tumeurs germinales métastatiques qui ont connu l’échec du traitement par chimiothérapie de première ligne à base de cisplatine. J Clin Oncol. 2010 ; 28 : 4906-4911.
- Lorch A, et al : Conventional-dose versus high-dose chemotherapy as first salvage treatment in male patients with metastatic germ cell tumors : evidence from a large international database. J Clin Oncol. 2011 ; 29 : 2178-2184.
- Pico JL, et al : A random trial of high-dose chemotherapy in the salvage treatment of patients failing first-line platinum chemotherapy for advanced germ cell tumours. Ann Oncol. 2005 ; 16 : 1152-1159.
- Adra N, et al : Chimiothérapie à haute dose et transplantation autologue de cellules souches de sang périphérique pour les tumeurs germinales métastatiques en rémission : l’expérience de l’Université de l’Indiana. J Clin Oncol. 2017 ; 35(10) : 1096-1102.
- Albers P, et al : Guidelines on Testicular Cancer : 2015 Update. Eur Urol. 2015 ; 68(6) : 1054-1068.
- Feldman DR, et al : Métastases cérébrales chez les patients atteints de tumeurs à cellules germées : facteurs pronostiques et options de traitement-Analyse du groupe mondial sur le cancer à cellules germées. J Clin Oncol. 2016 ; 34 : 345-351.
- Bokemeyer C, et al : Chimiothérapie combinée avec gemcitabine, oxaliplatine, et paclitaxel chez les patients atteints de tumeurs à cellules germinales réfractaires au cisplatine ou en rechute multiple : une étude du German Testicular Cancer Study Group. Ann Oncol. 2008 ; 19 : 448-453.
InFo ONKOLOGIE & HÉMATOLOGIE 2022 ; 10(5) : 6-10











