La résection chirurgicale constitue le pilier principal du traitement des sarcomes osseux du bassin. Le traitement est complexe et doit être individualisé. L’échange de données et de connaissances d’experts permet de mieux comprendre la maladie. Le SwissSarcomaNetwork constitue une approche à cet égard.
Les tumeurs osseuses malignes primaires, appelées sarcomes de l’os, sont rares. Leur examen et leur traitement exigent en outre un haut degré d’interdisciplinarité et de coordination. En fonction de l’âge, de l’étendue de la maladie, de la localisation anatomique et de la taille de la tumeur, le traitement doit être individualisé. La chirurgie constitue le pilier principal du traitement et une résection microscopiquement complète est directement corrélée au taux de survie.
Selon l’Institut Rizzoli (www.ior.it), 16,5% de toutes les tumeurs osseuses malignes primaires se trouvent dans le bassin. Les plus fréquents sont le chondrosarcome (5,3%), le sarcome d’Ewing (4,8%), l’ostéosarcome (3,2%) et le chordome (2%). La répartition par âge et par sexe est généralement fonction de la biologie sous-jacente de la tumeur.
Clarification d’un sarcome pelvien
L’examen des sarcomes osseux pelviens est complexe, car la tumeur – en particulier lorsqu’elle se développe en intrapelvien – est souvent et longtemps inaccessible à la palpation, et les douleurs sont généralement considérées comme non spécifiques au départ. La douleur est principalement influencée par l’emplacement anatomique de la lésion, plutôt que par la biologie sous-jacente. Il n’est pas rare que les sarcomes pelviens soient déjà relativement importants au moment où le diagnostic est posé. Il est donc important d’envisager le diagnostic différentiel d’un sarcome pelvien [14].
Une radiographie de synthèse du bassin peut déjà montrer des contours flous qui peuvent indiquer une tumeur pelvienne. Les tumeurs plus importantes montrent l’étendue de la destruction osseuse et permettent ainsi une évaluation fondamentale de la stabilité mécanique. L’imagerie par résonance magnétique (IRM) à contraste amélioré par voie intraveineuse est la méthode de choix pour caractériser suffisamment la lésion. Il s’agit d’évaluer la position anatomique dans le bassin, ainsi que la relation avec les structures neurovasculaires, le périoste et les structures articulaires. La prise de contraste donne des informations sur la vascularisation de la lésion et donc sur son agressivité potentielle.
Si l’imagerie ne permet toujours pas d’exclure une suspicion de sarcome osseux, il faut toujours demander une biopsie. Le choix de la voie de biopsie est critique et doit être fait de manière à ce qu’elle puisse être retirée au cours de l’intervention chirurgicale ultérieure sans contamination évitable des tissus et sans ouverture inutile de compartiments supplémentaires, afin de minimiser l’ensemencement des cellules tumorales et donc le risque de récidive locale. De préférence, la biopsie est réalisée par une unité d’évaluation bien rodée composée d’un radiologue interventionnel, d’un pathologiste et d’un chirurgien. Afin de minimiser l’ensemencement des cellules tumorales, une biopsie à l’emporte-pièce doit être réalisée, car contrairement à la biopsie ouverte (avec 32%), le risque est nettement plus faible (0,37%) [1,2].
Le traitement d’un échantillon biopsique est critique et doit au moins être relu par un pathologiste de référence. Les analyses moléculaires font aujourd’hui partie du bilan initial standard, mais elles ne peuvent pas être proposées ou interprétées partout. Un traitement initial dans une unité d’évaluation avec des pathologistes de référence permet également d’éviter des retards inutiles pour le patient dans l’établissement du diagnostic. Si la malignité d’un résultat est confirmée, un examen de “staging” doit être effectué afin d’exclure une métastase dans les poumons (par tomodensitométrie) ou dans les os (scintigraphie du squelette, PET-CT ou IRM du corps entier).
Traitement néo-adjuvant
Le traitement néo-adjuvant des sarcomes pelviens dépend de la biologie de la tumeur [12]. Les chondrosarcomes sont généralement résistants aux radiations et à la chimiothérapie, et la chirurgie reste le traitement de choix, un traitement (néo)adjuvant n’étant pas nécessaire. Les patients atteints de sarcome d’Ewing suivent généralement un traitement combiné, commençant par une thérapie d’induction VIDE préopératoire (https://sarcoma.surgery/pdf/ewing-sarkom ) pendant environ 16 semaines, suivie de la chirurgie, puis de huit cycles VAC pendant 23 semaines supplémentaires. Les indications de la radiothérapie concomitante sont en train d’évoluer, avec une augmentation du nombre de résections R0 [11].
Les patients atteints d’ostéosarcome sont également traités par thérapie combinée. La chimiothérapie d’induction comprend l’adriamycine, le cisplatine, l’ifosfamide et le méthothrexate à haute dose, conformément au protocole de l’étude EURAMOS, la poursuite du traitement après l’opération étant adaptée au risque. Les chordomes sont souvent localement avancés et, historiquement, le traitement était basé soit sur la chirurgie, soit sur une combinaison avec la radiothérapie. La radiothérapie par particules ioniques peut constituer une alternative efficace à la résection chirurgicale, bien qu’il n’existe pas d’études robustes et comparatives. Des traitements systémiques tels que les inhibiteurs de tyrosine kinase sont à l’étude [12].
Types de résection
Le traitement chirurgical constitue le pilier principal du traitement des tumeurs malignes primaires du pelvis à visée curative. L’étendue de la résection chirurgicale du bassin dépend de l’extension anatomique de la tumeur et doit être définie, planifiée et réalisée sur la base de l’imagerie IRM préopératoire. L’objectif est d’enlever complètement la tumeur au microscope, quelle que soit sa biologie (même pour un chondrosarcome G1 par exemple), avec une marge de sécurité adéquate en tenant compte des barrières anatomiques (sans définir de mesure métrique).
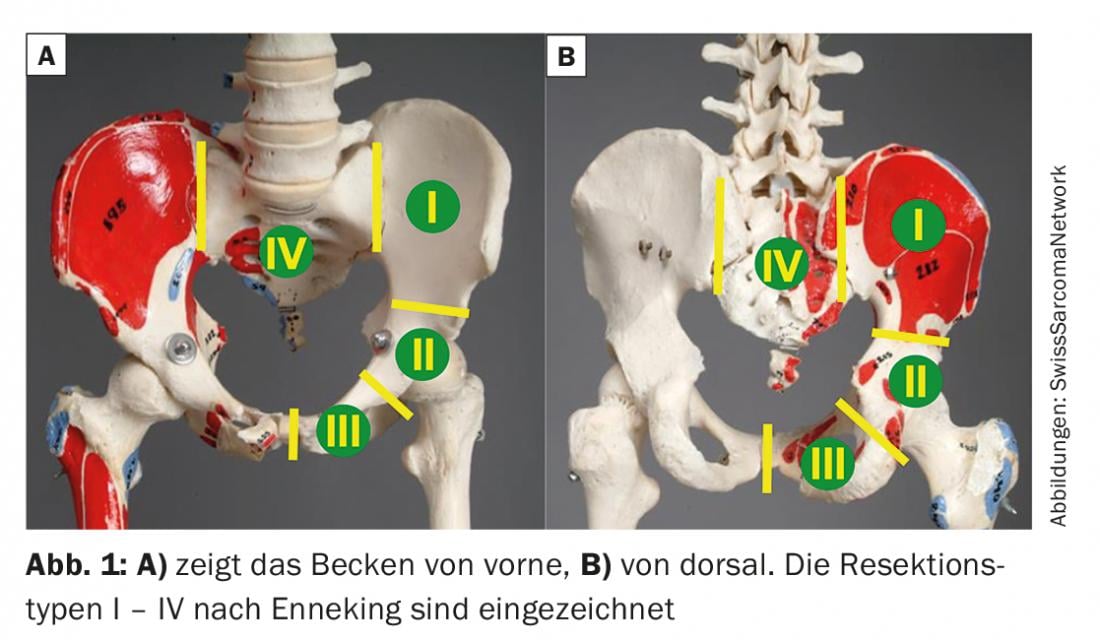
Les résections chirurgicales du bassin – ou hémipelvectomies dans le jargon médical – sont divisées en hémipelvectomies internes et externes. Dans ce dernier cas, le membre correspondant est également retiré, il s’agit d’une amputation dite de “Hindquarter”. En ce qui concerne l’indication, il convient d’évaluer l’infiltration tumorale de l’articulation de la hanche, des structures nerveuses (nerf sciatique) et des structures vasculaires (artère iliaque commune et branches). Si au moins deux des trois structures mentionnées doivent être réséquées en raison de l’infiltration tumorale, une hémipelvectomie externe est généralement envisagée. Les résections partielles du bassin avec conservation du membre inférieur sont appelées hémipelvectomies internes. Elles sont divisées en quatre types selon Enneking, et diverses combinaisons sont possibles (Fig. 1). Les résections de type I peuvent être réalisées avec ou sans interruption de l’anneau pelvien, et vont de l’articulation SI à l’acétabulum. Les résections de type II concernent l’acétabulum et les résections de type III le pubis. Ils peuvent être partiels ou complets, selon l’étendue de la tumeur. Les sarcomes pelviens peuvent dépasser l’articulation SI et nécessiter une résection de type I-IV ou, en cas d’infiltration de l’acétabulum ou de la pubis, une résection de type I-II, de type II-III ou de type I-II-III. En cas de résection du sacrum (résection de type IV), il faut avant tout détecter l’extension proximale de la tumeur sur l’imagerie. Le niveau d’ostéotomie dépend alors de la relation de la tumeur avec les racines nerveuses, qui peuvent être conservées au maximum avec une marge de sécurité adéquate. Selon l’étendue de la tumeur, une co-résection de l’ilium doit être envisagée (résection de type IV-I).
Les résections pelviennes sont anatomiquement complexes et nécessitent souvent l’utilisation de la navigation ou d’implants de coupe spécifiques au patient (PSI) [15,16]. Les coupes peuvent ainsi être réalisées au millimètre près après une planification 3D préalable.
Reconstructions
Les hémipelvectomies externes ne nécessitent généralement pas de reconstruction osseuse. Si une scoliose secondaire se développe, associée à une symptomatologie clinique, une stabilisation de la jonction lombo-pelvienne peut être envisagée. Les parties molles sont souvent recouvertes d’un lambeau de tissu mou glutéal. Même si les artères iliaques internes doivent être ligaturées en raison de l’extension de la tumeur, la vascularisation de ce lambeau est généralement assurée. Il est également possible de recourir à l’épiploon majeur comme lambeau de tissu mou vascularisé. En cas d’extension principale de la tumeur vers l’extrapelvien fémoral, le lambeau de tissu mou antérieur du muscle quadriceps est préféré pour la couverture des tissus mous, en se basant sur les vaisseaux fémoraux.
En cas d’hémipelvectomie interne, le type de reconstruction dépend de l’étendue de la résection. La reconstruction elle-même doit être individualisée en fonction du patient et dépend de nombreux autres facteurs tels que l’âge du patient ou la présence de métastases.
Dans le cas d’une résection de type I, il n’est pas nécessaire de procéder à une reconstruction tant que l’anneau pelvien est préservé. Si le pont osseux sur le foramen ischiadicum majus est trop faible, une allogreffe ou une autogreffe du reste du bassin peut être utilisée pour le renforcer. Si la continuité est interrompue, une reconstruction doit être effectuée dans la mesure du possible. L’objectif est d’obtenir une stabilité mécanique immédiate à l’aide de vis pédiculaires (lombaires et sacrées, ainsi que dans les piliers antérieurs et postérieurs) et de tiges, et d’obtenir une stabilité biologique à long terme par la mise en place d’une autogreffe de péroné (non) vascularisée ou d’une allogreffe, de sorte qu’il puisse en résulter une fonction normale [7].

En cas de résection de type II, une reconstruction doit être effectuée dans la mesure du possible afin de rétablir la continuité de l’anneau pelvien et d’améliorer ainsi la stabilité du bassin et la fonction de l’articulation de la hanche. Pour cela, il existe différentes options de reconstruction, dont le choix dépend entre autres de l’étendue de la résection locale. Les prothèses “sur étagère” peuvent être utilisées tant qu’il y a suffisamment d’os sur l’ilion pour permettre un ancrage sûr. Il existe également des options prothétiques “sur mesure”, où le fabricant d’implants imprime l’implant prothétique en 3D sur la base d’une tomographie assistée par ordinateur afin de reproduire l’anatomie spécifique du patient. Il est également possible d’utiliser du métal “trabéculaire”, où la partie osseuse manquante peut être reconstruite en peropératoire pour permettre la mise en place d’une prothèse. Comme alternative à la reconstruction prothétique, il est possible d’utiliser une allogreffe “en vrac” dans le sens d’un composite allogreffe-prothèse. En raison du taux de complications important, cette option est aujourd’hui moins utilisée. Une autre option, mais très spécifique, est l’autogreffe pasteurisée. Une fois la résection complétée, la tumeur est curetée et la préparation macroscopiquement exempte de tumeur est irradiée de manière extracorporelle à 50-90 Gy, éventuellement augmentée de ciment, puis replacée chez le patient [8].
Les résections de type III du bassin peuvent être unilatérales ou bilatérales. Les premières sont divisées en complètes et incomplètes, selon que l’anneau pelvien est maintenu en continuité ou non. Dans toutes les situations, la reconstruction n’est pas nécessaire.
Les résections de type IV concernent le sacrum, le niveau de l’ostéotomie se référant à la vertèbre sacrée correspondante ou à la racine nerveuse correspondante. En cas d’ostéotomie proximale, il est recommandé de procéder par voie antérieure et postérieure combinées. Une reconstruction osseuse n’est nécessaire que si la première vertèbre sacrée ne peut pas être conservée complètement [6]. Une résection distale de S3 n’entraîne généralement aucun déficit fonctionnel, alors qu’une résection incluant les racines nerveuses S2 peut entraîner une altération permanente de la miction et de la vidange intestinale, ce qui est très handicapant pour le patient. Malheureusement, les reconstructions de ces racines nerveuses n’ont pas montré de gain fonctionnel. Cependant, des problèmes de cicatrisation sont souvent observés lors de ces opérations. L’indication de reconstruction des tissus mous doit donc être posée de manière généreuse, comme par ex. Un lambeau de déplacement glutéal, un lambeau perforant lombaire, ou encore un lambeau VRAM transabdominal. Cependant, il est fréquent que les tumeurs du bassin soient relativement grandes et occupent plusieurs des zones mentionnées ci-dessus, ce qui nécessite une combinaison de types de résection.
Dans le cas d’une résection de type I-IV (ou IV-I), les reconstructions peuvent être effectuées de la même manière que pour les résections de type I. Les résections de type II peuvent être effectuées de la même manière.
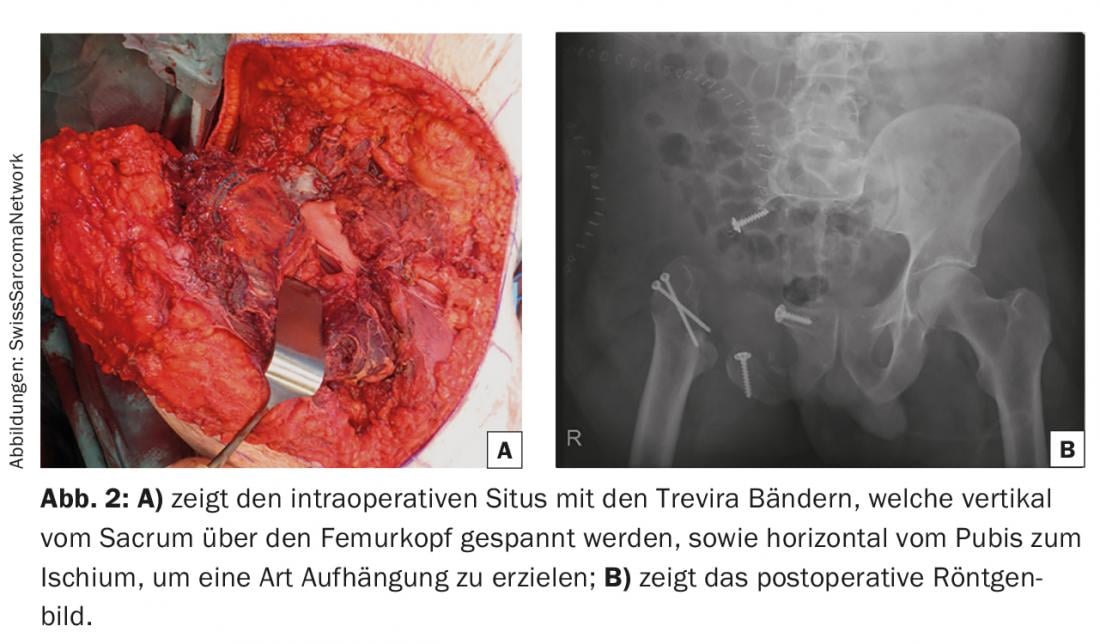
Pour les résections de type I-II (ou II-I), la décision doit être prise au cas par cas, les reconstructions sont analogues à celles mentionnées dans les résections de type I. Cependant, le point critique est l’emplacement de l’ostéotomie sur l’articulation sacro-iliaque. Bien que l’impression 3D basée sur le scanner permette de traiter chaque défaut avec une précision anatomique grâce à une prothèse “custom-made”, il est pratiquement impossible d’obtenir une stabilité à long terme en cas d’ostéotomie verticale pour des raisons mécaniques et l’échec de l’implant est la règle. Pour les défauts étendus, on a souvent recours à la résection-arthroplastie de Friedmann-Eilber [10]. Une modification consiste à utiliser deux tubes en Trévira, le premier étant fixé du fémur au sacrum et le second formant une boucle autour de celui-ci, en tirant du ramus superior pubis à l’ischium, de sorte qu’il en résulte une suspension (Fig. 2).
- Les résections de type II-III (ou III-II) sont reconstruites de la même manière que les résections de type II.
- Les résections de type I-II-III sont reconstruites comme mentionné dans les résections de type II-III.
Les exentérations occupent une place particulière. L’exentération postérieure se fait généralement d’abord par voie antérieure, par laparotomie et préparation de la tumeur intra- et/ou rétropéritonéale, pour ensuite repositionner le patient et le compléter par voie dorsale au moyen d’une sacrectomie. L’exentération antérieure commence également par une laparotomie et une dissection de la tumeur, puis par la présentation du stroma pelvien après extrapelvin, afin de compléter par une symphysectomie bilatérale (ou résection de type III).
Défis chirurgicaux et résultats
Les résections chirurgicales du bassin sont exigeantes et nécessitent une grande compréhension lors de la planification ainsi qu’une collaboration interdisciplinaire optimale lors de la mise en œuvre. Le principe est que plus la marge de sécurité est grande, plus le contrôle potentiel de la tumeur est grand et plus les pertes fonctionnelles potentielles sont importantes. De plus, les distances de sécurité ne peuvent pas être définies dans les extrémités comme c’est habituellement le cas, car il n’existe pas de compartiments correspondants. En ce qui concerne la fonction, il faut tenir compte du fait que la reconstruction de l’anneau pelvien ne conduit pas nécessairement à une bonne fonction. En effet, une résection des muscles abducteurs ou d’une racine nerveuse ou d’un nerf principal peut entraîner des pertes fonctionnelles considérables.
Les patients atteints d’ostéosarcome pelvien ont un pronostic relativement mauvais, avec une survie à 5 ans d’environ 40% [5]. Il est intéressant de noter que la valeur de la chimiothérapie néoadjuvante est même remise en question [13]. Les patients atteints du sarcome d’Ewing du bassin atteignent une survie de 37% à 5 ans [9]. Chez les patients atteints de chondrosarcome, la survie est directement corrélée au grade. Le taux de mortalité est de 3% pour le G1, 33% pour le G2 et 54% pour le G3, avec, outre le grade, une corrélation négative directe entre les marges de sécurité de la résection et la taille des tumeurs [3]. La même relation s’applique aux patients atteints de chordomes sacrés, avec un taux de survie à 5 ans de 74% [4].
Perspectives
Malgré un traitement combiné maximal, les sarcomes pelviens restent associés à un mauvais pronostic. La chirurgie constitue le pilier principal pour les maladies localisées, et la résection incomplète de la tumeur est corrélée à un mauvais contrôle de la tumeur, ce qui conduit souvent au décès. Pour mieux comprendre ces maladies, nous devons avoir de meilleurs échanges interdisciplinaires au niveau local, national et international. Cela nécessite de passer de la pensée classique en termes de disciplines (appelée “médecine centrée sur les disciplines”) à la “médecine centrée sur les problèmes” afin de traiter nos patients de manière optimale. Le SwissSarcomaNetwork (www.swiss-sarcoma.net) constitue une approche à cet égard.
Messages Take-Home
- Les sarcomes osseux du bassin sont rares et leur pronostic est moins bon que celui des sarcomes osseux des membres.
- L’évaluation et le traitement des patients atteints de sarcomes osseux du bassin nécessitent un haut degré d’interdisciplinarité et de coordination.
- La chirurgie constitue le pilier principal du traitement, en particulier lorsque la maladie est localisée.
- L’échange interrégional ou international de données et de connaissances d’experts permet de mieux comprendre la maladie.
Littérature :
- Barrientos-Ruiz I, et al : Are Biopsy Tracts a Concern for Seeding and Local Recurrence in Sarcomas ? Clin Orthop Relat Res 2017 ; 475 : 511-518.
- Berger-Richardson D, Swallow CJ : Insufflation du canal artériel après biopsie percutanée d’un sarcome : considérations de risque/bénéfice. Cancer 2017 ; 123 : 560-567.
- Bus MPA, et al : Conventional Primary Central Chondrosarcoma of the Pelvis : Prognostic Factors and Outcome of Surgical Treatment in 162 Patients. The Journal of Bone and Joint Surgery 2018 ; 100 : 316-325.
- Fuchs B, et al : Gestion chirurgicale du chordome sacral. J Bone Joint Surg Am 2005 ; 87 : 2211-2216.
- Fuchs B, et al : Osteosarcoma of the pelvis : outcome analysis of chirurgical treatment. Clin Orthop Relat Res. 2009 ; 467 : 510-518.
- Hugate RR, et al. : Effets mécaniques de la sacrectomie partielle : quand une reconstruction est-elle nécessaire ? Clin Orthop Relat Res 2006 ; 450 : 82-88.
- Krieg AH, Hefti F : Reconstruction avec des greffons fibulaires non vascularisés après résection de tumeurs osseuses. J Bone Joint Surg Br 2007 ; 89 : 215-221.
- Krieg AH, Mani M, Speth BM, Stalley PD : Irradiation extracorporelle pour la reconstruction pelvienne dans le sarcome d’Ewing. J Bone Joint Surg Br 2009 ; 91 : 395-400.
- Laitinen M, et al : Outcome of Pelvic Bone Sarcomas in Children. J Pediatr Orthop. 2016.
- Schwartz AJ, et al : L’arthroplastie par résection de Friedman-Eilber du bassin. Clin Orthop Relat Res 2009 ; 467 : 2825-2830.
- Whelan J, et al : La survie est influencée par les approches. Clin Sarcoma Res. 2018:1-13.
- Whelan JS, Davis LE. Ostéosarcome, chondrosarcome et chordome. Journal of Clinical Oncology 2018 ; 36 : 188-193.
- Xu J, Xie L, Guo W : Chimiothérapie néoadjuvante suivie d’une chirurgie différée. Clin Orthop Relat Res 2018 : 1.
- Fuchs B, et al. : Évaluation préthérapeutique et définition de la stratégie chez les patients atteints de tumeurs des os et des tissus mous. Luzerner Arzt 2017 ; 109 : 1-5.
- Jentzsch T, et al : Résection tumorale au niveau du pelvis à l’aide d’une planification en trois dimensions et d’instruments spécifiques au patient : une série de cas. World J Surg Oncol 2016 14(1) : 249.
- Sternheim A, et al : Cone-beam computed tomography-guided navigation in complex osteotomies improves accuracy at all competence levels : a study assessing accuracy and reproduciblitiy of joint-sparing bone cuts. J Bone Joint Surg Am 2018 : 100 (10).
InFo ONKOLOGIE & HÉMATOLOGIE 2018 ; 6(5) : 8-12