La douleur chronique est le problème de santé le plus fréquemment signalé par les patients atteints de paraplégie. En raison de l’apparition de différents types de douleurs et de mécanismes douloureux dans le cadre du modèle bio-psycho-social de la maladie, le traitement de la douleur dans ce groupe de patients représente un défi particulier.
La douleur chronique est le problème de santé le plus fréquemment signalé par les patients atteints de paraplégie. En raison de l’apparition de différents types de douleurs et de mécanismes douloureux dans le cadre du modèle bio-psycho-social de la maladie, le traitement de la douleur dans ce groupe de patients représente un défi particulier. Comme le montrent des données récentes, celle-ci peut réussir au sein d’une équipe interdisciplinaire. Les paragraphes suivants traitent de l’apparition, de l’importance et de la physiopathologie des douleurs chroniques en cas de paralysie médullaire ainsi que des approches diagnostiques et thérapeutiques.
Présence et importance
Parmi les cinq problèmes de santé les plus fréquemment rapportés par les patients atteints de paralysie médullaire en Suisse, la douleur occupe la première place [1], devant les problèmes liés à la fonction vésicale, à l’hygiène corporelle, à l’évacuation des intestins ou à la marche. Un travail de synthèse met en évidence l’ampleur des répercussions de la douleur à différents niveaux somatiques, psychologiques et sociaux [2]. Par exemple, la douleur chronique peut persister et s’aggraver au fil du temps, avoir un impact négatif sur la participation et les résultats de la rééducation, entraîner un handicap fonctionnel avec perte de mobilité, réduire la qualité de vie, perturber le sommeil, affecter la participation aux activités quotidiennes et rendre le retour au travail plus difficile. La présence de douleurs neuropathiques dans la phase précoce de trois à six mois après la blessure rend probable la persistance de ces douleurs après trois à cinq ans.
Les données suisses actuelles font état d’une prévalence élevée de 74% de douleurs chroniques chez les patients atteints de paralysie médullaire, ainsi que de facteurs de risque tels que le sexe féminin, l’âge avancé, les situations financières difficiles et également les problèmes de santé secondaires [3]. Les données de prévalence élevées correspondent également aux données connues au niveau international avec une prévalence de la douleur chez les paraplégiques de 84% [4]. Parmi celles-ci, outre les douleurs musculo-squelettiques qui présentent une prévalence de 59%, les douleurs neuropathiques occupent également une place importante (douleur neuropathique au niveau de la blessure 41%, en dessous du niveau de la blessure 34%). Parmi les douleurs musculo-squelettiques, les plus fréquentes sont les maux de dos (43-55% [5]) et les douleurs d’épaule (35% [6]). La prévalence élevée de la spasticité dans la paraplégie (71%) [7] est importante en raison des liens existants entre la spasticité et la douleur [8].
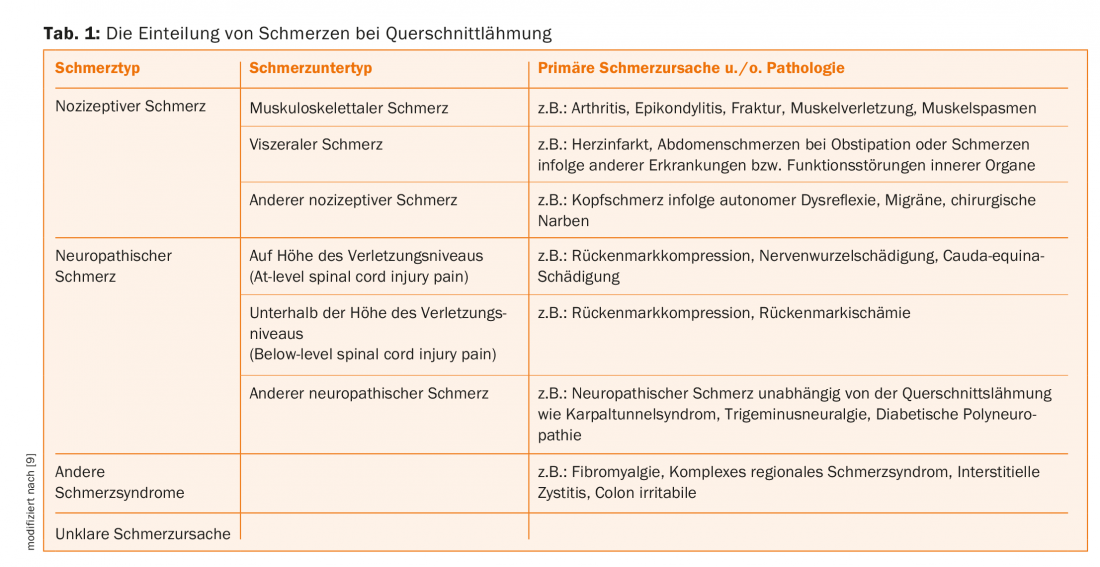
Classification des douleurs en cas de paralysie médullaire
Selon la classification des douleurs liées à la paralysie médullaire mise à jour en 2012 par l’International Spinal Cord Society, nous distinguons les syndromes douloureux nociceptifs, neuropathiques, les autres syndromes douloureux définis ainsi que les douleurs non attribuables [9]. (Tab. 1). En conséquence, parmi les douleurs nociceptives, on distingue les douleurs musculo-squelettiques dues à des pathologies musculaires, osseuses ou articulaires, les douleurs viscérales dues à des maladies et des dysfonctionnements d’organes internes et les autres douleurs nociceptives telles que les céphalées dues à une dysréflexie autonome. Les douleurs dues à la spasticité sont également classées parmi les douleurs nociceptives. Dans le groupe des douleurs neuropathiques, on distingue d’une part les douleurs neuropathiques dues à la lésion nerveuse, qui sont directement liées à la lésion de la moelle épinière ou à la lésion de la cauda equina, et d’autre part les douleurs neuropathiques qui existent indépendamment des lésions mentionnées. Les premières sont divisées en douleurs neuropathiques au niveau de la blessure (At-level spinal cord injury pain) et en douleurs neuropathiques en dessous du niveau de la blessure (Below-level spinal cord injury pain). Les douleurs neuropathiques indépendantes de la paralysie médullaire, telles que le syndrome du canal carpien, la névralgie du trijumeau, la polyneuropathie diabétique et autres, sont appelées “autres douleurs neuropathiques”. Les syndromes douloureux définis tels que la fibromyalgie, le syndrome douloureux régional complexe ou le côlon irritable sont classés dans ce que l’on appelle les autres syndromes douloureux. Enfin, il n’est pas toujours possible de classer le syndrome douloureux sur le plan étiologique. Dans ce cas, le syndrome douloureux est appelé “douleur non attribuable” [9,10]. Les caractéristiques cliniques permettant de distinguer les types de douleurs mentionnés sont présentées dans le tableau 1.

Diagnostic de la douleur chez les paralysés médullaires
Pour une présentation détaillée des étapes du diagnostic, nous vous renvoyons à la littérature [10]. Comme nous le verrons en détail plus loin, le traitement multimodal interdisciplinaire de la douleur comprend également un diagnostic intégré de la douleur par toutes les équipes [11]. Un algorithme de diagnostic est présenté dans la figure 1. En conséquence, toute personne impliquée dans la prise en charge de patients paralysés médullaires, idéalement un médecin spécialiste de la douleur, devrait envisager la présence de différents types de douleur en se basant sur les caractéristiques cliniques présentées dans l ‘aperçu 1 et faire appel aux différentes disciplines spécialisées en fonction des diagnostics de suspicion de douleur nociceptive ou neuropathique, étape par étape, selon la présentation clinique. Sur le plan clinique, il convient d’enregistrer les lieux de la douleur (il est utile de dessiner la douleur), des informations sur le caractère de la douleur, son intensité, son évolution au cours de la journée ou sa dépendance vis-à-vis de l’activité physique et des fonctions organiques. Idéalement, à la fin, tous les médecins et thérapeutes impliqués devraient discuter ensemble des résultats de l’examen et poser des diagnostics que tous les membres de l’équipe peuvent soutenir pour l’essentiel.
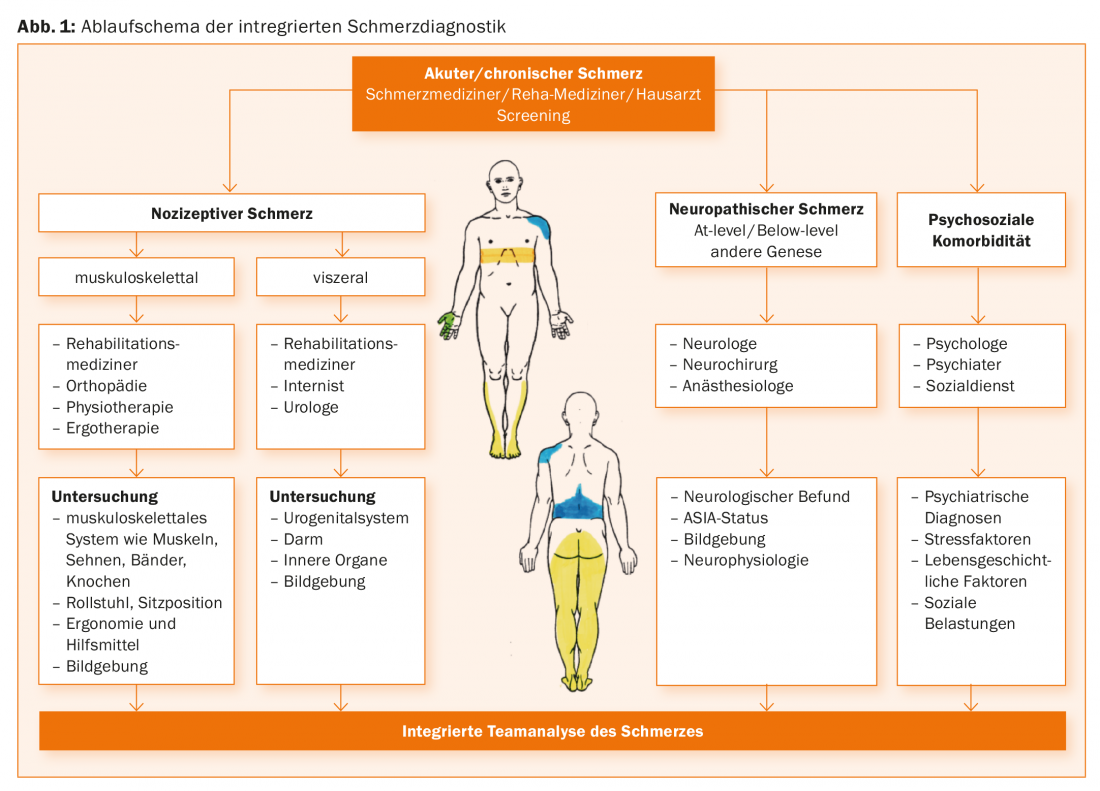
Selon la définition de l'”International Association for Study of Pain” (IASP) [12], la douleur nociceptive résulte de l’activation de nocicepteurs en raison d’une lésion actuelle ou imminente de tissus non neuronaux. Dans ce cas, contrairement à la douleur neuropathique, il existe un fonctionnement normal du système somatosensoriel. En fonction du tableau clinique, il convient ici d’impliquer dans le diagnostic des médecins rééducateurs, des orthopédistes, des internistes, des urologues, des physiothérapeutes et des ergothérapeutes afin de déceler avant tout les causes du système musculo-squelettique comme les muscles, les tendons, les ligaments et les os. De même, il est souvent nécessaire d’évaluer le fauteuil roulant et son ergonomie, y compris la position assise. En ce qui concerne le système viscéral, l’examen du système urogénital, du système intestinal et des organes internes joue un rôle. De manière générale, les techniques d’imagerie doivent également être incluses.
La douleur neuropathique est définie par l’IASP comme une douleur causée par une lésion ou une maladie du système somatosensoriel [12]. Pour le diagnostic des douleurs neuropathiques, il est recommandé d’utiliser un schéma de graduation [13], qui existe sous une forme adaptée pour le diagnostic des douleurs neuropathiques dues à une paralysie médullaire [14]. Dans ce cas, l’anamnèse exige la présence d’une paraplégie et d’une douleur au niveau ou en dessous du niveau de la blessure, l’appareillage la preuve d’une lésion de la moelle épinière ou de la cauda equina et le diagnostic différentiel l’exclusion d’autres causes de douleur. Si seules les données anamnestiques telles que les antécédents de paraplégie et les douleurs au niveau ou en dessous du niveau de la blessure sont remplies, il s’agit d’une possible douleur neuropathique. Si tous les critères diagnostiques suivants sont également remplis, comme la démonstration de signes sensoriels positifs ou négatifs, la mise en évidence par un appareil d’une lésion de la moelle épinière ou de la cauda equina et l’exclusion d’autres causes de douleur, il s’agit d’une douleur neuropathique certaine. Si seulement deux des trois critères mentionnés sont remplis, seule une douleur neuropathique probable due à la paraplégie peut être diagnostiquée.
Comme mentionné ci-dessus, le niveau de blessure joue un rôle important dans la classification des douleurs neuropathiques en cas de paraplégie. Le niveau de lésion neurologique est défini comme le segment le plus caudal de la moelle épinière avec une sensibilité normale au toucher léger et à la sensation de pointe et une fonction motrice normale [15]. On parle donc de douleur neuropathique au niveau de la blessure (At-level spinal cord injury pain) lorsqu’elle se situe dans le dermatome du niveau neurologique de la blessure, y compris la douleur au niveau de la colonne vertébrale. jusqu’à trois des dermatomes sous-jacents. D’autre part, on parle de douleur neuropathique en dessous du niveau de la blessure (Below-level spinal cord injury pain) lorsque la douleur s’étend sur plus de trois dermatomes en dessous du niveau de la blessure ou est généralement en dessous de ce niveau. Alors que la douleur neuropathique au niveau de la blessure peut être d’origine neuropathique centrale en cas de lésion de la moelle épinière ou d’origine neuropathique périphérique en cas, par exemple, de lésion traumatique de la racine nerveuse au niveau de la blessure, la douleur neuropathique en dessous du niveau de la blessure est toujours, par définition, une douleur neuropathique générée au niveau central. Les douleurs neuropathiques du syndrome de la cauda equina constituent une forme particulière, car elles correspondent à une cause de douleur neuropathique périphérique en raison de l’atteinte de la racine nerveuse de la cauda equina et sont donc classées par définition dans le groupe des douleurs neuropathiques au niveau lésionnel, même si l’extension de la douleur se situe au-delà de trois segments en dessous du niveau de la lésion neurologique [9]. L’apparition de douleurs neuropathiques plus d’un an après la lésion ou la modification du syndrome douloureux après un intervalle stable, alors éventuellement associée à une modification du statut neurologique, peut être l’expression d’une syringomyélie ou d’une autre pathologie spinale. Dans ce cas, il convient dans tous les cas de procéder à une imagerie, si elle est appropriée, au moyen d’une imagerie par résonance magnétique (IRM). Le cas échéant, il peut être nécessaire d’impliquer des neurochirurgiens dans le diagnostic. La syringomyélie est fréquente en moyenne 15 ans après un traumatisme, principalement en cas de paraplégie complète et au niveau du rachis cervical [16].
Diagnostic neurophysiologique et instrumental
Conformément au schéma diagnostique mentionné précédemment, le diagnostic de lésion de la moelle épinière ou de la cauda equina se fait de manière standard par IRM [17]. Dans la plupart des cas, des lésions peuvent être détectées chez les patients atteints ou non de douleurs neuropathiques dues à la paraplégie. Dans ce cas, la neurophysiologie clinique n’a qu’une importance secondaire dans le diagnostic de la douleur neuropathique, car même les patients sans douleur neuropathique présentent des résultats pathologiques. Les examens électrophysiologiques peuvent compléter l’examen clinique et améliorer le diagnostic de la paraplégie. Il s’agit notamment des potentiels évoqués somatosensoriels (SEP) comme test de la fonction du cordon postérieur, des potentiels évoqués par laser (LEP) et des potentiels évoqués par chaleur de contact (CHEPS) comme test de la fonction du tractus spinothalamique antérieur, des potentiels évoqués moteurs après stimulation magnétique transcrânienne comme test du tractus corticospinal et de la réponse cutanée sympathique comme test des voies sympathiques de la moelle épinière [18].
Comme expliqué précédemment, le diagnostic de la douleur neuropathique implique l’examen du système somatosensoriel [13]. En cas de lésion douteuse (par ex. artefacts métalliques à l’IRM) ou de lésion atypique à l’IRM (lésion en dehors des voies sensorielles), l’utilisation de méthodes spéciales disponibles uniquement dans les centres, telles que la LEP et le test sensoriel quantitatif (QST), peut aider à poser le diagnostic de douleur neuropathique due à une paraplégie [19]. Le test sensoriel quantitatif établit un profil des phénomènes sensoriels positifs ou négatifs [20]. Le QST a permis de montrer que le développement de douleurs neuropathiques suite à une paralysie médullaire s’accompagne de l’apparition d’une sensibilité accrue, comme l’hyperalgésie de Pinprick et l’allodynie [21,22], de sorte que le QST permet éventuellement d’identifier précocement les patients à risque de douleurs neuropathiques.
En ce qui concerne les nombreux mécanismes à l’origine des douleurs neuropathiques dues à la paraplégie, nous vous renvoyons à [10].
Les facteurs psychologiques jouent un rôle central dans le traitement de la douleur, conformément au modèle bio-psycho-social de la maladie [23] [24] . Selon cette étude, des facteurs tels que la catastrophisation de la douleur, l’anxiété liée à la douleur, la tension et l’évitement de la douleur ainsi que l’impuissance peuvent conduire à une augmentation de la douleur et à une moins bonne gestion de la douleur. Les facteurs qui peuvent réduire l’intensité de la douleur et améliorer la gestion de la douleur sont par exemple l’auto-efficacité, les stratégies de gestion de la douleur, la volonté de changement et l’acceptation de la douleur. L’implication des facteurs mentionnés a également été confirmée pour les patients souffrant de douleurs chroniques en cas de paraplégie [3,25,26]. Afin d’évaluer les facteurs psychologiques susmentionnés qui peuvent contribuer à la chronicité ou à la persistance de la douleur, une évaluation psychologique devrait toujours être effectuée en cas de suspicion de la même chose. Les indices de facteurs psychosociaux associés pertinents peuvent être des symptômes dépressifs, des troubles de l’appétit, une faible motivation ou participation aux activités quotidiennes, des indices de catastrophisme ou de préjugés concernant le diagnostic de la douleur, des symptômes d’anxiété et de panique, des troubles du sommeil, un manque de soutien familial ou des indices d’abus ou de dépendance à l’alcool, aux drogues ou aux médicaments [27].
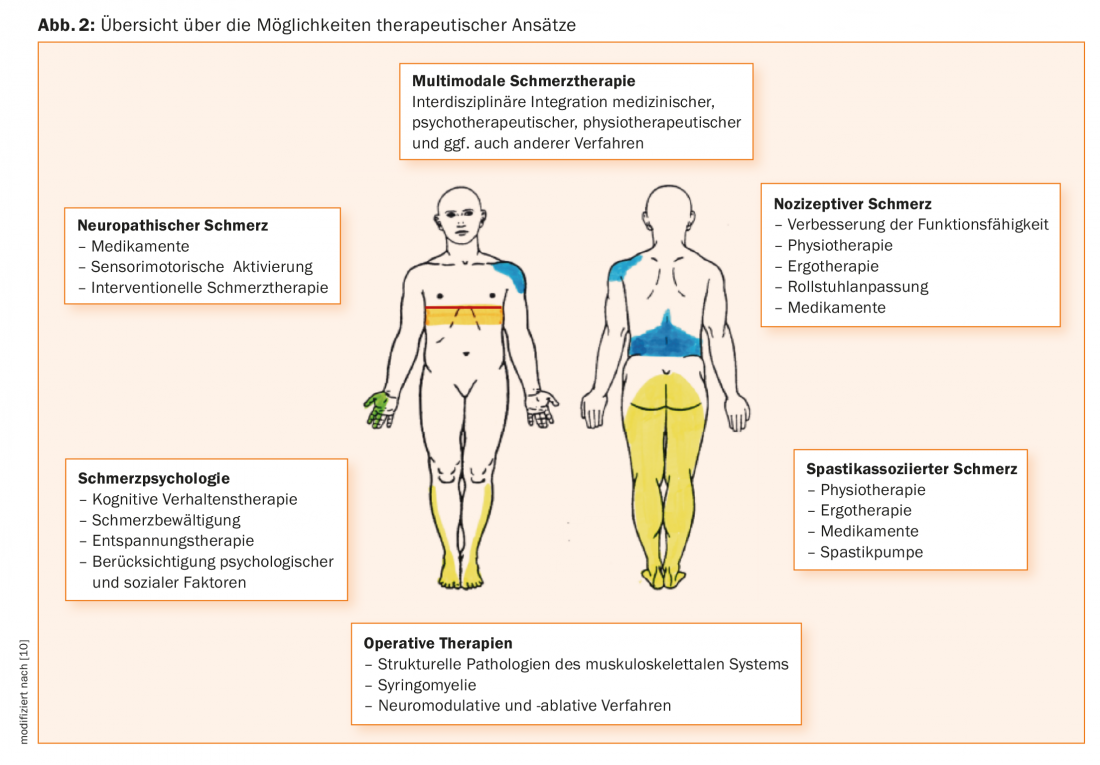
Approche thérapeutique multimodale interdisciplinaire
Conformément au modèle bio-psycho-social de la maladie [23], une approche thérapeutique multimodale interdisciplinaire s’est établie dans le traitement de la douleur chronique [11]. Il s’agit d’une approche intégrée qui englobe toutes les équipes, y compris les médecins, les physiothérapeutes, les psychologues et d’autres spécialistes. Les réunions d’équipe régulières et une communication interprofessionnelle structurée sont au cœur de cette approche. Cette approche peut se faire dans le cadre d’un patient individuel, où tous les médecins et thérapeutes impliqués traitent le patient sur la base de rendez-vous individuels, ou dans le cadre de programmes de groupe bien établis. Dans le meilleur des cas, un paraplégique souffrant de douleurs devrait être traité dans un centre disposant de l’expertise nécessaire. En revanche, une équipe ambulatoire bien rodée, composée de thérapeutes individuels, peut également obtenir de bons résultats si la communication est bonne.
Comme la douleur apparaît tôt chez les patients atteints de paraplégie et a tendance à persister, un traitement précoce est recommandé [28]. Une approche thérapeutique interdisciplinaire est prise en compte dans une revue récente [29]. Aperçu 2 donne un aperçu des options thérapeutiques actuelles qui devraient être appliquées en équipe interdisciplinaire.
Thérapie médicale
Traitement médicamenteux antinociceptif : le traitement médicamenteux de la douleur nociceptive comprend des analgésiques non opioïdes (par ex. paracétamol, métamizole, anti-inflammatoires non stéroïdiens [NSAR]) et également des opioïdes. Selon une ligne directrice thérapeutique pour les patients souffrant de lombalgie chronique sans paraplégie, ces médicaments ne représentent toutefois qu’une option thérapeutique de soutien et devraient être évalués toutes les quatre semaines en ce qui concerne leur effet et leurs effets secondaires, ou tous les trois mois en ce qui concerne la poursuite du traitement [30]. En cas d’interactions entre la douleur et la spasticité, il convient également d’essayer d’optimiser le traitement de la spasticité. En cas de douleurs viscérales liées au transit intestinal, il faudrait penser à optimiser le transit par des laxatifs.
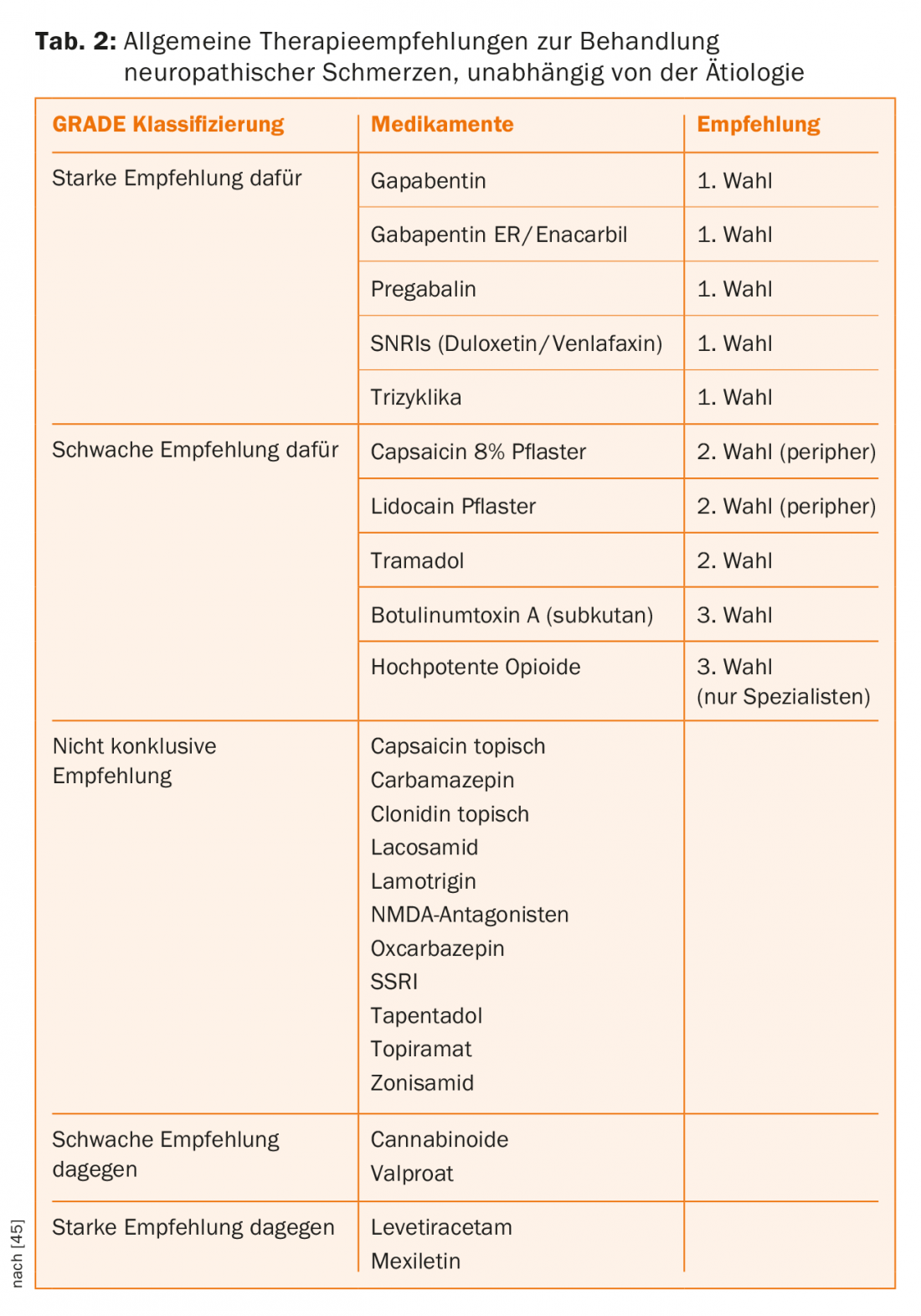
Traitement médicamenteux antineuropathique : le traitement médicamenteux des douleurs neuropathiques dues à la paralysie médullaire est résumé dans une guideline actuelle [31]. Les médicaments de premier choix recommandés sont la prégabaline, la gabapentine et l’amitriptyline, et les médicaments de deuxième choix sont le tramadol et la lamotrigine, cette dernière uniquement en cas de paraplégie incomplète. Les opioïdes sont considérés comme un traitement de quatrième intention (tableau 2). Si ces options médicamenteuses ne permettent pas d’obtenir de bons résultats, il est acceptable de recourir aux recommandations thérapeutiques générales de l’IASP (tableau 2).
Traitement interventionnel/neurochirurgical de la douleur : en ce qui concerne les douleurs neuropathiques dues à la paraplégie, les preuves sont limitées pour les procédures telles que la stimulation épidurale de la moelle épinière (SCS), la stimulation cérébrale profonde (DBS), la stimulation du cortex moteur (MCS), l’opération DREZ (dorsal root entry zone lesioning) et la myélotomie, et ces options ne peuvent donc pas être recommandées de manière générale. Dans chaque cas, des centres expérimentés sont nécessaires pour évaluer ces procédures [31] (voir également le tableau 2).

Physiothérapie/ergothérapie : les approches physiothérapeutiques sont principalement utilisées dans le traitement des douleurs nociceptives. Les objectifs de la physiothérapie peuvent être, selon le tableau clinique, l’élaboration du contrôle postural, du contrôle des mouvements ou d’un contrôle du tronc atteignable, le traitement des déséquilibres musculaires et les adaptations de transfert. Par exemple, les concepts thérapeutiques de Bobath ou de Vojta peuvent être appliqués ici. En particulier, les techniques manuelles et les traitements des tissus mous peuvent avoir un effet positif. L’adaptation optimale du fauteuil roulant est étroitement liée aux approches physiothérapeutiques. L’objectif de celle-ci est le réglage ergonomique du fauteuil roulant et de l’environnement en fonction des conditions et des exigences individuelles du paraplégique. L’optimisation de la position assise permet d’améliorer la stabilité de l’assise et de réduire ainsi les mauvaises sollicitations au niveau des épaules, de la nuque et du dos.
Psychologique : dans le traitement psychologique de la douleur, la thérapie cognitivo-comportementale (TCC) est une méthode fréquemment utilisée pour les problèmes psychosociaux [32]. La TCC a des effets positifs sur les variables de la douleur et du comportement chez les patients souffrant de syndromes douloureux chroniques, y compris les maux de dos [33]. De plus, des influences positives de la TCC sur la santé psychologique des personnes atteintes de paraplégie ont été démontrées [34]. D’autres procédés peuvent inclure, par exemple, des techniques de relaxation, l’hypnose, des méthodes basées sur la pleine conscience et des exercices de psychologie positive [35–37], qui ont également été partiellement étudiés dans le traitement de la douleur en cas de paralysie médullaire.
Programmes thérapeutiques multimodaux interdisciplinaires : La supériorité des thérapies pluridisciplinaires sur les traitements individuels est connue depuis longtemps [38]. De telles approches thérapeutiques peuvent conduire à une amélioration de la douleur et de l’humeur, à une réinsertion professionnelle et à une réduction des coûts de santé. En particulier, l’efficacité de programmes thérapeutiques interdisciplinaires basés sur la thérapie cognitivo-comportementale a été démontrée [39]. Il existe désormais des preuves de programmes interdisciplinaires multimodaux de traitement de la douleur pour les patients souffrant de douleurs neuropathiques chroniques dues à une paraplégie, avec des améliorations démontrées de l’anxiété et de la dépression, de la qualité du sommeil, de l’intensité de la douleur, du handicap lié à la douleur, de la participation et de la gestion de la douleur [40–43].
Sur la base de notre propre programme interdisciplinaire de traitement multimodal de la douleur chez des piétons souffrant de lombalgie chronique [44], qui ne durait certes qu’une semaine, mais qui comprenait une intensité de traitement élevée de 34 heures, nous avons pu démontrer des effets positifs durables jusqu’à un an en ce qui concerne l’atteinte à la douleur, la qualité de vie, le handicap lié à la douleur, la dépression et l’acceptation de la douleur. Nous avons désormais mis en place un programme hebdomadaire de ce type pour les paralysés médullaires souffrant de douleurs chroniques, qui est actuellement en cours d’évaluation. Les points forts de ce programme correspondent pour l’essentiel à ceux des études susmentionnées sur la paralysie médullaire, comme l’éducation médicale sur les questions spécifiques à la paraplégie ou à la douleur, la physiothérapie des douleurs nociceptives et de la spasticité, la thérapie d’entraînement médicale, la pleine conscience, l’ergothérapie concernant la position assise, l’adaptation et l’ergonomie du fauteuil roulant, ainsi que des contenus psychologiques comme les bases de la psychologie de la douleur, l’acceptation de la douleur, la gestion du stress, la thérapie de relaxation et autres (fig. 3).

Messages Take-Home
- En raison de l’apparition de différents types et mécanismes de douleur dans le cadre du modèle de maladie bio-psycho-social, le traitement de la douleur chez les patients atteints de paralysie médullaire constitue un défi particulier.
- Conformément au modèle bio-psycho-social de la maladie, une approche thérapeutique interdisciplinaire multimodale est recommandée dans le traitement de la douleur chronique.
- La supériorité des thérapies pluridisciplinaires sur les traitements individuels est connue depuis longtemps. En particulier, l’efficacité des programmes thérapeutiques interdisciplinaires basés sur la thérapie cognitivo-comportementale a été démontrée.
Littérature :
- Rubinelli S, Glassel A, Brach M : From the person’s perspective : Perceived problems in functioning among individuals with spinal cord injury in Switzerland. J Rehabil Med. 2016 ; 48(2):235-243.
- Siddall PJ : Prise en charge de la douleur neuropathique suite à une lésion du cordon spinal : aujourd’hui et à l’avenir. Cordon spinal. 2009 ; 47(5) : 352-359. Epub 2008/11/13.
- Muller R, Landmann G, Bechir M, et al : Chronic pain, depression and quality of life in individuals with spinal cord injury : Mediating role of participation. J Rehabil Med 2017 ; 49(6) : 489-496. Epub 2017/06/10.
- Siddall PJ, McClelland JM, et al : A longitudinal study of the prevalence and characteristics of pain in the first 5 years following spinal cord injury. Pain 2003 ; 103(3) : 249-57. Epub 2003/06/07.
- Michailidou C, Marston L, De Souza LH, Sutherland I : A systematic review of the prevalence of musculoskeletal pain, back and low back pain in people with spinal cord injury. Handicap et réadaptation. 2014 ; 36(9) : 705-715. Epub 2013/07/12.
- Bossuyt FM, Arnet U, et al : Shoulder pain in the Swiss spinal cord injury community : prevalence and associated factors. Disability and rehabilitation 2018 ; 40(7) : 798-805. Epub 2017/01/14.
- Andresen SR, Biering-Sorensen F, et al : Douleur, spasticité et qualité de vie chez les personnes souffrant d’une lésion traumatique de la moelle épinière au Danemark. Spinal cord 2016 ; 54(11) : 973-979. Epub 2016/11/05.
- Finnerup NB : Douleur neuropathique et spasticité : conséquences intricables des lésions du cordon spinal. Cordon spinal 2017 ; 11(10) : 70. Epub 2017/07/12.
- Bryce TN, Biering-Sorensen F, et al : International spinal cord injury pain classification : part I. Background and description. March 6-7, 2009, Spinal cord 2012 ; 50(6) : 413-417, Epub 2011/12/21.
- Landmann G, Chang EC, et al. : [Pain in patients with paraplegia]. Douleur 2017 ; 31(5) : 527-545. Epub 2017/09/25.
- Kaiser U, Treede RD, Sabatowski R : Multimodal pain therapy in chronic noncancer pain-gold standard or need for further clarification ? Douleur 2017 ; 158(10) : 1853-1859.
- Loeser JD, Treede RD : Le protocole de Kyoto de la terminologie de base de la douleur de l’IASP. Douleur 2008 ; 137(3) : 473-477. Epub 2008/06/28.
- Finnerup NB, Haroutounian S, et al : Neuropathic pain : an updated grading system for research and clinical practice. Pai. 2016 ; 157(8):1599-1606.
- Finnerup NB : Douleur chez les patients souffrant d’une lésion de la moelle épinière. Pain 2013 ; 154 Suppl 1(1) : S71-76. Epub 2013/02/05.
- Kirshblum SC, Burns SP, et al : Normes internationales pour la classification neurologique des lésions de la moelle épinière (révisées en 2011). The journal of spinal cord medicine 2011 ; 34(6) : 535-546. Epub 2012/02/15.
- Krebs J, Koch HG, et al. : Les caractéristiques de la syringomyélie post-traumatique. Cordon rachidien. 2015 ; 1(10) : 218. Epub 2015/12/02.
- Watts J, Box GA, et al : Magnetic resonance imaging of intramedullary spinal cord lesions : a pictorial review. Journal of medical imaging and radiation oncology 2014 ; 58(5) : 569-581. Epub 2014/07/06.
- Curt A, Ellaway PH : La neurophysiologie clinique dans le pronostic et le suivi des lésions traumatiques du rachis. Handbook of clinical neurology 2012 ; 109 : 63-75. Epub 2012/10/27.
- Landmann G, Berger MF, et al : Usefulness of laser-evoked potentials and quantitative sensory testing in the diagnosis of neuropathic spinal cord injury pain : a multiple case study. Spinal cord 2017 ; 55(6) : 575-582. Epub 2017/01/25.
- Rolke R, Magerl W, et al : Quantitative sensory testing : a comprehensive protocol for clinical trials. European journal of pain 2006 ; 10(1) : 77-88. Epub 2005/11/18.
- Zeilig G, Enosh S et al : The nature and course of sensory changes following spinal cord injury : predictive properties and implications on the mechanism of central pain. Brain : a journal of neurology 2012 ; 135(Pt 2) : 418-430. Epub 2011/11/19.
- Finnerup NB, Norrbrink C, et al : Phénotypes et prédicteurs de la douleur suite à une lésion traumatique de la colonne vertébrale : une étude prospective. The journal of pain : official journal of the American Pain Society 2014 ; 15(1) : 40-48. Epub 2013/11/26.
- Engel GL : The need for a new medical model : a challenge for biomedicine. Science 1977 ; 196(4286) : 129-136. Epub 1977/04/08.
- Keefe FJ, Rumble ME, et al : Psychological aspects of persistent pain : current state of the science. The journal of pain : official journal of the American Pain Society 2004 ; 5(4) : 195-211. Epub 2004/05/27.
- Jensen MP, Moore MR, et al : Psychosocial factors and adjustment to chronic pain in persons with physical disabilities : a systematic review. Arch Phys Med Rehabil 2011 ; 92(1) : 146-160.
- Craig A, Tran Y, Middleton J : Morbidité psychologique et traumatisme spinal : une revue systématique. Cordon spinal 2009 ; 47(2) : 108-114. Epub 2008/09/10.
- Mehta S, Guy SD, Bryce TN, et al : The CanPain SCI Clinical Practice Guidelines for Rehabilitation Management of Neuropathic Pain after Spinal Cord : screening and diagnosis recommendations. Cordon rachidien 2016 ; 54 Suppl 1(1) : S7-S13. Epub 2016/07/23.
- Finnerup NB, Jensen MP, et al : A prospective study of pain and psychological functioning following traumatic spinal cord injury. Cordon spinal 2016 ; 54(10) : 816-821. Epub 2016/03/02.
- Loh E, Guy SD, et al : The CanPain SCI Clinical Practice Guidelines for Rehabilitation Management of Neuropathic Pain after Spinal Cord : introduction, methodology and recommendation overview. Cordon rachidien 2016 ; 54 Suppl 1(1) : S1-6. Epub 2016/07/23.
- Bundesärztekammer (BÄK) KBK, Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF) : Ligne directrice nationale de soins pour les douleurs lombaires non spécifiques – version longue. www.versorgungsleitlinien.de, www.awmf.org
- Guy SD, Mehta S, Casalino A, et al : The CanPain SCI Clinical Practice Guidelines for Rehabilitation Management of Neuropathic Pain after Spinal Cord : Recommendations for treatment. Cordon rachidien 2016 ; 54 Suppl 1(1) : S14-23. Epub 2016/07/23.
- Butler AC, Chapman JE, et al. : The empirical status of cognitive-behavioral therapy : a review of meta-analyses. Clinical psychology review. 2006 ; 26(1) : 17-31. Epub 2005/10/04.
- Ostelo RW, van Tulder MW, et al : Behavioural treatment for chronic low-back pain. The Cochrane database of systematic reviews 2005 ; 25(1) : CD002014. Epub 2005/01/28.
- Mehta S, Orenczuk S, et al : An evidence-based review of the effectiveness of cognitive behavioral therapy for psychosocial issues post-spinal cord injury. Rehabilitation psychology 2011 ; 56(1) : 15-25. Epub 2011/03/16.
- Muller R, Gertz KJ, et al : Effects of a Tailored Positive Psychology Intervention on Well-Being and Pain in Individuals With Chronic Pain and a Physical Disability : A Feasibility Trial. The Clinical journal of pain 2016 ; 32(1) : 32-44. Epub 2015/02/28.
- Jensen MP, Barber J, et al : The effect of hypnotic suggestion on spinal cord injury pain. Journal of Back and Musculoskeletal Rehabilitation 2000 ; 14(1,2) : 3-10.
- Kabat-Zinn J : Interventions basées sur la pleine conscience dans le contexte : passé, présent et futur. Clinical Psychology : Science and Practice 2003 ; 10(2) : 144-156.
- Flor H, Fydrich T, Turk DC : Efficacité des centres multidisciplinaires de traitement de la douleur : une revue méta-analytique. Douleur 1992 ; 49(2) : 221-230. Epub 1992/05/01.
- Morley S, Eccleston C, Williams A : Systematic review and meta-analysis of randomized controlled trials of cognitive behaviour therapy and behaviour therapy for chronic pain in adults, excluding headache. Douleur 1999 ; 80(1-2) : 1-13.
- Norrbrink C, Lindberg T, et al : Effets d’un programme d’exercice sur les douleurs musculo-squelettiques et neuropathiques après une blessure du cordon spinal-résultats d’une étude sur ergomètre à double polarité en position assise. Spinal cord 2012 ; 50(6) : 457-461. Epub 2012/02/01.
- Heutink M, Post MW, et al : The CONECSI trial : results of a randomized controlled trial of a multidisciplinary cognitive behavioral program for coping with chronic neuropathic pain after spinal cord injury. Pain 2012 ; 153(1) : 120-128. Epub 2011/11/22.
- Perry KN, Nicholas MK, Middleton JW : Comparaison d’un programme de gestion de la douleur avec les soins habituels dans un centre de gestion de la douleur pour les personnes souffrant de douleurs chroniques liées à une lésion de la moelle épinière. The Clinical journal of pain 2010 ; 26(3) : 206-216. Epub 2010/02/23.
- Burns AS, Delparte JJ, et al : Evaluation of an interdisciplinary program for chronic pain after spinal cord injury. PM & R : the journal of injury, function, and rehabilitation 2013 ; 5(10) : 832-838. Epub 2013/05/21.
- Reck T, Dumat W, Krebs J, Lyutow A : [Outpatient multimodal pain therapy : Results of a 1-week intensive outpatient multimodal group program for patients with chronic unspecific back pain – retrospective evaluation after 3 and 12 months]. Douleur 2017 ; 31(5) : 508-515. Epub 2017/03/05. Traitement multimodal ambulatoire de la douleur : résultats d’un programme de groupe multimodal intensif ambulatoire d’une semaine pour les patients souffrant de lombalgies chroniques non spécifiques – évaluation rétrospective à 3 et 12 mois.
- Finnerup NB, Attal N, et al : Pharmacotherapy for neuropathic pain in adults : a systematic review and meta-analysis. Lancet Neurol 2015 ; 14(2) : 162-173. Epub 2015/01/13.
InFo NEUROLOGIE & PSYCHIATRIE 2018 ; 16(3) : 16-24