Le carcinome hépatocellulaire (CHC) est la tumeur hépatocellulaire primaire la plus fréquente et représente un défi pour le traitement systémique en raison de sa résistance intrinsèque aux agents chimiothérapeutiques classiques. Le clinicien responsable ne doit pas seulement évaluer la situation tumorale avec un effet thérapeutique possible – il faut aussi évaluer soigneusement les avantages du traitement et le risque de décompensation hépatique.
Le carcinome hépatocellulaire (CHC) est la tumeur hépatocellulaire primaire la plus fréquente et représente un défi pour le traitement systémique en raison de sa résistance intrinsèque aux agents chimiothérapeutiques classiques [1]. Outre les possibilités thérapeutiques limitées en nombre jusqu’à présent dans le traitement systémique, c’est principalement la maladie hépatique avancée qui détermine le pronostic. Les facteurs de risque connus de cirrhose du foie, tels que les hépatites virales VHB ou VHC, et l’alcool ne sont pas les seuls à jouer un rôle. Parfois, la stéatose hépatique, qui est en augmentation dans notre région, ainsi que la stéatose hépatique non alcoolique (NAFLD) ne sont pas seulement un facteur de risque du CHC. Au contraire, la réduction des performances du foie qui en résulte est également un facteur pronostique dans le traitement du CHC [2]. Le clinicien responsable ne doit donc pas seulement évaluer la situation tumorale avec un effet thérapeutique possible – il faut aussi évaluer soigneusement les avantages du traitement et le risque de décompensation hépatique. Les traitements curatifs sont réservés aux stades précoces du CHC selon la classification de la Barcelona Clinic Liver Cancer (BCLC) pour BCLC 0/A et comprennent la chirurgie, les techniques d’ablation locale ou la transplantation hépatique. Le risque de récidive après chirurgie ou ablation dans un foie déjà endommagé est assez élevé, de 65 à 85% selon les études, et c’est précisément dans cette situation que différentes options de traitement sont actuellement étudiées dans des essais cliniques contrôlés [3]. Pour les patients en CHC “intermédiaire” ou “avancé”, le traitement est palliatif. La radio-embolisation trans-artérielle (TARE) est une application souvent utilisée pour le stade BCLC-B. Elle permet de réduire le risque d’infection par le VIH. Dans ce cas également, le risque de récidive ou d’apparition de foyers de CHC de novo est élevé dans le foie déjà endommagé. Ainsi, ce champ thérapeutique avec une bonne fonction hépatique préservée est également un champ d’intérêt actuel des traitements systémiques adjuvants. Après un choix longtemps très limité d’options systémiques pour le CHC dans le BCLC-C avec les inhibiteurs de multikinases (MKI) sorafénib en première ligne [4] et régorafénib en deuxième ligne [5], les traitements pour le CHC se sont élargis au cours des 3,5 dernières années avec des thérapies combinées d’anticorps vasculaires plus des inhibiteurs de points de contrôle immunitaire (ICI) ([6,7]. De plus, dans le domaine du CHC “avancé” (aHCC), il y a actuellement un vif intérêt pour des études sur d’autres combinaisons, parfois MKI plus ICI. Ces résultats sont attendus avec impatience, car non seulement de telles combinaisons sont étudiées en première ligne de traitement, mais certaines combinaisons thérapeutiques sont également utilisées après une immunothérapie préalable. Dès la fin 2021, l’étude COSMIC-312, présentée lors du symposium virtuel ESMO Asia, a démontré une combinaison de cabozantinib et d’atezolizumab dans le traitement de première ligne du CHCa. Début 2022, une étude positive portant sur une combinaison d’ICI avait été présentée lors du symposium virtuel ASCO GI, l’étude HIMALAYA. J’aimerais présenter ces données ainsi que les perspectives d’études ultérieures sur les thérapies combinées dans un aperçu simplifié.
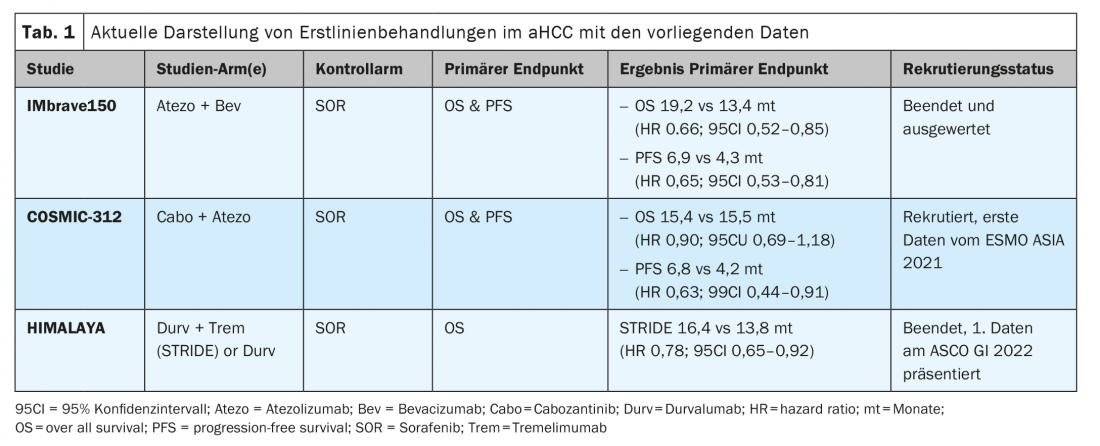
Thérapies combinées dans le CHCa
Etude IMbrave 150 – autres résultats à long terme de l’ASCO 2021 : Avec l’étude IMbrave 150, un nouveau standard thérapeutique mondial a été atteint à partir de 2019 dans le traitement de première ligne du CHCa au stade BCLC C, ainsi qu’avec l’application précoce au stade BCLC B. L’étude IMbrave 150 a été lancée en 2009. [7] Moins d’un an plus tard, le 16 novembre 2020, SwissMedic a également autorisé cette combinaison en première ligne d’atezolizumab plus bevacizumab en Suisse. Cette combinaison a permis d’obtenir une amélioration significative de la mOS et de la mPFS par rapport au sorafenib. Lors du virtuel ASCO GI 2021, les données actuelles ont été présentées avec des intervalles d’évolution plus longs [8]. Les avantages de survie significatifs déjà connus pour le mOS (19,2 vs 13,4 mois ; HR 0,66 ; p=0,0009) et la mPFS (6,9 vs 4,3 mois ; HR 0,65 ; p=0,0001) ont été confirmés sur la période d’observation prolongée de plus de 18 mois. La réduction du risque de décès de 34% et un avantage de survie globale de 5,8 mois par rapport au sorafénib ont également été obtenus avec une amélioration et une stabilisation de la qualité de vie [6,9].
Étude COSMIC-312 – conclusions de l’ESMO Asia 2021 : d’autres combinaisons intéressantes consistent en des inhibiteurs de multikinases (MKI) et des inhibiteurs de points de contrôle (ICI). Le sorafénib, le cabozantinib ou le lenvatinib en combinaison avec des inhibiteurs de PD-1 sont actuellement en cours d’évaluation dans les bras d’étude du CHCa. L’étude COSMIC-312 (NCT03755791) a été conçue en trois bras pour le traitement de première ligne du CHCa. Il est intéressant de noter que les stades BCLC-B peuvent déjà être inclus. Contre le bras standard sorafenib, un bras d’étude en cabozantinib monothérapie (Cabo) et un autre bras d’étude en combinaison cabozantinib plus atezolizumab (Cabo-Atezo) sont comparés pour le double critère mOS et PFS. Les premiers résultats de l’étude mondiale, portant sur 837 patients randomisés, ont été présentés à ESMO Asia 2021 [10]. Dans le groupe Cabo Atezo, le critère de la PFS a été atteint par rapport au sorafénib, mais il n’y a pas eu de différence dans la survie globale dans les deux bras à courbe de courbe identique (tableau 1). Les données de PFS du Cabo Mono étaient également significativement supérieures à celles du Sorafenib, mais les données d’OS n’ont pas encore été démontrées. Il est intéressant de noter que ce sont surtout les CHC associés à l’hépatite B (VHB) qui bénéficient de l’association Cabo-Atezo, avec une PFS HR de 0,49 (IC à 95% : 0,29-0,73). Ce sous-groupe VHB a obtenu un bénéfice sur l’OS avec un HR de 0,53 (IC à 95% : 0,33-0,87). L’atteinte extra-hépatique (EHD) et l’invasion macrovasculaire (MVI) ont également indiqué un bénéfice en termes de PFS pour le traitement combiné cabo-attéro (HR 0,57 ; IC à 95% 0,41-0,78) dans l’analyse des sous-groupes. En revanche, les CHC non associés à un virus et les CHC associés à l’hépatite C (VHC) ne semblent pas bénéficier de l’association. Les Asiatiques, en particulier, ont davantage bénéficié de la combinaison que les patients non asiatiques atteints de CHC, de sorte qu’il n’est pas clair si l’infection par le VHB ou l’ethnie constitue un facteur de confusion (confounder) dans l’analyse. Les auteurs ont prudemment conclu que cette combinaison constituait une nouvelle option dans le traitement du CHC. Toutefois, il convient d’attendre les analyses finales.
ORIENT-32 – Données de l’ESMO 2021 : Lors de l’ESMO 2021, les résultats de l’étude ORIENT-32, une autre combinaison de sintilimab (Sin) et de bevacizumab (Bev) contre sorafenib, ont été démontrés [11]. Dans la population purement chinoise, la combinaison Sin + Bev a montré des avantages significatifs en termes de traitement en termes d’OS (NR vs 10,4 mois) et de mPFS (4,6 vs 2,8 mois). Les taux d’effets secondaires de l’IMbrave et de l’ORIENT-32 étaient inférieurs à ceux du sorafénib et correspondaient au profil d’effets secondaires typique de l’aVGFR et de l’OI.
Étude HIMALAYA – Combinaison d’inhibiteurs de points de contrôle immunitaires en première ligne du CHCa : les thérapies combinées ICI sont également plus étudiées dans le CHCa. Ainsi, la FDA a déjà approuvé en 2019 la combinaison nivolumab plus tremelimumab (Trem) dans le CHCa après un traitement préalable au sorafenib. Une autre combinaison ICI approuvée par la FDA depuis janvier 2021 est devaruzumab plus tremelimumab. Les deux combinaisons sont utilisables dans le traitement de deuxième ligne, mais ne sont pas soutenues par l’EMA ou Swissmedic. Or, l’étude HIMALAYA (NCT03298451) a récemment été présentée à l’ASCO GI 2022 avec ses premières données. L’étude, qui comporte désormais trois bras, a comparé le bras STRIDE (tremelimumab plus durvalumab) ou Durvalumab mono (Durv) au sorafénib comme bras standard. Le critère d’évaluation primaire de l’OS était significativement supérieur dans le bras STRIDE avec 16,4 mois contre 13,8 mois dans le bras sorafénib, également très bon (HR 0,78 ; p=0,0035). Il n’y avait pas de différence dans la PFS, mais une DoR (duration of response) médiane impressionnante de 22,34 mois, soit une population de 65,8% de patients avec une réponse Trem+Durv à 12 mois. Ces résultats sont très intéressants pour la combinaison d’inhibiteurs de points de contrôle et, dans les analyses de sous-groupes effectuées jusqu’à présent, presque chaque groupe individuel était en faveur de l’utilisation de cette combinaison. La grande discussion sur la population appropriée par rapport au nouveau SoC (standard of care) atezolizumab plus bevacizumab est donnée et n’est pas facile à répondre. De mon point de vue, il manque des biomarqueurs clairs pour la sélection ou l’attribution à l’une des deux combinaisons.
Études en cours de recrutement et à venir
CheckMate 9DW : cette étude de phase 3 NCT04039607 compare l’association nivolumab (Nivo) plus ipilimumab (Ipi) au sorafénib en première ligne chez 728 aHCC prévus aux stades BCLC-B et BCLC-C. L’étude a montré que l’association nivolumab plus ipilimumab (Ipi) était plus efficace que le sorafénib en première ligne. Le critère d’évaluation principal est l’OS et l’étude est actuellement ouverte, mais ne recrute pas actuellement en raison de la pandémie COVID-19 (au 28 janvier 2022 clinicaltrials.gov).
LEAP-002 : Cette étude de phase 3 (NCT03713593) compare le SoC lenvatinib à l’association lenvatinib plus pembrolizumab. L’issue primaire est la comparaison de la PFS et de l’OS des deux groupes. Cette étude est également active, mais aucun recrutement n’a lieu actuellement (au 28 décembre 2021 clinicaltrials.gov).
Études de recrutement en situation adjuvante
Non seulement le champ des aHCC fait actuellement l’objet d’études intensives pour un effet des immunothérapies, mais les stades locaux après chirurgie ou ablation sont également étudiés. Le groupe de contrôle est constitué d’un traitement placebo. Le pembrolizumab est étudié en monothérapie dans l’étude Keynote 937 (NCT03867084), le toripalimab dans l’étude JUPITER 04 (NCT03859128) ou le nivolumab dans l’étude CheckMate 9Dx (NCT03383458) en tant que traitement adjuvant. L’étude EMERALD-2 (NCT03847428) se concentre sur le durvalumab ou la combinaison durvalumab plus bevacizumab dans la configuration adjuvante. L’étude ImBrave050 (NCT04102098) évalue également l’association atezolizumab plus bevacizumab chez des patients atteints de CHC à haut risque par rapport à un placebo après une chirurgie ou une ablation. Ces résultats sont globalement attendus avec impatience, car les résultats positifs des études font passer l’utilisation de l’ICI en première ligne. Ainsi, à l’avenir, non seulement l’extension de l’ICI avec différentes combinaisons dans le CHCa donnera lieu à une discussion intensive sur le placement dans les directives, mais aussi sur la séquence en cas de récidive après chirurgie ou ablation, si l’ICI a été utilisé à cette occasion.
Perspectives et “besoins non satisfaits
Les études présentées sont très attendues dans les stades BCLC-B localement et localement avancés du CHC et, si les critères d’évaluation sont atteints, elles établiront un nouveau standard thérapeutique. De même, dans l’aHCC avec des stades BCLC-B ou C, de nombreuses perspectives d’études avec des signaux positifs sont actuellement attendues. Nous pouvons donc espérer une grande variété de nouvelles combinaisons thérapeutiques dans un avenir proche. Outre ces perspectives positives, des questions directes et indirectes se posent avec des exigences actuellement (encore) non résolues. Il s’agit d’une part de la séquence de traitement optimale d’un patient atteint de CHC et d’autre part de la question des différents traitements en fonction de l’hépatopathie sous-jacente. En revanche, la question des biomarqueurs appropriés pour le pronostic et la prédiction n’est pas encore résolue de manière satisfaisante et fait également l’objet de questions de recherche actuelles. L’analyse de la résistance instrinsèque ou acquise à une thérapie ICI (immune checkpoint inhibition) joue ici un rôle central. Pour l’application clinique, la sécurité et l’efficacité des thérapies chez les patients CHILD-Pugh-B ainsi qu’en post-transplantation jouent également un rôle, car cela n’a pas été inclus dans les études précédentes. De ces questions ouvertes découle la nécessité de développer et de définir des scores cliniques et diagnostiques afin de sélectionner les patients optimaux pour la meilleure thérapie combinée possible.
Messages Take-Home
- Le champ d’application du traitement du BCLC au stade C du CHC s’est considérablement élargi, avec notamment une combinaison d’atezolizumab et de bevacizumab actuellement autorisée en Suisse.
- La fonction hépatique et un bon score de Child-Pugh sont essentiels pour l’utilisation des thérapies systémiques dans le CHC.
- Les patients atteints de CHC doivent être évalués rapidement par un hépatologue et un oncologue médical, de sorte que l’évaluation de la fonction hépatique s’ajoute à l’évaluation du traitement systémique.
- Le champ de traitement du CHC s’élargit également aux stades précoces du BCLC. Dans la mesure du possible, les patients doivent être inclus dans des études.
Littérature :
- Fulgenzi CAM, et al ; Immunothérapie dans le carcinome hépatocellulaire. Curr Treat Options Oncol 2021, 22(10) : 87.
- Galati G, et al : Current Treatment Options for HCC : From Pharmacokinetics to Efficacy and Adverse Events in Liver Cirrhosis. Curr Drug Metab 2020, 21(11) : 866-884.
- Llovet JM, et al : Locoregional therapies in the era of molecular and immune treatments for hepatocellular carcinoma. Nat Rev Gastroenterol Hepatol 2021, 18(5) : 293-313.
- Llovet JM, et al : Sorafenib in advanced hepatocellular carcinoma. N Engl J Med 2008, 359(4) : 378-390.
- Bruix J, et al : Regorafenib for patients with hepatocellular carcinoma who progressed on sorafenib treatment (RESORCE) : a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 2017, 389(10064) : 56-66.
- Casak SJ, et al : Résumé de l’approbation de la FDA : Atezolizumab Plus Bevacizumab pour le traitement des patients atteints de carcinome hépatocellulaire avancé non résécable ou métastatique. Clin Cancer Res 2021. 27(7) : 1836-1841.
- Finn RS, et al : Atezolizumab plus Bevacizumab in Unresectable Hepatocellular Carcinoma. N Engl J Med 2020, 382(20) : 1894-1905.
- Finn R, QS, Ikeda M, et al : IMbrave150 : mise à jour des données de survie globale issues d’une étude globale, randomisée, en ouvert et en phase III de l’atezolizumab + bevacizumab vs sorafenib chez des patients atteints d’un carcinome hépatocellulaire non résécable. Journal of Clinical Oncology 39, no. 3_suppl (January 20, 2021) 267-267, 2021.
- Gordan JD, et al : Systemic Therapy for Advanced Hepatocellular Carcinoma : ASCO Guideline. J Clin Oncol 2020, 38(36) : 4317-4345.
- Kelley RK, et al : VP10-2021 : Cabozantinib (C) plus atezolizumab (A) versus sorafenib (S) comme traitement systémique de première ligne pour le carcinome hépatocellulaire avancé (aHCC) : Résultats de l’essai randomisé de phase III COSMIC-312. Annals of Oncology 2021. ESMO VIRTUAL PLENARY ABSTRACT VOLUME 33, ISSUE 1, P114-116.
- Ren Z, et al : Sintilimab plus un biosimilaire du bevacizumab (IBI305) versus sorafenib dans le carcinome hépatocellulaire non résécable (ORIENT-32) : une étude randomisée, en ouvert, phase 2-3. Lancet Oncol 2021, 22(7) : 977-990.
InFo ONKOLOGIE & HÉMATOLOGIE 2022 ; 10(2) : 6-8











