La sclérose en plaques est la maladie neurologique la plus fréquente chez les jeunes adultes. Elle peut entraîner un handicap permanent dès le plus jeune âge, mais l’activité de la maladie au début semble avoir une incidence sur son évolution ultérieure. Il est donc important de commencer un traitement efficace le plus tôt possible. Des études cliniques récemment achevées et des résultats de recherche récents et prometteurs laissent entrevoir une augmentation des options thérapeutiques dans les mois et années à venir.
La sclérose en plaques (SEP) est la maladie auto-immune la plus fréquente du système nerveux central (SNC), dont les bases physiopathologiques ne sont toujours pas élucidées en détail. Sur la base des nouveaux critères de McDonald 2010, le diagnostic de SEP est souvent posé dès le premier épisode clinique [1]. La plupart du temps, la maladie évolue par poussées (“relapsing remitting multiple sclerosis”, RRMS).
Au cours de l’évolution, de nombreux patients présentent une progression secondaire chronique des symptômes, indépendante des poussées (“secondary progressive MS”, SPMS) ; après dix ans, c’est le cas pour environ 30 à 40% des patients [2]. Une progression chronique primaire (“primary progressive MS”, PPMS) est présente chez 10-20% des patients, cette évolution pouvant également comporter des poussées superposées [3].
Le stade initial de la SEPR correspond souvent formellement à un syndrome cliniquement isolé (“clinically isolated syndrome”, CIS). Chez les patients atteints d’ECI, les critères de McDonald de 2010 pour le diagnostic de la SEPR ne sont pas remplis, mais la présence d’une SEP doit souvent être considérée comme probable [4].
Les processus qui se déroulent dans la phase précoce des maladies semblent avoir une influence significative sur l’évolution ultérieure de la maladie, de sorte qu’il est important de commencer le traitement le plus tôt possible. La transition formelle d’un CIS vers une SEP cliniquement confirmée peut être retardée et l’évolution ultérieure influencée positivement par l’utilisation précoce d’un traitement de fond [5, 6].
Plus récemment, des progrès ont été réalisés dans le traitement de l’ECI et du SMRR. Outre les substances orales (telles que l’acide fumarique, le laquinimod, le tériflunomide), des traitements par anticorps (tels que l’alemtuzumab, le daclizumab, l’ocrelizumab) font l’objet d’études de phase II ou III ou certaines de ces études sont déjà terminées.
L’acide fumarique, le tériflunomide et l’alemtuzumab sont déjà autorisés dans certains pays, de sorte que l’on peut s’attendre à un élargissement des options thérapeutiques en Suisse dans un proche avenir. (Tab. 1 et Fig. 1).
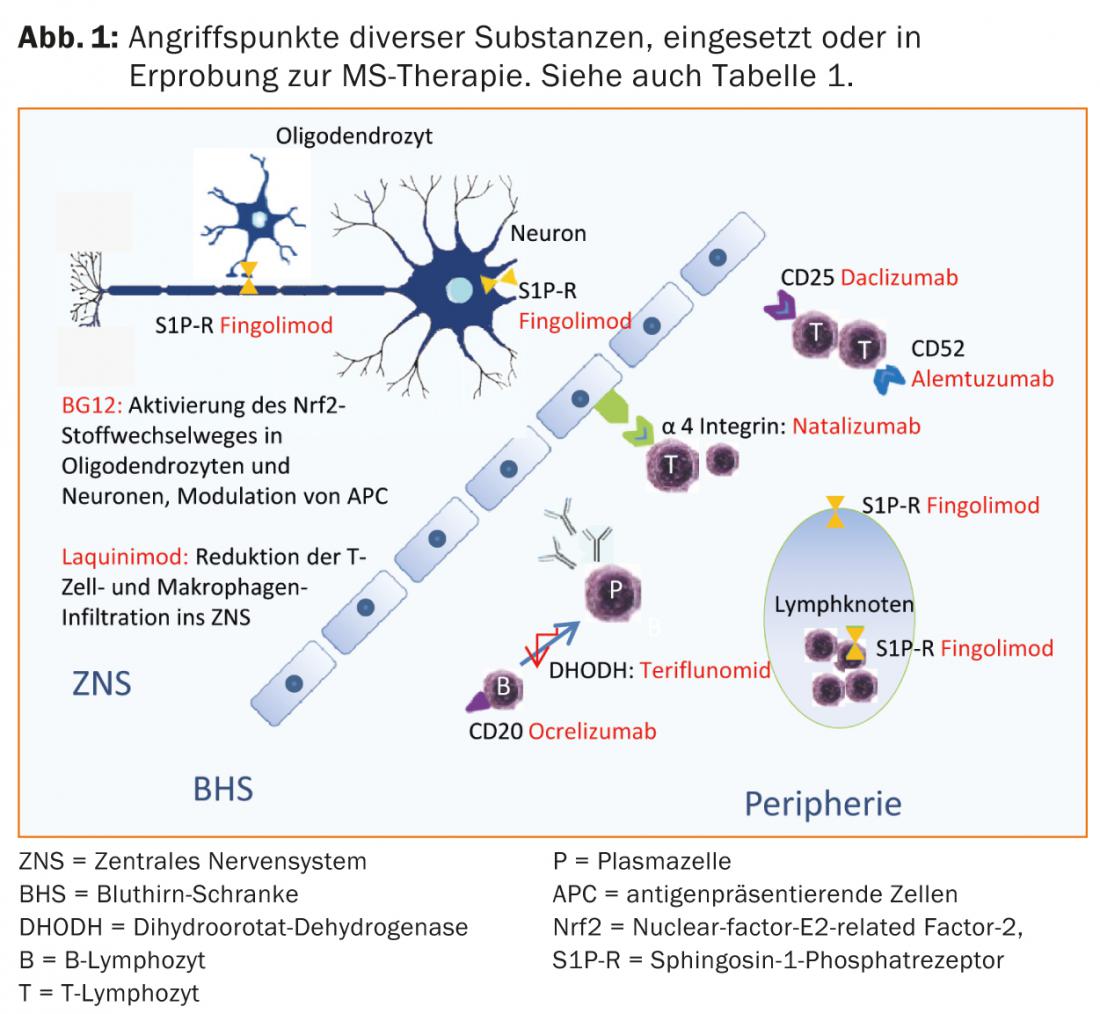
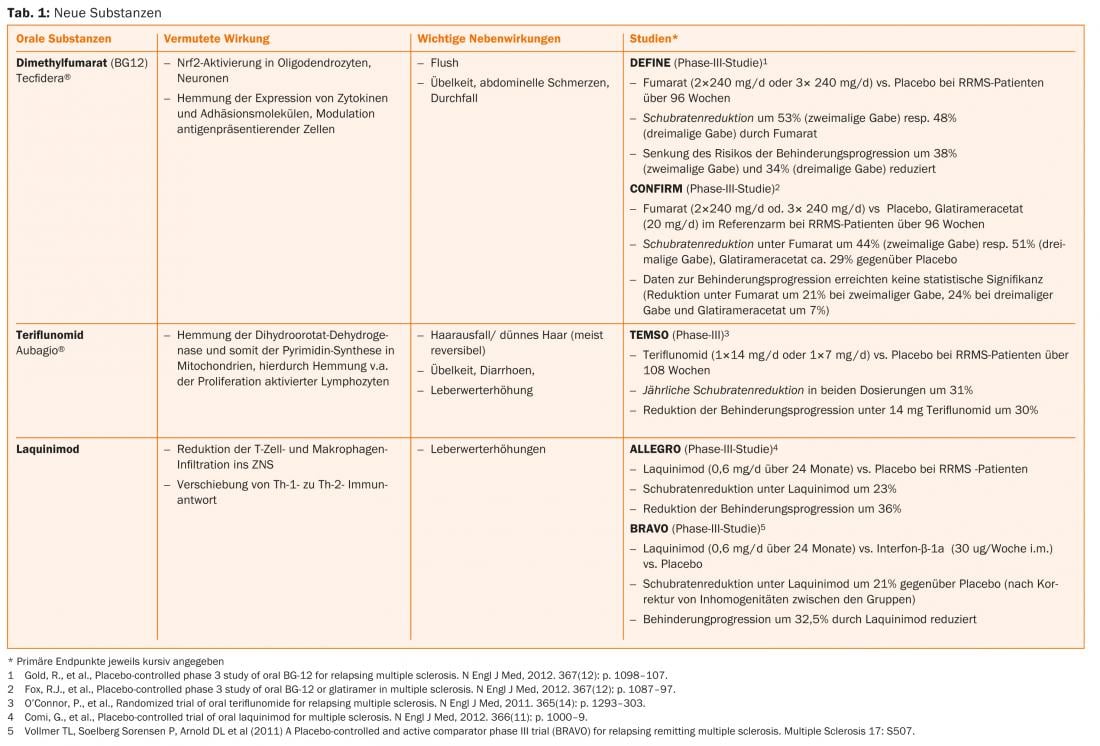
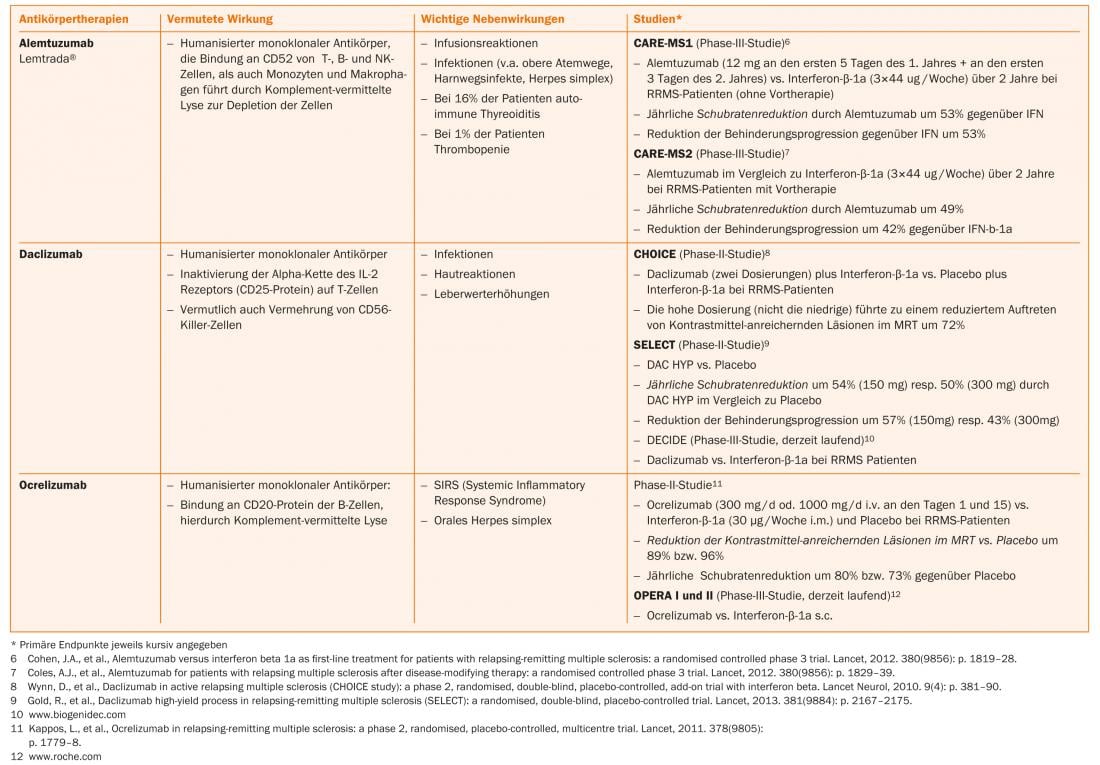
Options thérapeutiques actuelles
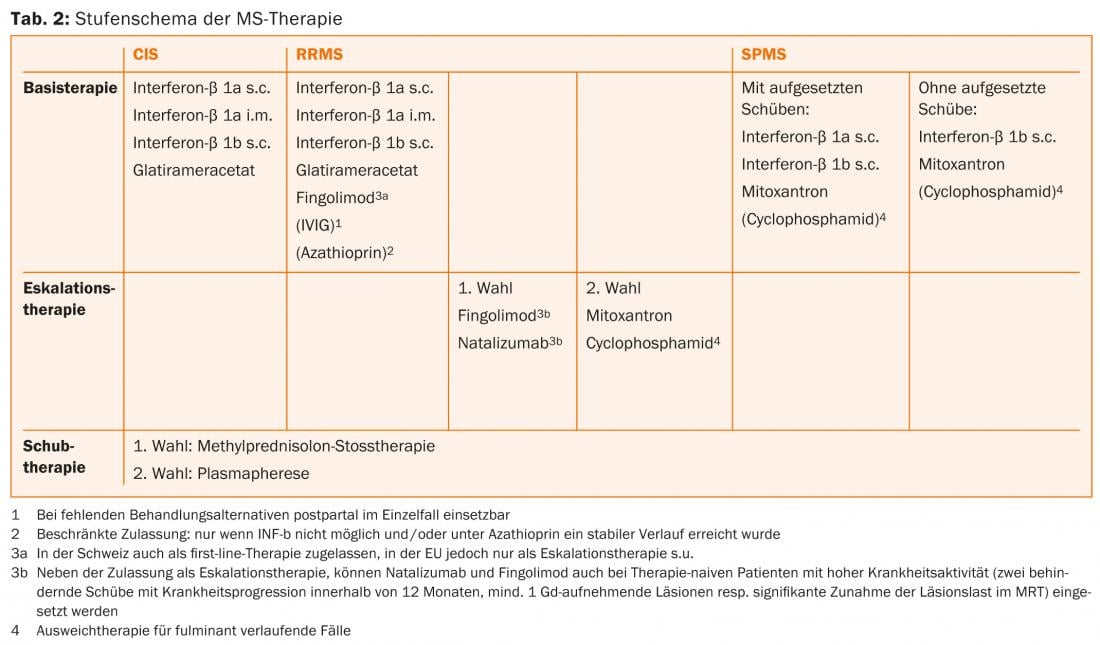
Pour le traitement des patients atteints de CIS et de RRMS, les interférons bêta (interféron-bêta 1b s.c. [Betaferon®], interféron-bêta 1a s.c. et i.m. [Rebif® et Avonex®] et l’acétate de glatiramère s.c. [Copaxone®] sont autorisés [7, 8]. Ces substances, généralement injectées par le patient lui-même, bénéficient d’une longue et vaste expérience et se distinguent notamment par un profil de sécurité favorable [9]. En 2011, le fingolimod a également été approuvé en Suisse comme traitement de première ligne pour la SEPR [10]. Des examens d’imagerie par résonance magnétique (IRM) doivent être effectués initialement et régulièrement au cours du traitement afin de déterminer la situation initiale et d’assurer le suivi ultérieur du traitement.
Les interférons (IFN) utilisés sont produits par recombinaison. Les IFN endogènes font partie intégrante du système immunitaire et sont importants pour la réponse immunitaire aux infections virales. Le mécanisme d’action exact des préparations à base d’IFN-β dans le traitement de l’ECI/RRMS n’est pas encore totalement élucidé. Des effets secondaires de type grippal sont fréquents, surtout au cours des premiers mois de traitement, et peuvent être atténués par la prise d’un anti-inflammatoire non stéroïdien ou de paracétamol [11]. Des effets secondaires locaux tels que douleur, rougeur de la peau, lipoatrophie et induration peuvent survenir au niveau des sites d’injection [12, 13]. Comme alternative aux interférons bêta, on peut utiliser le copolymère d’acétate de glatiramère, comparable en termes d’efficacité, un mélange hétérogène de polypeptides synthétiques composé de quatre acides aminés, dont le mécanisme d’action n’est pas non plus totalement compris [14]. Les effets secondaires de type grippal ne sont pas pertinents avec ce médicament, mais des réactions post-injection avec une symptomatologie de flush et des indurations locales ou des lipoatrophies au niveau des sites d’injection peuvent survenir [15].
En Suisse, le fingolimod (comprimé) est également autorisé comme traitement de fond de première ligne de la SEPR. Le fingolimod est le premier traitement modificateur de la SEP disponible par voie orale, généralement bien toléré, qui s’est avéré supérieur à l’interféron bêta 1a i.m., la substance de référence, dans l’une des études pivots [17]. Le fingolimod est un antagoniste non sélectif de haute affinité qui se lie aux récepteurs de la sphingosine-1-phosphate (S1P-R) sur les lymphocytes, empêchant ainsi leur migration hors des organes lymphatiques secondaires. La redistribution des lymphocytes résulte en une lymphopénie, la métabolisation dans le foie peut conduire à des valeurs hépatiques élevées. En raison de l’expression des récepteurs S1P au niveau du système de conduction cardiaque, des effets secondaires tels que des bradycardies ou une perturbation de la conduction auriculo-ventriculaire peuvent survenir, en particulier lors de la première prise. C’est pourquoi il est nécessaire de contrôler la pression artérielle, le pouls et l’ECG lors de la première administration ainsi qu’après les pauses thérapeutiques. Une complication rare peut être un œdème maculaire [16]. En raison des effets sur le système immunitaire, les patients dont le type de peau les prédispose aux tumeurs malignes devraient être régulièrement examinés par un dermatologue [17, 18]. En outre, ce sont surtout les infections virales qui sont favorisées. Chez les patients qui n’ont pas eu la varicelle, les titres d’anticorps anti-varicelle-zona doivent être déterminés avant le début du traitement. Les patients séronégatifs doivent être vaccinés.
De nouvelles substances telles que l’alemtuzumab (perfusion, uniquement pour les patients dont l’activité de la maladie est en cours), le diméthylfumarate (comprimé) et le tériflunomide (comprimé) sont déjà autorisées dans certains pays pour le traitement du SMRR et font l’objet d’une demande d’autorisation en Suisse.
Thérapie d’escalade
L’escalade thérapeutique d’un traitement de première ligne vers le fingolimod (lui-même en première ligne en Suisse, pas dans l’UE) [16, 19] ou le natalizumab [20] peut être envisagée si ≥1 poussée est survenue sous un traitement de fond au cours de l’année précédente et si l’IRM montre ≥9 lésions hyperintenses en T2 ou ≥1 lésion aiguë, donc prenant le contraste. Les IFN sont mentionnés dans les indications comme traitement de base correspondant. Cependant, selon la pratique courante, une escalade peut être évaluée de la même manière chez les patients traités par acétate de glatiramère ou, en cas d’escalade vers le natalizumab, par fingolimod. Le traitement primaire par natalizumab ou (dans l’UE, sans restriction en Suisse) fingolimod n’est indiqué que pour les patients qui ont déjà présenté ≥2 poussées avec progression du handicap au cours de l’année écoulée et chez lesquels ≥1 lésion prenant le contraste ou une augmentation “significative” de la charge lésionnelle T2 sont détectables à l’IRM cérébrale.
Le natalizumab est un anticorps monoclonal humanisé dirigé contre l’intégrine α4, une molécule d’adhésion cellulaire dont les lymphocytes ont besoin pour pénétrer dans le SNC. Dans l’étude pivot, le natalizumab a réduit le taux de poussées de 68% par rapport au placebo et a également montré un bon effet sur la progression du handicap ainsi que sur les signes d’activité de la maladie à l’imagerie par résonance magnétique [20]. Le natalizumab est administré par perfusion tous les 28 jours et est généralement bien toléré. L’utilisation de ce médicament très efficace est limitée par le risque de leucoencéphalopathie multifocale progressive (LEMP). Cette infection opportuniste provoquée par le virus JC entraîne souvent de graves handicaps, une issue fatale est possible. Il n’existe pas de traitement ciblé pour la LEMP. En cas de LEMP, le natalizumab est donc arrêté et lavé par une plasmaphérèse afin de rétablir l’immunocompétence le plus rapidement possible. Un peu plus de la moitié des patients atteints de SEP et de la population saine correspondante sont porteurs du virus JC. Alors que les patients séronégatifs JC présentent un faible risque de LEMP (environ 1/10 000) [21], le risque peut augmenter jusqu’à environ 1/89 pour la troisième et la quatrième année chez les patients séropositifs si un traitement immunosuppresseur a été administré dans le passé. En fonction du risque individuel, il est donc nécessaire de conseiller soigneusement les patients sur les avantages et les risques [22]. En cas de passage du fingolimod au natalizumab, il convient de respecter une période de lessivage d’environ deux mois, et d’attendre au moins la normalisation du nombre de lymphocytes [23]. En tant que médicaments de réserve et de deuxième choix, la mitoxantrone, le cyclophosphamide ou l’azathioprine [23] peuvent être utilisés dans le traitement d’escalade après un examen minutieux (tableau 2). D’autres thérapies off-label peuvent être envisagées.
Enfin, il convient de noter que les combinaisons de ces médicaments ne sont pas autorisées.
Désir d’enfant, grossesse, allaitement
La SEP touche souvent les jeunes femmes. La question du traitement en cas de désir d’enfant, de grossesse et d’allaitement est donc pertinente. L’utilisation d’agents chimiothérapeutiques ou immunosuppresseurs tératogènes tels que l’azathioprine, le cyclophosphamide et la mitoxantrone est contre-indiquée. Pour le fingolimod également, il convient, dans la mesure du possible, de respecter une phase de lavage avant d’arrêter une contraception. L’acétate de glatiramère a été le mieux évalué par la Food and Drug Agency (FDA) des États-Unis en ce qui concerne les risques liés à l’exposition pendant la grossesse, car ce médicament n’a pas été tératogène dans les études animales et les données antérieures chez l’homme sont également favorables [24]. De même, aucune tératogénicité n’a été observée chez l’homme à ce jour pour les interférons et le natalizumab.
Bien que ces données ne proviennent pas d’études contrôlées, il convient d’envisager, en tenant compte de l’étiquette correspondante, de n’interrompre le traitement par l’un de ces médicaments qu’en cas de survenue d’une grossesse. Pendant la grossesse, où l’activité des poussées est généralement faible, le traitement n’est effectué que dans de rares cas exceptionnels. En général, on ne traite pas non plus pendant l’allaitement, d’autant plus que de nombreuses personnes atteintes de SEP n’allaitent pas afin de pouvoir reprendre le traitement après l’accouchement, qui est souvent suivi d’une forte activité de la maladie.
Utilisation de traitements de fond dans les formes progressives
Il n’existe actuellement aucune option de traitement efficace ayant un effet clair sur la forme progressive de l’évolution. Outre un traitement individuel, multimodal et symptomatique, les mesures de physiothérapie et de rééducation sont au premier plan. En cas de SPMS, l’option d’utiliser l’IFN-β-1b et, en cas de poussées imposées, l’IFN-β-1a s.c. [25] s’impose.
Si l’évolution est particulièrement agressive, l’administration de mitoxantrone doit être discutée [26]. Auparavant, il convient d’évaluer soigneusement le rapport bénéfice/risque, notamment en raison du risque accru de leucémie [27] et de cardiomyopathie, ainsi que de l’effet toxique sur la fonction gonadique. La durée du traitement est limitée par la dose totale cumulée pouvant être administrée (en Suisse, 100 mg/m2 de surface corporelle au maximum). Cette limite peut éventuellement être dépassée sous réserve d’un contrôle attentif de la fonction cardiaque.
Conclusion
Le traitement précoce de l’ECI/RRMS est important pour l’évolution de la maladie. Pour cela, il existe un nombre croissant de médicaments qui se distinguent par leur efficacité, leur sécurité, leur profil d’effets secondaires et leur confort thérapeutique. Le choix de plus en plus large de médicaments contre la SEP offre la possibilité d’un traitement plus personnalisé, adapté au profil spécifique du patient.
Helen Könnecke
PD Dr. med. Michael Linnebank
Littérature :
- Polman CH, et al : Ann Neurol 2011 ; 69(2) : 292-302.
- Weinshenker BG, et al : Brain 1989 ; 112(Pt1) : 133-146.
- Weinshenker BG : Semin Neurol 1998 ; 18(3) : 301-307.
- Miller DH, et al. : Mult Scler 2008 ; 14(9) : 1157-1174.
- Weinshenker BG, et al. : Brain 1989 ; 112(Pt 6) : 1419-1428.
- Hirst C, et al : J Neurol 2008 ; 255(2) : 280-287.
- Buttmann M, Rieckmann P : Expert Rev Neurother 2007 ; 7(3) : 227-239.
- Comi G, et al : Ann Neurol 2011 ; 69(1) : 75-82.
- Reder AT, et al : Neurology 2010 ; 74(23) : 1877-1885.
- www.swissmedic.ch.
- Hartung HP, et al : Nervenarzt 2013 ; 84(6) : 679-704.
- Nikfar S, Rahimi R, Abdollahi M : Clin Ther 2010 ; 32(11) : 1871-1888.
- Plosker GL : CNS Drugs 2011 ; 25(1) : 67-88.
- O’Connor P, et al : Lancet Neurol 2009 ; 8(10) : 889-897.
- Ford C, et al. : Mult Scler 2010 ; 16(3) : 342-350.
- Cohen JA, et al. : NEJM 2010 ; 362(5) : 402-415.
- Comi G, et al : Mult Scler 2010 ; 16(2) : 197-207.
- Kappos L, et al. : NEJM 2006 ; 355(11) : 1124-1140.
- Kappos L, et al. : NEJM 2010 ; 362(5) : 387-401.
- Polman CH, et al. : NEJM 2006 ; 354(9) : 899-910.
- Bloomgren G, et al. : NEJM 2012 ; 366(20) : 1870-1880.
- www.biogenidec.ch.
- Lignes directrices de la DGN sur le diagnostic et le traitement de la SEP. Diener HC, Weimar C (éd.) : Lignes directrices de la Société allemande de neurologie Thieme Verlag : Stuttgart 2012, 430-475.
- Salminen HJ, Leggett H, Boggild M : J Neurol 2010 ; 257(12) : 2020-2023.
- Kappos L, et al : Neurology 2004 ; 63(10) : 1779-1787.
- Hartung HP, et al : Lancet 2002 ; 360(9350) : 2018-2025.
- Martinelli V, et al : Neurology 2011 ; 77(21) : 1887-1895.
InFo Neurologie & Psychiatrie 2013 ; 11(6) : 13-20











