Le diabète est associé à une augmentation de la morbidité et de la mortalité cardiovasculaires. La réduction du cholestérol LDL stratifiée en fonction du risque est un élément important du traitement du diabète et peut améliorer le pronostic clinique. Pour atteindre les valeurs cibles définies par l’ESC, un traitement par étapes s’est avéré efficace. Les statines continuent d’occuper une place importante dans la gestion des lipides. En outre, outre l’ézétimibe, il existe aujourd’hui des inhibiteurs de PCSK9 et de l’acide bempédoïque.
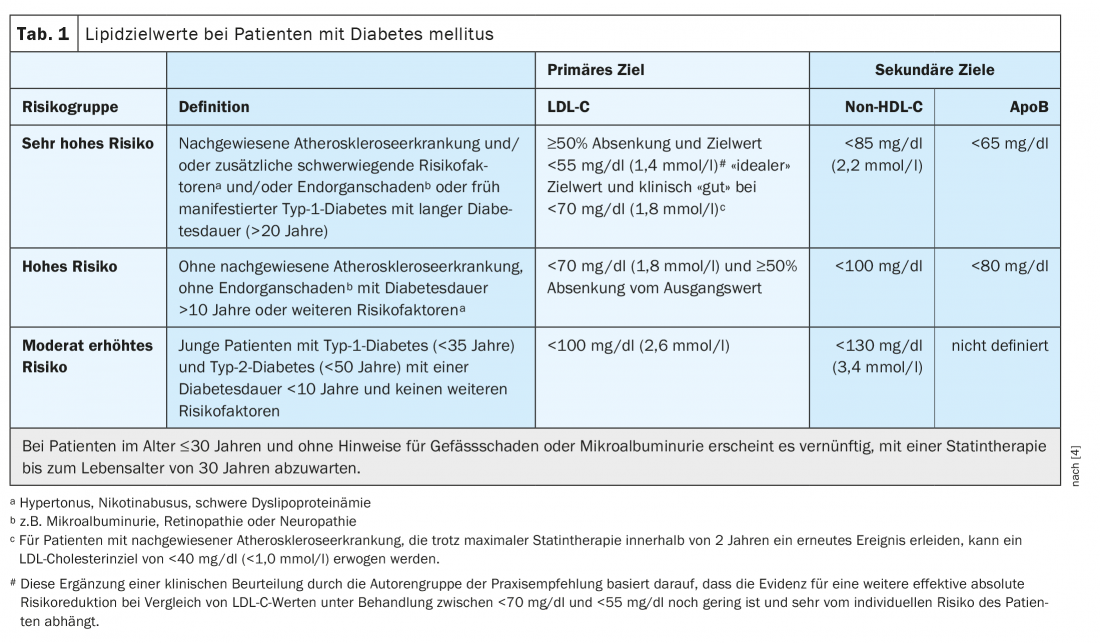
Les patients atteints de diabète sucré présentent souvent un risque cardiovasculaire accru. Une réduction des lipides adaptée au risque, basée sur l’ESC-SCORE* (“systematic coronary risk estimation”), constitue une contre-mesure importante [1,2]. Chez les patients présentant un risque cardiovasculaire très élevé, on vise un taux de cholestérol LDL (LDL-C) <55 mg/dl ou <1,4 mmol/l et une réduction de ≥50 pour cent, explique le professeur Dirk Müller-Wieland, de l’hôpital universitaire RWTH d’Aix-la-Chapelle (D) (tableau 1) [3,4]. L’objectif premier est de réduire le cholestérol LDL, mais les valeurs du cholestérol non-HDL (cholestérol total moins cholestérol HDL) sont également pertinentes, comme le souligne le conférencier, ancien président de l’Association allemande du diabète. La différence entre le cholestérol non-HDL et le cholestérol LDL ne doit pas dépasser 30 mg/dl (tableau 1) [3,4]. Sur le plan physiopathologique, l’activité du récepteur LDL dans le foie est un facteur central et la clé de la réduction thérapeutique des lipoprotéines athérogènes et du risque cardiovasculaire [5]. Les caractéristiques de la dyslipidémie diabétique hautement athérogène sont l’hypertriglycéridémie, l’augmentation des particules rémanentes, les petites LDL denses (“small dense” -LDL) et le faible taux de HDL-cholestérol. Le manque d’insuline ou la résistance à l’insuline entraînent une désinhibition de la lipolyse et donc une augmentation des acides gras libres qui, en fonction de leur concentration, passent dans le foie et sont incorporés dans les lipoprotéines riches en triglycérides (VLDL) sous l’effet de l’insuline [5]. “Plus vous activez le récepteur LDL – et un indicateur est bien sûr la réduction du cholestérol LDL – plus vous réduisez également la proportion de cholestérol athérogène dans ces lipoprotéines riches en triglycérides”, a expliqué le professeur Müller-Wieland. Cela est associé à un risque cardiovasculaire nettement plus faible, comme le montrent différentes études, ajoute le conférencier. Les recommandations pratiques de la DDG sur le traitement des lipides dans le diabète sucré, ainsi que les lignes directrices d’autres sociétés savantes internationales, en tiennent compte [3 .4].
* L’ESC-SCORE est disponible sous forme d’outil en ligne et de tableau de score et indique le risque absolu sur 10 ans d’un événement athérosclérotique fatal (y compris la mort subite d’origine cardiaque) en pourcentage. [1,2]
Les statines restent une option de première ligne
“La base du traitement des lipides est et reste actuellement le traitement par statine”, a déclaré le Dr Julia Brandts, de l’hôpital universitaire RWTH d’Aix-la-Chapelle [6]. Il existe des données robustes montrant que les statines entraînent une réduction significative du risque par rapport au placebo, tant en prévention secondaire qu’en prévention primaire. Pour chaque réduction de 1 mmol/l de cholestérol LDL, une réduction relative du risque cardiovasculaire d’environ 20% peut être obtenue, a déclaré l’oratrice. Cela est valable quel que soit le risque initial du patient et quel que soit le produit utilisé pour obtenir cette réduction du cholestérol. Pour les patients atteints de diabète sucré qui présentent un risque cardiovasculaire élevé ou très élevé, on souhaite une réduction du LDL-C d’au moins 50 pour cent, raison pour laquelle on utilise notamment l’atorvastatine (40 mg) ou la rosuvastatine (20 mg) pour le traitement par statine.
Ezétimibe, acide bempédoïque et PCSK9-i pour l’escalade thérapeutique
Si le traitement par statine seul ne permet pas d’atteindre les valeurs cibles individuelles, l’ajout d’ézétimibe constitue la prochaine étape, explique le Dr Brandts [6]. L’ézétimibe réduit l’absorption du cholestérol dans l’intestin grêle en se liant spécifiquement à NPC1L1 (protéine C-1 like 1 de Niemann-Pick). L’étude IMPROVE-IT a montré que l’ézétimibe (10 mg/j) ajouté à la simvastatine (40 mg/j) chez des patients randomisés pour recevoir cette combinaison dans les 10 jours suivant l’apparition d’un syndrome coronarien aigu réduisait davantage le taux d’événements cardiovasculaires qu’une monothérapie par statine, sans augmenter le taux d’événements indésirables [7,8]. Une autre option thérapeutique hypolipémiante est l’acide bempédoïque, qui, comme les statines, inhibe la biosynthèse du cholestérol, mais n’agit que dans le foie, ce qui explique que les myopathies soient plus rares [4]. La diminution de la biosynthèse du cholestérol entraîne une réduction du cholestérol dans les cellules hépatiques, ce qui, par un mécanisme de rétroaction, entraîne l’expression d’un plus grand nombre de récepteurs LDL afin d’éliminer le cholestérol LDL de la circulation. Dans l’étude internationale multicentrique CLEAR-Outcomes en cours, les critères d’évaluation cardiovasculaires sont suivis sur une période de 5 ans chez les patients à haut risque [13]. On attend avec impatience les résultats.
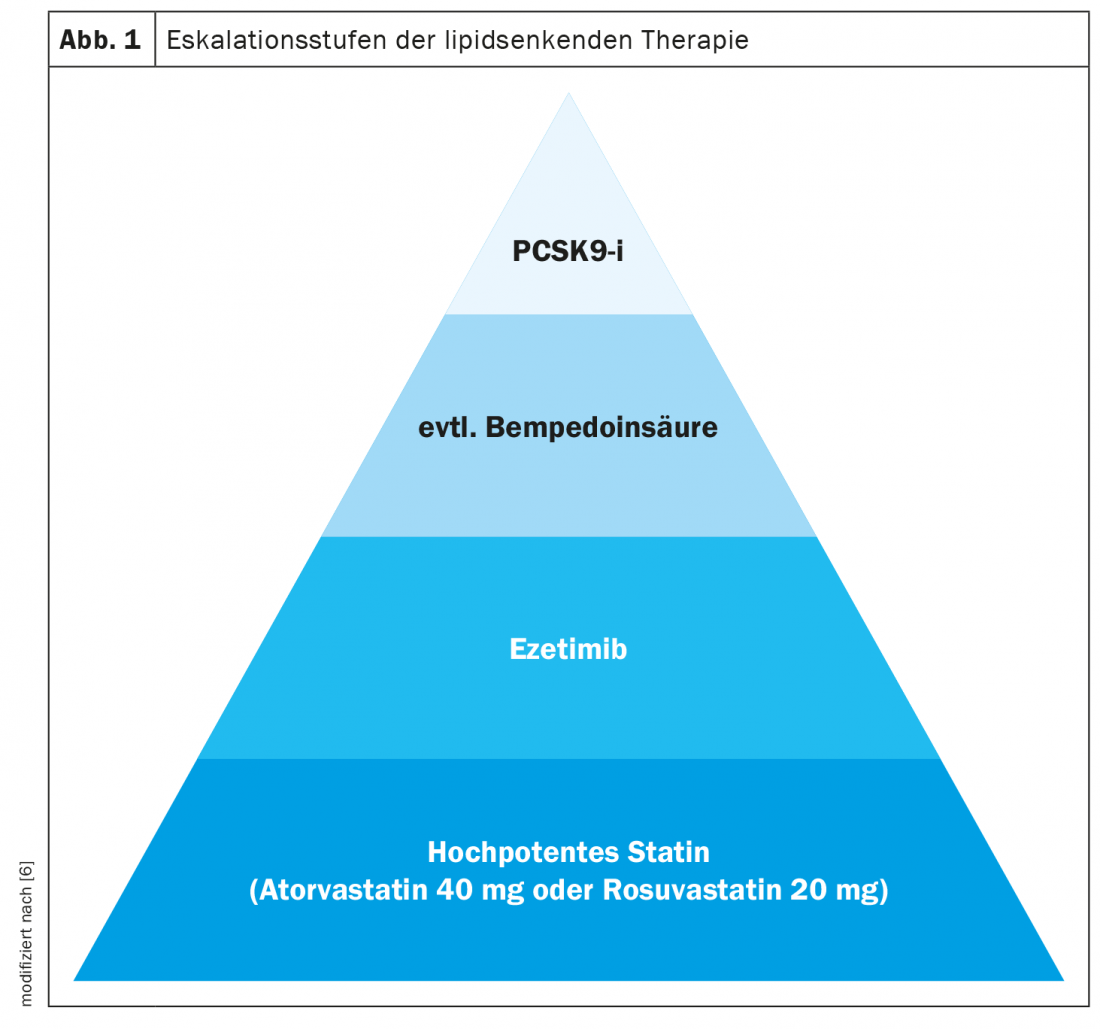
Chez les patients à haut risque qui n’atteignent pas les valeurs cibles malgré l’ajout d’ézétimibe et/ou d’acide bempédoïque, un inhibiteur de PCSK9, par exemple l’alirocumab, l’évolocumab ou le traitement par siRNA inclisiran, peut être utilisé comme étape d’escalade supplémentaire. L’alirocumab et l’évolocumab sont des anticorps monoclonaux injectés par voie sous-cutanée qui se lient sélectivement à la sérine protéase PCSK9 (proprotein convertase subtilisin-kexin type 9). L’Inclisiran – un “petit acide ribonucléique interférant” (siRNA) – bloque la néosynthèse de PCSK9, une sérine protéase qui se lie aux récepteurs LDL-C à la surface des cellules hépatiques et favorise leur dégradation dans les lysosomes des hépatocytes. Si l’on bloque la néosynthèse de PCSK9 ou sa fonction, le nombre de récepteurs LDL à la surface des hépatocytes augmente. Ils fixent ainsi davantage de LDL-C circulant dans les cellules hépatiques et le taux de LDL-C dans le sang diminue [9].
Pour l’évolocumab, l’étude FOURIER a permis d’obtenir une réduction relative du risque de 20% sur une période de 36 mois. Dans l’essai ODYSSEE-Outome, le traitement par alirocumab a permis de réduire le risque de 15% par rapport au placebo, explique le Dr Brandts [6,10,11]. Inclisiran a réduit de manière significative le taux de cholestérol LDL chez des patients atteints d’hypercholestérolémie familiale ou de maladies cardiovasculaires athéroscléreuses dans le programme d’étude randomisé ORION [12].
Perspectives : d’autres options thérapeutiques prometteuses
“Dans la suite du développement clinique des inhibiteurs de PCSK9, il y a encore les oligonucléotides antisens, appelés ‘ASOS'”, a déclaré le Dr Brandts [6]. Il s’agit de molécules simple brin qui, grâce à leur structure complémentaire à celle de l’ARNm, se lient à celui-ci et le fragmentent. Selon elle, ce qui est particulièrement intéressant pour les oligonucléotides antisens, c’est qu’une application sous-cutanée une fois par mois permet d’obtenir une réduction de plus de 60% du LDL-C sur une période de 80 jours [6]. En outre, une forme d’application orale d’un inhibiteur de PCSK9 a également été testée pour la première fois. Administré quotidiennement, il aurait permis d’obtenir une réduction de 50% du LDL-C à partir du septième jour. De petites molécules, les adnectines, sont toujours en cours de développement clinique, rapporte le Dr Brandts. Ceux-ci se lient également au PCSK9 circulant dans les cellules et agissent donc de la même manière que les anticorps monoclonaux. “Là encore, les premières études de phase II montrent qu’une réduction maximale a été obtenue avec une dose de 300 mg appliquée pendant quatre semaines, avec une réduction allant jusqu’à 76% du cholestérol LDL”, a-t-elle déclaré [6].
Congrès : Diabétologie sans frontières
Littérature :
- EAPC : HeartScore, www.heartscore.org, (dernière consultation 05.05.2022)
- ESC : SCORE : European High Risk Chart, www.escardio.org/static_file/Escardio/Subspecialty/EACPR/Documents (dernière consultation 05.05.2022)
- “Dyslipidémies chez les personnes atteintes de diabète”, Prof. Dr med. Müller-Wieland, Diabetologie sans frontières, 4.2-5.2.2022.
- Parhofer KG, et al. : Lipidtherapie bei Patienten mit Diabetes mellitus. www.deutsche-diabetes-gesellschaft.de (dernière consultation 05.05.2022)
- Müller-Wieland et al. : Principes physiopathologiques des dyslipoprotéinémies. Dtsch Med Wochenschrift 2021 ; 146 : e103-e112. DOI 10.1055/a-1516-2441
- “Die Stufentherapie der Hypercholesterinämie – Therapeutische Neuentwicklungen”, Dr. med. Julia Brandts, Diabetologie grenzenlos, 4.2-5.2.2022.
- Giugliano RP, et al. (IMPROVE-IT) : Circulation 2018 (10) ; 137(15) : 1571-1582.
- DGK : Intensifier la réduction des lipides avec une statine plus l’ézétimibe : qui en bénéficie particulièrement, 29.07.2019, www.kardiologie.org, (dernière consultation 05.05.2022)
- Lyko C, et al : Inhibiteurs de PCSK9. Swiss Medical Forum 2017 ; 17 (45) : 979-986.
- Sabatine MS, et al. (FOURIER) : Evolocumab and Clinical Outcomes in Patients with Cardiovascular Disease. N Engl J Med 2017 ; 376(18) : 1713-1722.
- Schwartz GG, et al. (ODYSSEY) : Alirocumab and Cardiovascular Outcomes after Acute Coronary Syndrome. NEJM 2018 ; 379(22) : 2097-2107.
- Ray KK, et al : Deux essais de phase 3 d’Inclisiran chez des patients présentant une élévation du cholestérol LDL. N Engl J Med 2020 ; 382(16) : 1507-1519.
- Ray KK, et al ; CLEAR Harmony Trial. Sécurité et efficacité de l’acide bempédoïque pour réduire le cholestérol LDL. N Engl J Med 2019 ; 380(11) : 1022-1032.
PRATIQUE DU MÉDECIN DE FAMILLE 2022 ; 17(5) : 38-39
CARDIOVASC 2022 ; 21(2) : 24-25