Les troubles respiratoires liés au sommeil sont fréquents. Le syndrome d’apnées obstructives du sommeil (SAOS) est une maladie très répandue. La prévalence de l’apnée obstructive du sommeil ne cesse d’augmenter dans les pays occidentaux industrialisés en raison de la fréquence croissante de l’obésité, du vieillissement et de la généralisation des méthodes de diagnostic. 40% de la population souffre d’apnée obstructive du sommeil avec un indice d’apnée et d’hypopnée (IAH) >5, l’IAH décrivant l’occurrence d’événements respiratoires par heure de sommeil.
Les troubles respiratoires liés au sommeil sont fréquents. Le syndrome d’apnées obstructives du sommeil (SAOS) est une maladie très répandue. La prévalence de l’apnée obstructive du sommeil ne cesse d’augmenter dans les pays occidentaux industrialisés en raison de la fréquence croissante de l’obésité, du vieillissement et de la généralisation des méthodes de diagnostic. 40% de la population allemande souffre d’apnée obstructive du sommeil avec un indice d’apnée et d’hypopnée (IAH) >5, l’IAH décrivant l’occurrence d’événements respiratoires par heure de sommeil.
La maladie est plus fréquente chez les hommes et les personnes âgées de plus de 60 ans. Le syndrome du SAOS, qui associe un SAOS et une somnolence diurne, est estimé à une prévalence de 5 % de la population allemande (aucune enquête récente n’est disponible en Suisse à l’heure actuelle) [1]. Les troubles respiratoires du sommeil non traités entraînent des maladies cardiovasculaires secondaires, une fatigue diurne prononcée ou une somnolence diurne et, par conséquent, un risque accru d’accident. La fonction cognitive de la personne concernée peut également être affectée.
Les troubles respiratoires du sommeil sont divisés en quatre grands groupes selon l’ICSD-3 : le SA obstructif, le SA central, l’hypoxémie liée au sommeil, l’hypoventilation liée au sommeil [2]. Le SAOS se caractérise par un collapsus répétitif des voies respiratoires supérieures. En raison de la baisse du tonus musculaire, elle se produit plus fréquemment pendant le sommeil profond et le sommeil paradoxal. Si un collapsus des voies respiratoires supérieures se produit sous la forme d’une apnée, la personne concernée tente de lutter contre cette apnée en augmentant ses efforts respiratoires. Cet effort accru entraîne une réaction de réveil du système nerveux central, appelée éveil. Si la personne concernée parvient à rouvrir les voies respiratoires, elle produit alors un bruit de ronflement fort et irrégulier. L’apnée centrale du sommeil résulte d’un trouble de la régulation centrale de la respiration. L’hypoxémie et l’hypoventilation liées au sommeil résultent d’une diminution persistante de l’activité respiratoire. Ils ont tous en commun une perturbation de l’architecture normale du sommeil, c’est-à-dire que le sommeil est constamment interrompu par des réactions de réveil, la proportion de sommeil profond et de sommeil paradoxal diminue, ce qui entraîne un sommeil non réparateur avec la fatigue ou la somnolence qui en résulte.
Symptômes et diagnostic
Les pauses respiratoires, le ronflement et la fatigue diurne sont cités comme des symptômes fréquents des troubles respiratoires du sommeil, et il est particulièrement nécessaire de disposer d’informations sur l’anamnèse des autres, car il n’est pas rare que les patients concernés ne signalent aucun trouble subjectif. La fragmentation de l’architecture du sommeil entraîne des plaintes d’insomnie. En cas d’apnée prononcée, un réveil avec essoufflement est décrit. Des questionnaires peuvent être utilisés pour évaluer la somnolence diurne résultant du SBAS (troubles respiratoires du sommeil). L’échelle Epworth Sleepiness Scale est souvent utilisée à cet effet. Dans ce cadre, les patients sont interrogés sur la probabilité de s’endormir dans huit situations typiques de la vie quotidienne. Les résultats individuels sont additionnés pour obtenir un total compris entre zéro et 24. Une valeur supérieure à 10 est considérée comme pathologique. L’examen clinique doit inclure une inspection des voies respiratoires supérieures. La cavité nasale, le nasopharynx, la cavité buccale ainsi que le pharynx profond et le larynx doivent être examinés. L’obstruction anatomique de la cavité buccale, en particulier l’hypertrophie des amygdales palatines et de la base de la langue, joue un rôle particulier dans l’apparition d’un trouble respiratoire du sommeil de type SAOS.
De même, la position de la mâchoire supérieure par rapport à la mâchoire inférieure et l’état des dents doivent être évalués. Les appareils de diagnostic disponibles sont la polygraphie cardio-respiratoire et la polysomnographie. Comme diagnostic de base, la polygraphie est d’abord réalisée en ambulatoire, c’est-à-dire que le patient peut dormir chez lui avec le système de diagnostic dans son environnement habituel. L’appareil PG est un appareil de mesure portable qui mesure ou enregistre le débit respiratoire nasal, les excursions respiratoires de la poitrine et de l’abdomen, la fréquence cardiaque, les ronflements, la saturation en oxygène et la position du patient. Les données sont enregistrées en continu pendant au moins 6 heures et sont ensuite traitées ou synchronisées avec un logiciel, ce qui permet au médecin traitant de procéder à une évaluation individuelle de l’ensemble de la nuit. Si un diagnostic de trouble respiratoire du sommeil n’est pas possible dans le cadre d’une polygraphie cardiorespiratoire ambulatoire, le patient concerné doit être adressé à un laboratoire du sommeil pour un diagnostic plus approfondi, dans ce cas une polysomnographie.
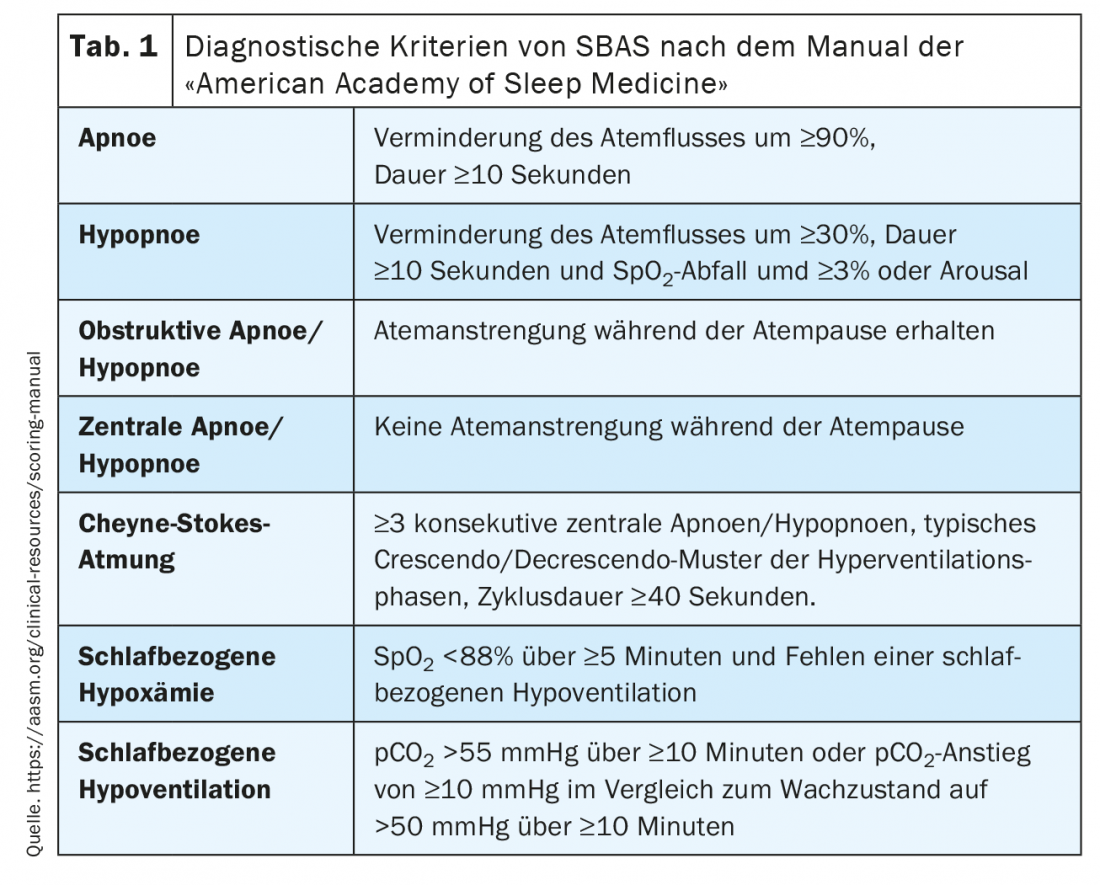
Les critères diagnostiques du SBAS dans le cadre du PG/PSG sont définis selon le manuel de l’American Academy of Sleep Medicine [3] et sont résumés dans le tableau 1 .
Apnée obstructive du sommeil
Le SAOS résulte d’une obstruction des voies aériennes supérieures au niveau du (oro)-pharynx postérieur pendant le sommeil. La cause peut être, outre un webbing prononcé du palais mou avec des voûtes palatines basses et éventuellement une luette élargie et allongée, l’hypertrophie des amygdales palatines ou une hypertrophie de la base de la langue. De même, des malformations de la mâchoire ou des facteurs non anatomiques tels qu’une faiblesse du muscle génioglosse, qui a une fonction d’élargissement sur la section pharyngée des voies aériennes supérieures, sont également présents. Le plus souvent, le rétrécissement des voies respiratoires est lié à l’obésité, qui entraîne une augmentation de l’accumulation de graisse dans les parois latérales du pharynx. L’obésité est le principal facteur de risque du SAOS, avec l’âge croissant et le sexe masculin. En conséquence, les patients souffrant d’un syndrome métabolique sont particulièrement touchés par le SAOS [4]. Le SAOS est la cause la plus fréquente d’hypertension artérielle secondaire et influence le métabolisme diabétique en augmentant la résistance à l’insuline. Le lien entre l’hyperlipidémie et le SAOS n’a pas encore été définitivement établi. Globalement, le risque cardiovasculaire est plus élevé chez les patients atteints du SAOS non traités [5].
Ce sont précisément les patients souffrant d’un SAOS sévère qui développent une hypertension artérielle avec non-dipping (absence de baisse de la pression artérielle pendant la nuit). Même les patients qui ne présentent qu’une obstruction des voies aériennes supérieures pendant le sommeil paradoxal en raison de la relaxation musculaire qui s’y produit, présentent la symptomatologie d’une hypertension artérielle (6). Il existe une association étroite entre le SAOS non traité et les troubles du rythme cardiaque, en particulier la fibrillation auriculaire [7], les maladies cardiaques telles que la maladie coronarienne et l’infarctus du myocarde [8], ainsi que la survenue d’un accident vasculaire cérébral [9]. Si le SAOS entraîne une somnolence diurne excessive, on peut également supposer un risque cardiovasculaire accru [10]. La fatigue diurne, voire la somnolence diurne excessive, qui peut survenir dans le cadre du SAOS rend les patients concernés particulièrement vulnérables aux accidents, en particulier lorsqu’ils exercent des professions impliquant des activités de contrôle et de surveillance. Il n’y a pas d’obligation de déclaration médicale, mais la personne concernée doit impérativement être informée de cette situation, l’information fournie doit être consignée par écrit et contresignée par le patient.
La réalisation d’une polygraphie cardiorespiratoire permet de déterminer la sévérité du SAOS. Pour ce faire, l’indice d’apnée-hypopnée (IAH) de la personne concernée est déterminé. L’IAH comprend le nombre d’apnées et d’hypopnées par heure de sommeil. Les résultats légers correspondent à un IAH de 5-15, les résultats moyens à un IAH de 15-30/h et les résultats graves à un IAH supérieur à 30/h.
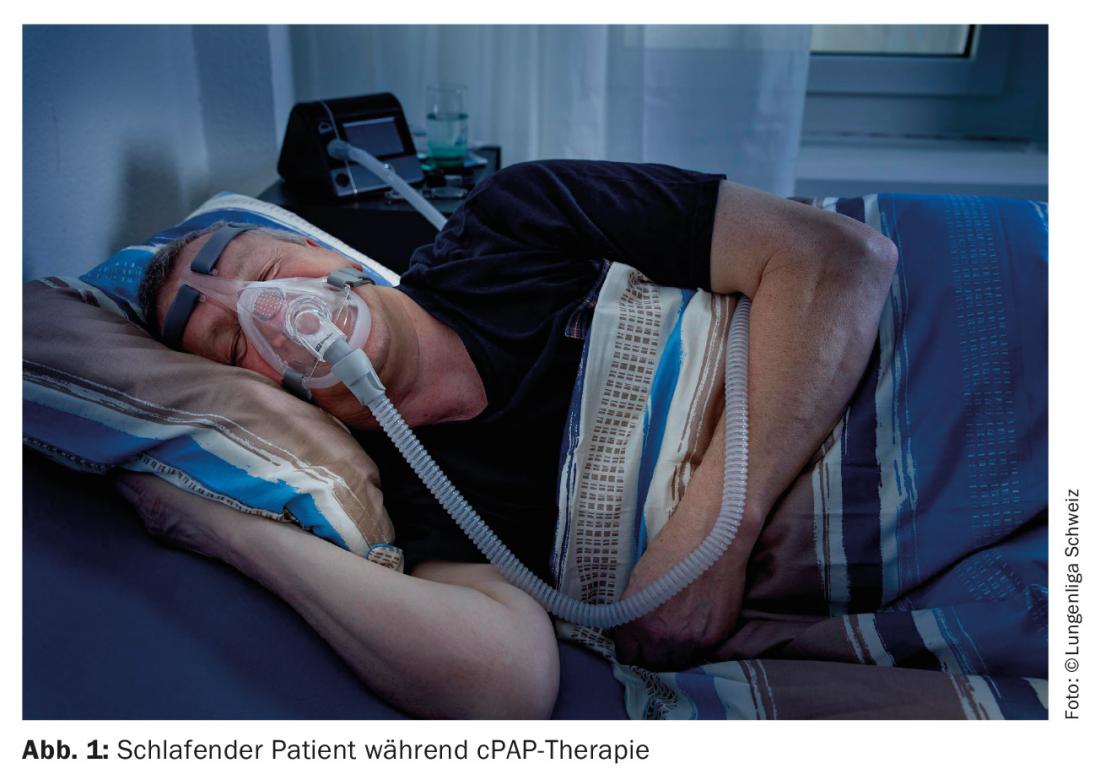
Traitement par PPC : l’étalon-or du traitement du SAOS est une contention pneumatique continue des voies aériennes supérieures par pression positive appliquée au moyen d’un masque nasal/buccal (Fig. 1). Le traitement le plus courant est la PPC (pression positive continue des voies aériennes). La contention pneumatique supprime l’obstruction des voies aériennes supérieures et donc, idéalement, toutes les apnées et hypopnées, et donc l’hypoxie nocturne. La suppression de l’éveil lié à l’hypoxie améliore l’architecture du sommeil et donc la récupération du sommeil, ce qui entraîne une réduction de la fatigue diurne concomitante. L’effet secondaire est l’élimination considérable du ronflement, ce qui élimine l’aspect souvent signalé comme socialement gênant par le partenaire de lit, ce qui améliore l’observance du traitement par PPC. En améliorant la fonction endothéliale [10] et en réduisant la pression artérielle [11], les facteurs de risque cardiovasculaire [12] sont minimisés. La thérapie nocturne par pression positive entraîne des effets secondaires indésirables chez un nombre non négligeable de patients.
On se plaint souvent d’une sécheresse matinale des muqueuses des voies respiratoires supérieures. Les humidificateurs d’air chaud, qui sont aujourd’hui intégrés dans la plupart des appareils de PPC et peuvent être réglés individuellement par le patient, peuvent aider à résoudre ce problème. Une obstruction nasale sous traitement est tout aussi fréquemment décrite, ce qui conduit assez souvent à un arrêt nocturne du traitement. L’ajustement du masque doit être contrôlé et, si nécessaire, changé pour un autre modèle. Parfois, il peut être utile de réduire légèrement la surpression positive du traitement, notamment pour soulager les voies respiratoires nasales. La réduction de la pression thérapeutique doit faire l’objet d’un contrôle polygraphique au cours de l’évolution, au moins sur le plan cardio-respiratoire, et ne doit pas compromettre de manière significative la suffisance du traitement.
Les patients concernés ont souvent recours de manière autonome à des congestifs nasaux, tels que des gouttes nasales ou des sprays contenant de la xylométazoline, afin d’éviter le gonflement du nez dû à l’augmentation de l’irrigation sanguine dans la partie inférieure du nez. Il est bien connu qu’il se produit une accoutumance qui conduit progressivement à une fréquence plus élevée d’utilisation des gouttes/
sprays. Pour ne pas compromettre le traitement par cPAP, il faut tout à fait envisager des interventions chirurgicales sur les cornets nasaux inférieurs. Grâce à la conchotomie assistée par radiofréquence, la réduction de la partie inférieure du nez, les traitements peuvent être effectués en préservant les tissus et sont très efficaces. Malgré les nombreuses options disponibles pour optimiser le traitement par PPC, le taux d’observance du traitement à long terme n’est que de 60 à 70%. Dans ce contexte, il est utile de rattacher les patients à des groupes d’entraide, ce qui peut améliorer considérablement l’acceptation du traitement parmi les personnes concernées grâce aux échanges réguliers entre elles.
Il existe quelques alternatives à la thérapie cPAP dans le traitement du SAOS, mais leur efficacité comparative est réduite. Les gouttières d’avancement mandibulaire (UPS) sont les plus utilisées. Leur confort a été considérablement amélioré ces dernières années grâce à l’utilisation de nouveaux matériaux et de nouvelles méthodes d’adaptation. En avançant la mâchoire inférieure, l’obstruction oropharyngée est réduite, surtout au niveau de la base de la langue. Les conditions préalables à l’adaptation d’un UPS sont un état dentaire suffisant, une protrusion suffisante de la mâchoire inférieure et l’absence de pathologies de l’articulation temporo-mandibulaire. Grâce aux améliorations techniques apportées à l’UPS au cours des dernières années, ce traitement est désormais considéré comme équivalent à la PPC chez les patients souffrant d’un SAOS léger à modéré, à condition que les conditions anatomiques et fonctionnelles susmentionnées soient remplies chez les personnes concernées.
En cas de SAOS sévère, les UPS ne doivent être utilisés qu’après l’échec de l’initialisation d’un traitement par PPC. Les effets secondaires typiques du traitement UPS sont des douleurs au niveau de l’articulation temporo-mandibulaire, de sorte que des contrôles réguliers par un dentiste ou un orthodontiste sont recommandés. En cas de SAOS dépendant du décubitus dorsal, souvent associé à un SAOS léger, l’utilisation d’un gilet de prévention du décubitus dorsal peut être utile. Il n’est pas rare que le port de ces dispositifs pendant la nuit soit perçu comme désagréable, de sorte que l’observance à long terme est plutôt faible. Les mesures chirurgicales alternatives au traitement par PPC sont l’uvulopalatopharnygoplastie combinée à une amygdalectomie bds. (TE-UPPP) [13], l’Advancement maxillomandibulaire [14] et la stimulation du nerf hypoglosse (HGNS, hypoglossal nerve stimulation) [15] peuvent être envisagées. L’indication de l’une de ces interventions chirurgicales implique une sélection précise des patients en fonction de l’anatomie et de la fonction des voies aériennes supérieures. L’indication d’une UPPP-TE nécessite la présence d’une hypertrophie de l’amygdale palatine bds, que l’on retrouve également dans la zone distale au niveau de la base de la langue, ainsi qu’un webbing prononcé, c’est-à-dire une position basse du voile du palais avec une luette hypertrophiée.
L’intervention se caractérise par son caractère très invasif, les complications possibles ne surviennent pas seulement dans l’évolution postopératoire immédiate, mais peuvent également entraîner des troubles à long terme en raison de la modification profonde de la structure anatomique de l’oropharynx. On observe en outre que le succès thérapeutique initial diminue avec le temps, de sorte que l’UPPP-TE ne doit être pratiquée qu’après une indication très stricte et une sélection très minutieuse des patients en préopératoire. En présence d’une malposition de la mâchoire chez les patients atteints de SAOS, il est possible d’envisager un avancement maxillomandibulaire, dans lequel une ostéotomie du maxillaire et de la mandibule permet de les avancer et d’éliminer ainsi très efficacement l’obstruction oropharyngée – en particulier l’espace aérien postérieur.
En principe, les patients ne présentant pas de malposition squelettique du maxillaire/de la mandibule sont également éligibles pour cette intervention, mais là encore, il convient de tenir compte du caractère hautement invasif de l’intervention et de la modification externe de la région maxillomandibulaire du visage. L’HGNS est une autre alternative chirurgicale pour le traitement du SAOS. L’agrégat du stimulateur est implanté de la même manière que les stimulateurs cardiaques connus, l’électrode de stimulation du nerf hypoglosse est placée à l’extrémité distale du nerf et une autre électrode est introduite dans un espace intercostal pour évaluer la respiration. Comme pour les autres procédures chirurgicales, un diagnostic préopératoire précis est nécessaire. Il est notamment recommandé de procéder à un examen endoscopique des voies respiratoires supérieures induit par les médicaments afin d’exclure une obstruction concentrique au niveau de l’oropharynx.
Apnée centrale du sommeil
L’apnée centrale du sommeil (ACS) est plus rare que l’AOS et se caractérise par l’absence d’efforts respiratoires pendant la pause respiratoire, en raison d’un dysfonctionnement de l’influx nerveux central qui commande la respiration. Outre son caractère idiopathique, la ZSA peut survenir dans le cadre de pathologies neurologiques dues à des lésions du centre respiratoire situé dans le bulbe rachidien. Les médicaments dépresseurs de la respiration, tels que les opiacés, peuvent également provoquer une ZSA. Cependant, le sous-type le plus courant est la respiration de Cheyne-Stokes, qui se produit chez jusqu’à la moitié des patients souffrant d’insuffisance cardiaque systolique sévère [16]. De manière caractéristique, des phases d’hyperventilation crescendo-decrescendo en forme de fuseau apparaissent entre les apnées centrales. Les facteurs de risque sont le sexe masculin, l’âge avancé, l’hypocapnie et la présence d’une fibrillation auriculaire [17]. Les hypoxies récurrentes et l’activation du système nerveux sympathique qui en résulte entraînent souvent des arythmies cardiaques malignes chez les patients concernés, ce qui réduit d’autant la survie globale de ce groupe de patients [18].
Outre le traitement de la maladie sous-jacente concernée, une approche de traitement par appareil est possible, comme pour le traitement du SAOS. La thérapie cPAP est moins efficace que pour le SAOS, le traitement appareillé peut être étendu par l’utilisation d’appareils biPAP-ST, ces appareils génèrent un niveau de pression différent à l’inspiration et à l’expiration et une fréquence respiratoire minimale est enregistrée ; si cette fréquence minimale n’est pas atteinte, les appareils déclenchent la respiration suivante. Une forme particulière est la servoventilation adaptative (ASV), utilisée dans le traitement de la respiration de Cheyne-Stokes. Avant d’initier une ASV, il est impératif de réaliser une échocardiographie pour déterminer la fraction d’éjection ventriculaire gauche (FEVG), car l’ASV ne doit être mise en place que pour les patients dont la FEVG est >45% [19]. La stimulation phrénique transveineuse [20] est une autre méthode de traitement de la ZSA. Comme pour l’HGNS, un stimulateur cardiaque est implanté et stimule le nerf phrénique via une électrode, la respiration est détectée via une autre électrode dans la veine azygos.
Hypoxémie et hypoventilation liées au sommeil
L’hypoxémie et l’hypoventilation liées au sommeil se caractérisent par des phases prolongées de réduction ventilatoire pendant le sommeil, principalement pendant les phases de sommeil paradoxal, avec des désaturations prolongées en oxygène (SB hypoxémie) et une hypercapnie concomitante (SB hypoventilation) due à une surcharge simultanée de la pompe respiratoire. Les céphalées matinales dues à l’hypercapnie sont typiques et s’accompagnent de vertiges, de troubles de la concentration et de fatigue diurne. Outre la BPCO, les maladies neuromusculaires et les déformations thoraciques jouent un rôle essentiel dans le développement de la maladie. Une forme particulière est le syndrome d’hypoventilation lié à l’obésité (OHS, obesity hypoventilation syndrom), qui se définit par une hypercapnie supérieure à 45 mmg/Hg de pCO2 pendant la journée et un IMC supérieur à 30. De nombreux patients présentent un SAOS concomitant.
Outre le traitement de la maladie sous-jacente, le traitement automatisé est le plus souvent réalisé à l’aide d’un appareil biPAP-ST. Si la cause est une BPCO cliniquement significative, le traitement par ventilation non invasive à domicile (VNI) [21] est généralement nécessaire, ainsi qu’une oxygénation prolongée d’au moins 16 heures par jour. Comme pour le traitement du SAOS par PPC, le succès à long terme des options de traitement susmentionnées est limité par le manque d’observance de la part des patients.
Messages Take-Home
- L’apnée obstructive du sommeil (AOS), l’apnée centrale du sommeil (ACS) ainsi que l’hypoxémie et l’hypoventilation liées au sommeil font partie des troubles respiratoires du sommeil (SBAS).
- Un ronflement excessif associé à des arrêts respiratoires et à la fatigue diurne ou à la somnolence qui en résulte sont des symptômes typiques du SAOS, qui est le SBAS le plus fréquent.
- L’insuffisance cardiaque peut entraîner un schéma respiratoire nocturne typique, la respiration de Cheyne-Stokes, qui est une forme de ZSA.
- L’hypoxémie et l’hypoventilation liées au sommeil se produisent en cas d’insuffisance respiratoire, d’épuisement de la pompe respiratoire ou de diminution de la fonction pulmonaire.
- Outre l’anamnèse et l’examen clinique, la polygraphie cardiorespiratoire ou polysomnographie constitue le cœur du diagnostic.
Littérature :
- Fietze I, Laharnar N, Obst A, et al : Prevalence and association analysis of obstructive sleep apnea with gender and age differences – Results of SHIP Trend. J Sleep Res 2019 ; 28(5) : e12770 ; doi : 10.1111/jsr12770 ; Epub 2018 Oct 1.
- Stuck BA, Weeß HG : La nouvelle “Classification internationale des troubles du sommeil” – Une évaluation critique des critères diagnostiques des troubles respiratoires du sommeil. Somnologie 2015 ; 19 : 126-132.
- Rodenbeck A : Manuel de l’American Academy of Sleep Medicine. Présentation de la version 2.0 de update. Somnologie 2013 ; 17 : 122-130.
- Schulz R, Eisele HJ, Reichenberger F, Seeger W : Apnée obstructive du sommeil et syndrome métabolique. Pneumologie 2008 ; 62(2) : 88-91.
- Schulz R, Eisele HJ, Weissmann N, Seeger W : L’apnée obstructive du sommeil : un facteur de risque cardiovasculaire important. Deutsches Ärzteblatt 2006 ; 103 : 775-781.
- Aurora RN, Crainiceanu C, Gottlieb DJ, et al : Apnée obstructive du sommeil pendant le sommeil paradoxal et maladie cardiovasculaire. AM J Respir Crit Care Med 2018 ; 197(5) : 653-660 ; doi : 10.1164/rccm.201706-1112OC.
- Gami AS, Pressman G, Caples SM et al : Association of atrial fibrillation and obstructive sleep apnea. Circulation 2004 ; 110(4) : 364-367 ; doi : 10.1161/01.CIR.0000136587.68725.8E ; Epub 2004 Jul12.
- Gottlieb DJ, Yenokyan G, Newman AB, et al : Prospective study of obstructive sleep apnea and incident coronary heart disease and heart failure : the sleep heart health study. Circulation 2010 ; 122(4) : 352-360 ; doi 10.1161/CIRCULATIONHA.109.901801 ; Epub 2010 Jul 12.
- Arzt M, Young T, Finn L, et al : Association of sleep-disordered breathing and the occurrence of stroke. Am J Respir Crit Care Med 2005 ; 172(11) : 1447-1451 ; doi : 10.1164/rccm.200505-7020C ; Epub 2005 Sept 1.
- Mazzotti DR, Keenan BT, Lim DC, et al : Symptom Subtypes of Obstructive Sleep Apnea Predict Incidence of Cardiovascular Outcomes. Am J Respir Crit Care Med 2019 ; 200(4) : 493-506 ; doi : 10.1164/rccm.201808-1509OC.
- Becker HF, Jerrentrup A, Ploch T, et al : Effect of nasal continuous positive airway pressure treatment on blood pressure in patients with obstructive sleep apnea. Circulation 2003 ; 107(1) : 68-73 ; doi : 10.1161/01.cir.0000042706.47107.7a.
- McEvoy RD, Antic NA, Heeley E, et al : CPAP for prevention of cardiovascular events in obstructive sleep apnea. N Engl J Med 2016 ; 375(10) : 919-931 ; doi : 10.1056/NEJMoa1606599.
- Fujita S, Conway WA, Zorick F, Roth T : Correction chirurgicale des anomalies anatomiques dans le syndrome de l’apnée obstructive du sommeil : uvulopalatopharyngoplastie. Otolaryngol Head Neck Surg 1981 ; 89 : 923-934.
- Hochban W, Brandenburg U, Peter JH. : Traitement chirurgical de l’apnée obstructive du sommeil par avancement maxillomandibulaire. Sleep 1994 ; 17 : 624-629.
- Strollo PJ Jr, Soose RJ, Maurer JT, et al : Upper-airway stimulation for obstructive sleep apnea. N Engl J Med 2014 ; 370(2) : 139-149 ; doi : 10.1056/NEJMoa1308659.
- Schulz R, Blau A, Börgel J et al : Sleep apnea in heart failure. Eur Respir J 2007 ; 29(6) : 1201-1205 ; doi : 10.1183/09031036.00037106.
- Sin DD, Fitzgerald F, Parker JD, et al : Risk facors for central and obstructive sleep apnea in 450 men and women with congestive heart failure. Am J Respir Crit Care Med 1999 ; 160(4) : 1101-1106 ; doi : 10.1164/ajrccm.160.4.9903020.
- Hanly PJ, Zuberi-Khokhar NS : Increased mortality associated with Cheyne-Stokes respiration in patients with congestive heart failure. Am J Respir Crit Care Med 1996 ; 153(1) : 272-276 ; doi : 10.1164/ajrccm.153.1.8542128.
- Cowie MR, Woehrle H, Wegscheider K, et al : Adaptive servo-ventilation for central sleep apnea in systolic heart failure. N Engl J Med 2015 ; 373(12) : 1095-1105 ; doi : 10.1056/NEJMoa1506459.
- Ponikowski P, Javaheri S, Michalkiewicz D, et al : Transvenous phrenic nerve stimulation for the treatment of central sleep apnea in heart failure. Eur Heart J 2012 ; 33(7) : 889-894 ; doi : 10.1093/eurheartj/ehr298.
- Köhnlein T, Windisch W, Köhler D, et al : Non-invasive positive pressure ventilation for the treatment of severe stable chronic obstructive pulmonary disease : a prospecitve, mulicentre, randomised, controlled clinical trial. Lancet Respir Med 2014 ; 2(9) : 698-705 ; doi : 10.1016/S2213-2600(14)70153-5.
PRATIQUE DU MÉDECIN DE FAMILLE 2021 ; 16(5) : 5-9