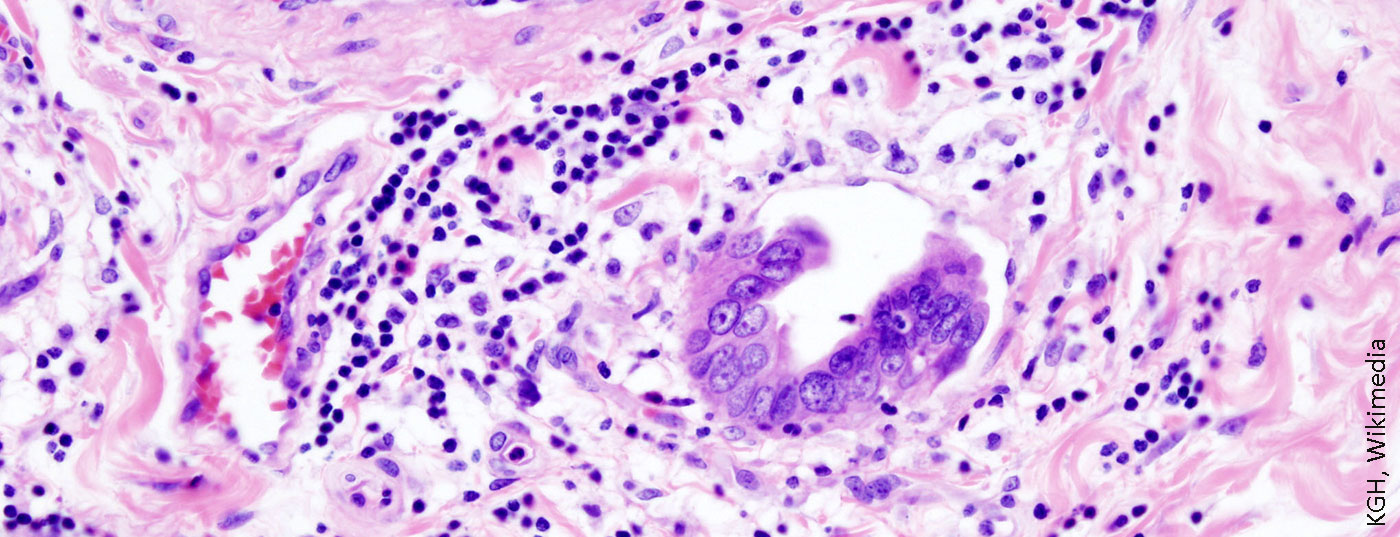
Les tumeurs du système biliaire, telles que le cholangiocarcinome ou le cholécarcinome de la vésicule biliaire, font partie des entités tumorales malignes rares, mais elles sont en augmentation constante. Parfois, une chimiothérapie combinée systémique et locorégionale peut être envisagée. Dans tous les cas, le traitement doit avoir lieu dans un centre spécialisé avec une équipe multidisciplinaire.
Les tumeurs du système biliaire, telles que le cholangiocarcinome ou le cholécarcinome de la vésicule biliaire, font partie des entités tumorales malignes rares, mais leur nombre n’a cessé d’augmenter en Europe et en Suisse au cours des deux dernières décennies. Cette entité tumorale se propage le long du système biliaire et n’est souvent diagnostiquée correctement qu’à un stade avancé. C’est pourquoi la mortalité liée à cette maladie continue d’augmenter. Au moindre doute, le patient doit être adressé rapidement à un centre spécialisé. Le diagnostic précis des tumeurs biliaires requiert une grande expertise de la part d’une équipe interdisciplinaire. Un algorithme d’évaluation erroné peut faire passer une option de traitement potentiellement curable à une situation palliative ou retarder un traitement curatif. Le traitement des patients concernés se déroule généralement selon un concept thérapeutique multimodal comprenant une résection chirurgicale, une chimiothérapie systémique et, dans certains cas sélectionnés, une radiothérapie. Le type d’opération dépend de la localisation de la tumeur. Dans de rares cas, la transplantation hépatique est une option de traitement potentielle pour les patients atteints de cholangiocarcinome périhilaire. Cet article de synthèse fait le point sur les risques et les facteurs de risque de cette maladie grave et explique les stratégies de traitement multimodales modernes qui, au cours de la dernière décennie, ont apporté un avantage décisif en termes de survie aux patients concernés.
Comment les tumeurs des voies biliaires sont-elles classées ?
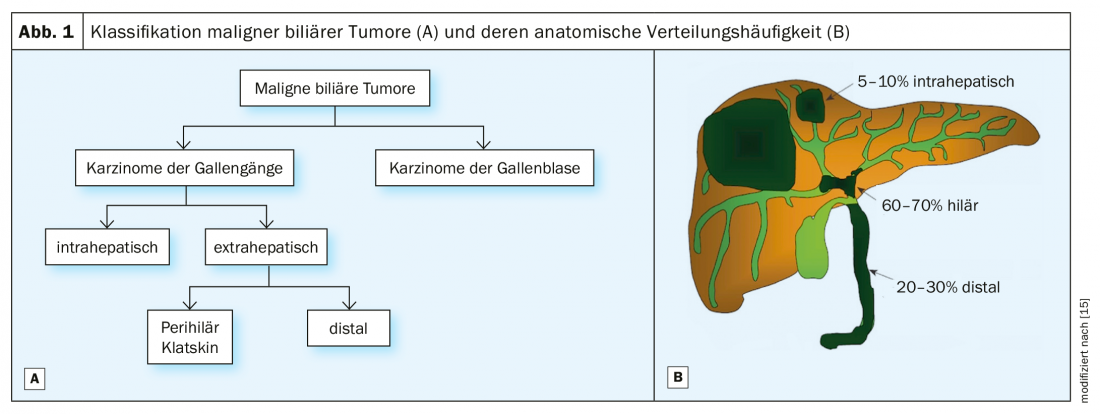
Les tumeurs biliaires malignes sont divisées en carcinomes des voies biliaires (cholangiocarcinomes) et de la vésicule biliaire, les premiers étant classés en tumeurs intrahépatiques et extrahépatiques selon leur localisation anatomique (Fig. 1). Les tumeurs extra-hépatiques sont ensuite divisées en cholangiocarcinomes périhilaires et distaux. Les tumeurs périhilaires, également appelées tumeurs de Klatskin, sont localisées immédiatement à la bifurcation du système biliaire extrahépatique, alors que les cholangiocarcinomes distaux se développent plus distalement dans le canal cholédoque, au niveau de la tête du pancréas [1]. La stratégie de traitement chirurgical est basée sur cette classification anatomique des tumeurs.
Quelle est la fréquence du cholangiocarcinome en Suisse ?
Le cholangiocarcinome est une maladie tumorale maligne et hétérogène très rare, qui se développe à partir des cellules épithéliales des voies biliaires intra- et extrahépatiques. Ce type de cancer représente 3% de toutes les tumeurs malignes gastro-intestinales [2]. En 2018, 334 nouveaux cas ont été diagnostiqués en Suisse. Cependant, chez la plupart des patients, ce cancer est malheureusement détecté à un stade localement avancé, ce qui explique que la mortalité liée à cette maladie tumorale reste élevée. Chaque année en Suisse, près de la moitié des patients décèdent après le diagnostic (180 décès par an ; ce qui correspond à 1% de tous les décès par cancer par an) [2].
Qui est concerné et quels sont les facteurs de risque connus ?
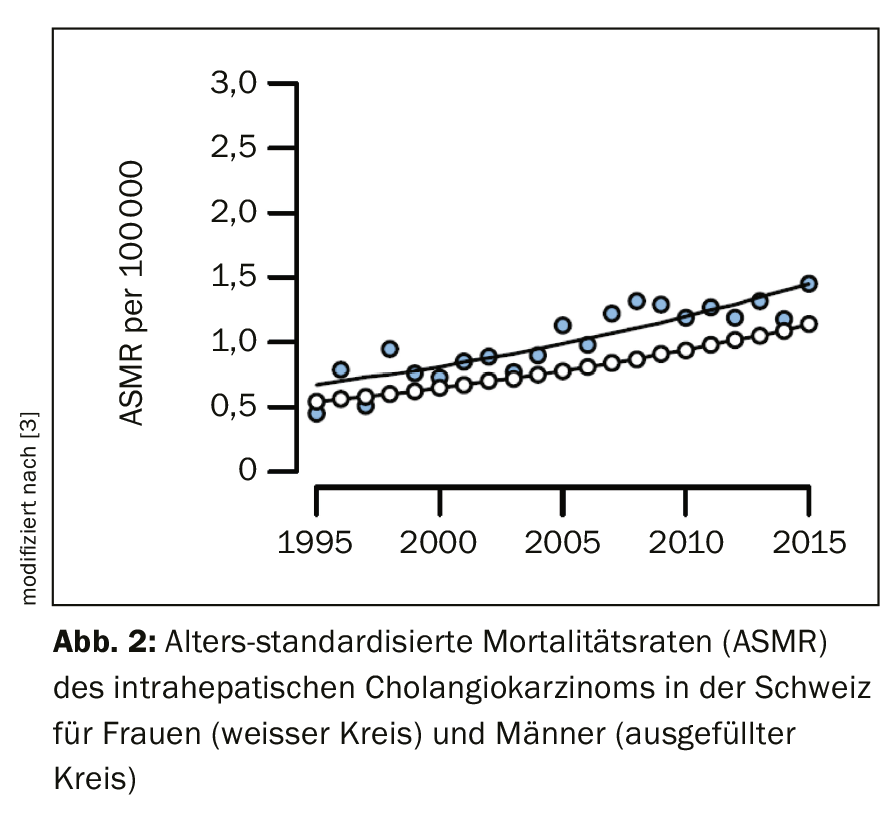
Pour des raisons encore obscures, l’incidence du cholangiocarcinome intrahépatique a augmenté au cours des deux dernières décennies en Suisse et dans le monde (Fig. 2), tandis que les taux de cholangiocarcinome extrahépatique sont en baisse [3]. En règle générale, l’incidence du cancer des voies biliaires augmente avec l’âge et atteint son pic entre 50 et 70 ans [4,5]. Les patients chez qui on a diagnostiqué une cholangite sclérosante primaire (CSP) ou des kystes cholédociens connus développent des cancers en moyenne près de deux décennies plus tôt. Contrairement au cancer de la vésicule biliaire, pour lequel les femmes sont nettement plus touchées, l’incidence du cholangiocarcinome est légèrement plus élevée chez les hommes [4]. Cela reflète probablement l’incidence plus élevée de la PSC chez les hommes.
Un certain nombre de facteurs de risque de cholangiocarcinome sont connus, bien qu’un facteur de risque spécifique ne puisse pas être clairement identifié pour de nombreux patients [5]. En Europe, les principaux facteurs de risque sont la cholangite sclérosante primaire (CSP) et les kystes du cholédoque. Il existe un lien clair entre l’hépatolithiase intrahépatique chronique, qui entraîne une cholangite pyogène récidivante, et le cholangiocarcinome. Les maladies chroniques du foie telles que la cirrhose ou l’hépatite B et C sont connues pour être des facteurs de risque, en particulier pour le cholangiocarcinome intrahépatique [5,6]. En outre, au moins quatre maladies génétiques telles que le syndrome de Lynch, le syndrome de prédisposition aux tumeurs de la protéine 1 associée au BRCA (BAP1), la fibrose kystique et la papillomatose biliaire semblent augmenter le risque de cholangiocarcinome [6].
Quelles sont les clarifications modernes nécessaires ?
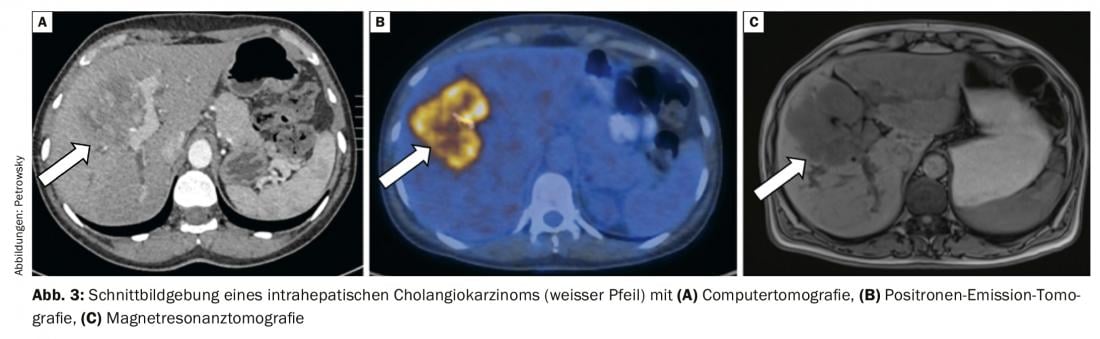
Le diagnostic des cholangiocarcinomes suit généralement des algorithmes d’évaluation complexes et nécessite souvent une infrastructure avec une expertise prononcée en gastroentérologie endoscopique et en radiologie interventionnelle. Si l’on suspecte une tumeur maligne des voies biliaires chez un patient, il faut d’abord procéder à une classification topographique. La meilleure méthode non invasive pour la représentation anatomique spatiale de la tumeur, et en particulier des voies biliaires, est la cholangiopancréatographie par résonance magnétique (MRCP) [7]. Elle est désormais presque aussi sensible et spécifique que la cholangiographie rétrograde endoscopique (CRE) diagnostique et la cholangiographie transhépatique percutanée (CTP), plus invasives [7]. L’imagerie par résonance magnétique avec MRCP permet d’évaluer la résécabilité locale et sert également de “planificateur d’itinéraire” pour un éventuel drainage endoscopique ou percutané nécessaire. La tomodensitométrie montre une sensibilité accrue en cas d’infiltration tumorale des artères et des veines pour l’évaluation avant la résection planifiée (Fig. 3) [7].
En cas d’épaississement des voies biliaires sur une longue distance, le diagnostic différentiel doit également porter sur une cholangiopathie auto-immune. Dans ce cas, le dosage des IgG4 dans le sérum et une endosonographie (EUS) pour évaluer le canal biliaire sont utiles [8]. En cas de ganglions lymphatiques rétropéritonéaux et périhilaires anormaux, une EUS doit également être réalisée afin de déterminer la valeur intrinsèque des ganglions lymphatiques accessibles par ponction à l’aiguille fine.
Pour la suite du staging, le PET/CT est particulièrement précieux, notamment pour le diagnostic des métastases à distance, qui ne sont souvent pas toujours diagnostiquées par l’imagerie régulière comme l’IRM ou le scanner. Le PET/CT fait partie du “work-up” standardisé dans notre clinique et a une influence importante sur le choix du traitement adéquat (Fig. 3) [7,9].
Une fois l’imagerie réalisée, tous les patients sans exception sont présentés et discutés au sein de notre tumorboard interdisciplinaire. En particulier, cela est indispensable avant un diagnostic invasif comme la CPRE ou la PTCD, car toute manipulation des voies biliaires rend l’évaluation de l’imagerie en coupe plus difficile.
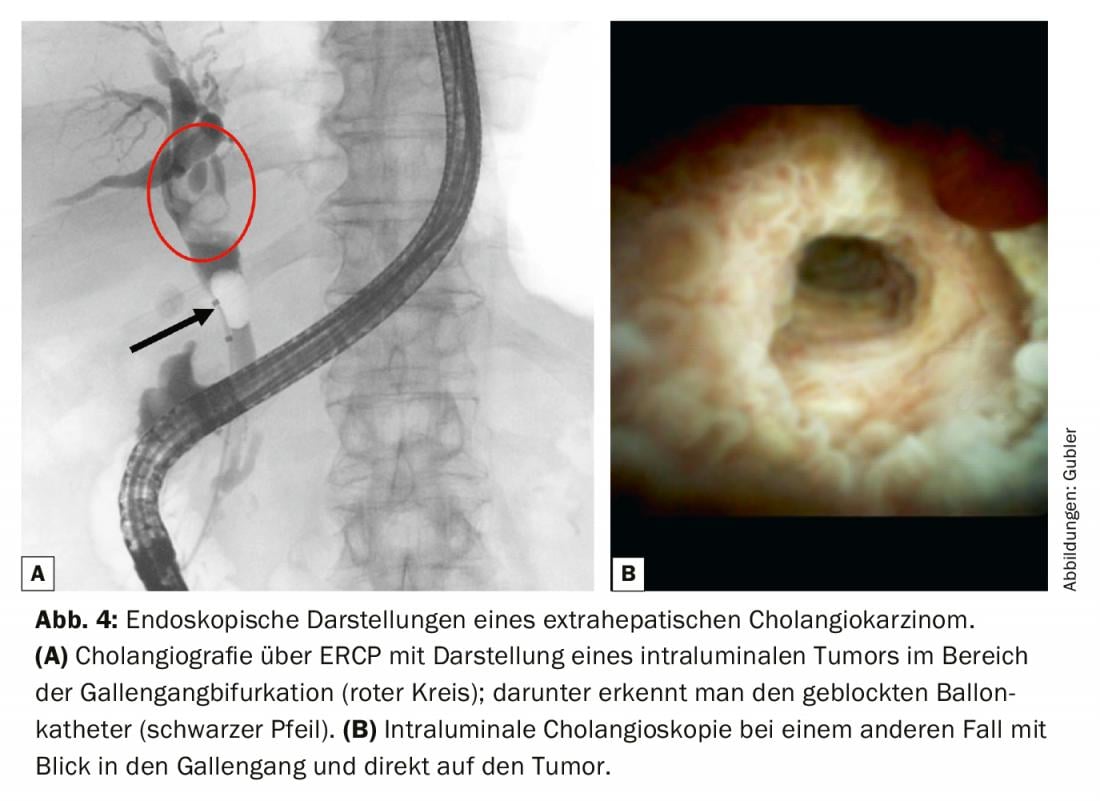
Pour les tumeurs résécables du foie ou du hile hépatique, il est préférable d’insérer en préopératoire une PTCD sur la partie du foie à conserver afin de décomprimer le système biliaire [10]. Dans le diagnostic histologique des cholangiocarcinomes périhilaires et distaux, la CPRE [11] occupe une place de choix, sachant qu’en cas de remplissage des voies biliaires, un drainage doit également être effectué, faute de quoi une cholangite avec abcès hépatiques potentiels risque de se produire. Initialement, le plus important est de réaliser un cholangiogramme de haute qualité avec obtention focalisée d’une cytologie en brosse (Fig. 4). Celle-ci est généralement associée à une biopsie intraluminale afin d’augmenter la sensibilité. En cas de diagnostic tissulaire négatif, ce qui n’est pas rare, une cholangioscopie perorale (POCS) avec cartographie des voies biliaires sous contrôle visuel peut également être réalisée dans un deuxième temps. Il s’agit ici de représenter la bifurcation des voies biliaires ainsi que les voies biliaires droite et gauche afin d’utiliser les résultats de la cartographie pour la planification de l’opération avec une estimation de l’étendue de la résection préopératoire [12]. Une laparoscopie de stadification peut être utile pour détecter les petites métastases ainsi que la carcinomatose péritonéale qui ne sont pas visibles au scanner ou à l’IRM [13].
Quels sont les éléments à prendre en compte pour la résécabilité chirurgicale ?
Pour évaluer une résection chirurgicale, l’emplacement de la lésion tumorale, y compris ses relations avec les structures vasculaires et biliaires, ainsi que le volume et la qualité du parenchyme hépatique restant après la résection de la tumeur sont essentiels (tableau 1).
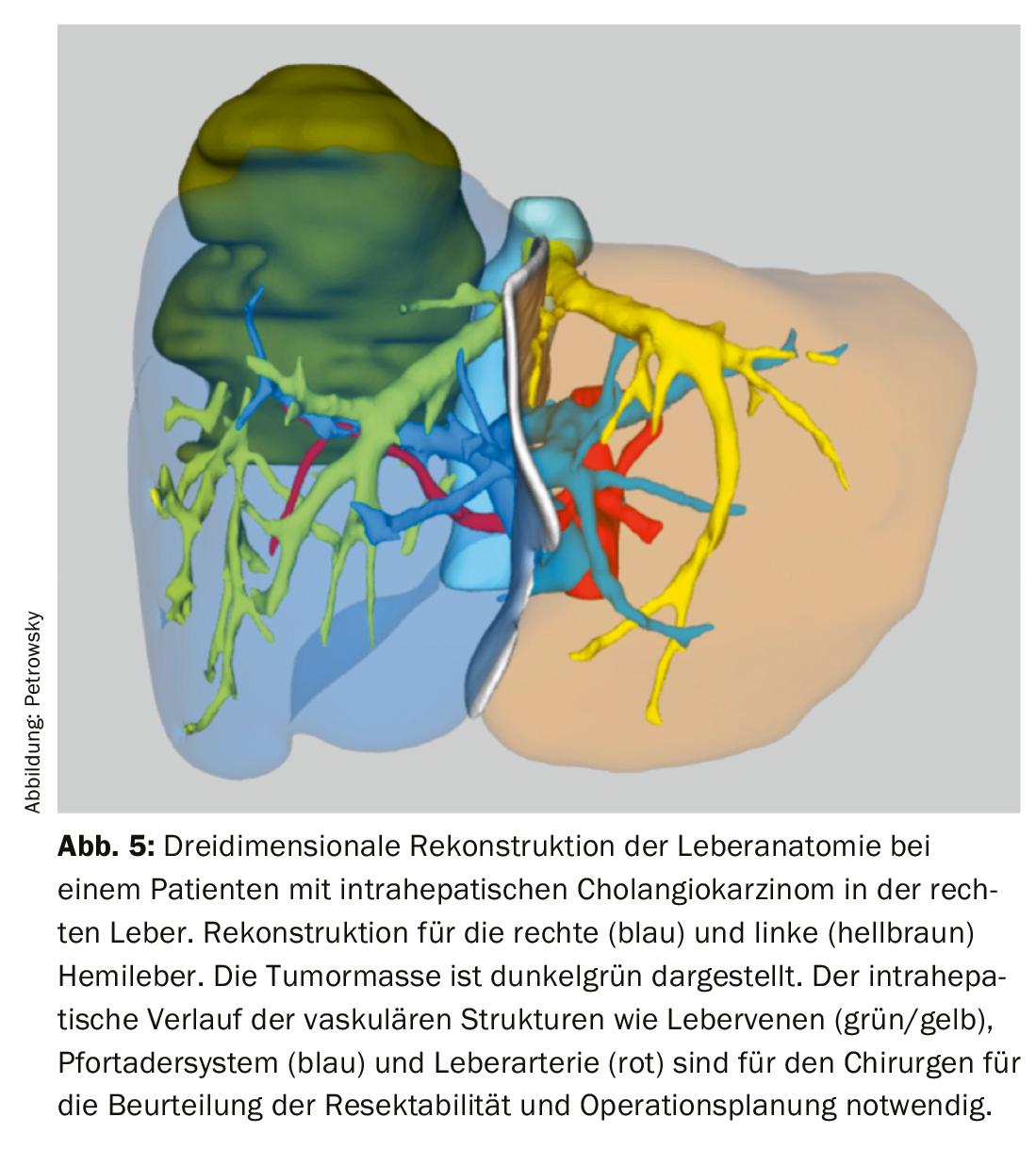
Pour évaluer précisément la résécabilité technique et mieux planifier l’opération, la plupart des centres disposent aujourd’hui de reconstructions d’images tridimensionnelles de l’anatomie vasculaire et biliaire du foie (fig. 5). La preuve histologique préopératoire de la tumeur est toujours recherchée avant une opération, mais elle ne peut pas toujours être obtenue en cas de cholangiocarcinome périhilaire. Dans ces cas, une masse suspecte à l’imagerie en coupe, associée aux données cliniques correspondantes, suffit à suspecter une tumeur maligne et à indiquer une résection.
Le traitement chirurgical reste la seule modalité de traitement curatif, mais seulement si la résection peut être réalisée en bloc avec des marges de résection sans tumeur (histologiquement R0) [14]. L’évaluation de la résécabilité doit tenir compte de la taille de la tumeur, des lésions satellites, de l’atteinte vasculaire, des métastases ganglionnaires et des métastases à distance. Bien que la taille de la tumeur ait été controversée ces dernières années, elle a été réintroduite dans le système de staging de la 8e édition de l’AJCC [4]. Une augmentation de la taille de la tumeur est associée à une augmentation de l’incidence des métastases satellites, des métastases ganglionnaires, des tumeurs vasculaires et mal différenciées, et donc à une moins bonne biologie générale de la tumeur [10,15].
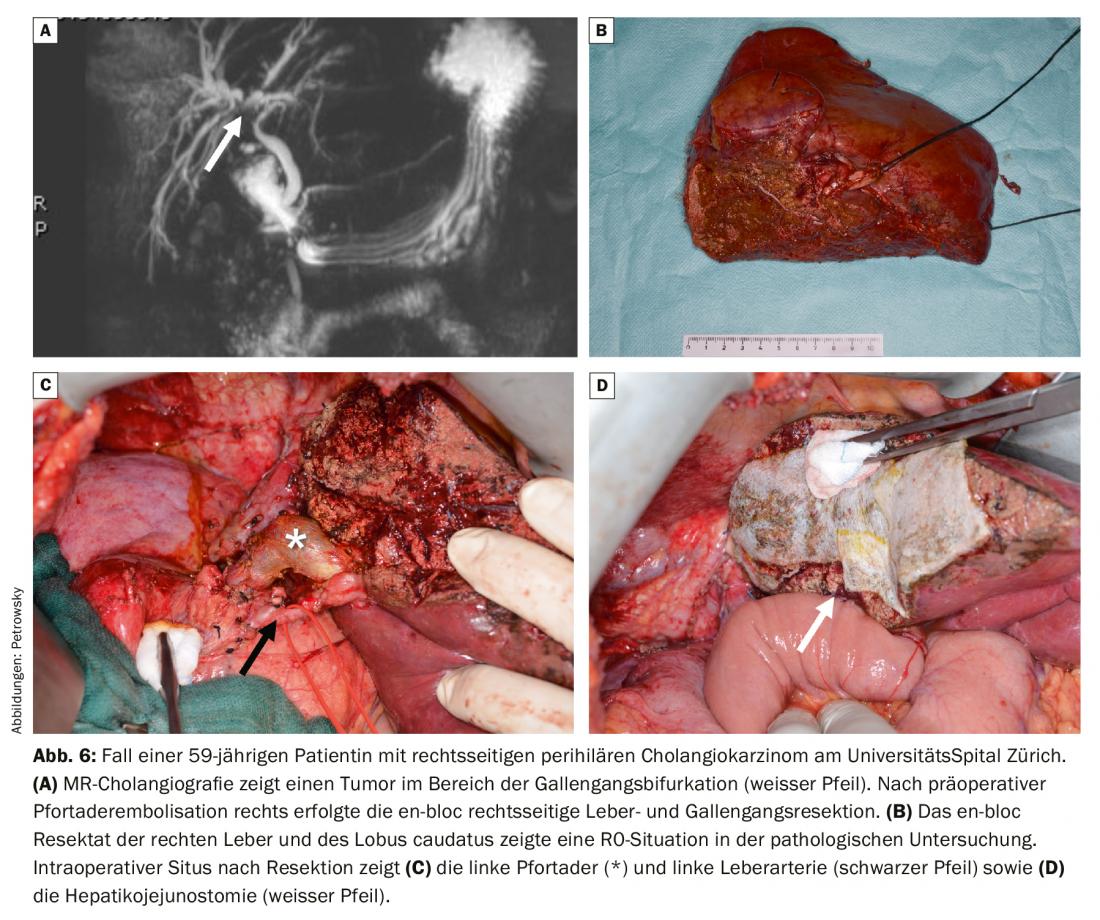
La procédure chirurgicale primaire dépend en premier lieu de la localisation de la tumeur. Ainsi, la résection classique de la tête du pancréas (Whipple) est adaptée aux cholangiocarcinomes localisés dans le canal biliaire distal. La résection hépatique des cholangiocarcinomes périhilaires s’oriente vers le côté où l’atteinte tumorale est dominante. Les opérations des tumeurs des voies biliaires hilaires sont très complexes et nécessitent généralement une résection des voies biliaires extra-hépatiques ainsi qu’une hémihepatectomie élargie incluant la résection du lobus caudatus (Fig. 6) [15]. En cas d’infiltration tumorale de la bifurcation de la veine porte, une résection de la veine porte avec reconstruction primaire est nécessaire [16]. Une volumétrie et des tests fonctionnels de la fonction hépatique sont toujours réalisés en préopératoire pour ces opérations. Souvent, ces procédures chirurgicales hépatiques très étendues nécessitent une embolisation préopératoire de la veine porte pour induire une hypertrophie lorsque le foie restant est trop petit. Cependant, dans certains cas, la tumeur provoque une auto-hypertrophie par occlusion tumorale d’une branche de la veine porte, qui dans cette situation ne nécessite plus d’embolisation préopératoire de la veine porte. Dans notre centre hépatobiliaire, nous drainons également le côté restant du foie, généralement à l’aide d’un PTCD (drainage transhépatique percutané du cholangium), qui peut ensuite être utilisé comme contention interne et structure de guidage lors de l’opération. Ces opérations hautement spécialisées ne doivent être effectuées qu’après une planification minutieuse dans un centre spécialisé.
Dans le cas des cholangiocarcinomes intrahépatiques, la résection du côté du foie atteint est au premier plan. Les procédures de résection hépatique nécessaires à cet effet ne sont pas différentes de celles utilisées pour d’autres tumeurs hépatiques, telles que les métastases hépatiques colorectales. En fonction de la taille et de la localisation de la tumeur, nous proposons à nos patients toute la gamme des techniques chirurgicales, de l’ablation mini-invasive de la tumeur assistée par robot aux interventions hépatiques complexes de grande envergure. Une condition importante est un volume de résidus hépatiques suffisant en quantité et en qualité [15]. Si, en raison de la taille de la tumeur, l’étendue de la résection ne permet pas d’obtenir un volume suffisant du foie restant, il est possible de procéder à une embolisation de la veine porte pour une hypertrophie préopératoire du volume ou, dans des cas sélectionnés, à une procédure chirurgicale en deux temps du foie (opération ALPPS) [17]. Dans la procédure ALPPS, une première opération consiste à fermer une branche de la veine porte de la moitié du foie qui contient la tumeur et à sectionner le parenchyme hépatique entre les deux moitiés du foie. Cela déclenche une poussée de croissance rapide et substantielle du côté du foie où la veine porte reste ouverte. Après 1 à 2 semaines, la tumeur peut alors être retirée sans problème dans le cadre d’une deuxième opération, de sorte qu’il reste suffisamment de tissu hépatique. Cette stratégie permet d’obtenir des taux de résection R0 supérieurs à 85%, mais doit être réservée aux cas où la charge tumorale du foie est unilatérale et où la croissance de la moitié du foie non tumorale est adéquate après embolisation de la veine porte [17].
En cas de cholangiocarcinome intrahépatique initialement non résécable, une chimiothérapie de conversion combinée systémique et intra-artérielle peut être administrée. La chimiothérapie à haute dose est administrée en continu directement dans l’artère gastroduodénale à l’aide d’une pompe. Le traitement intra-artériel permet d’atteindre dans le foie des taux de principe actif nettement plus élevés que par voie systémique. Le taux de réponse de cette chimiothérapie locorégionale intensifiée, le plus souvent avec de la floxuridine (FUDR), est de 60% et prolonge significativement la survie des patients, même en situation palliative [18]. Dans notre centre, nous proposons cette thérapie aux patients en situation palliative et potentiellement curative de cholangiocarcinome intrahépatique. Nous implantons généralement la pompe par voie sous-cutanée dans la région de l’abdomen inférieur droit et insérons le cathéter de la pompe de manière peu invasive à l’aide du système robotique da Vinci (fig. 7). Cette procédure chirurgicale mini-invasive est très douce pour les patients et garantit une récupération postopératoire rapide et donc un début rapide de la chimiothérapie après l’implantation de la pompe.
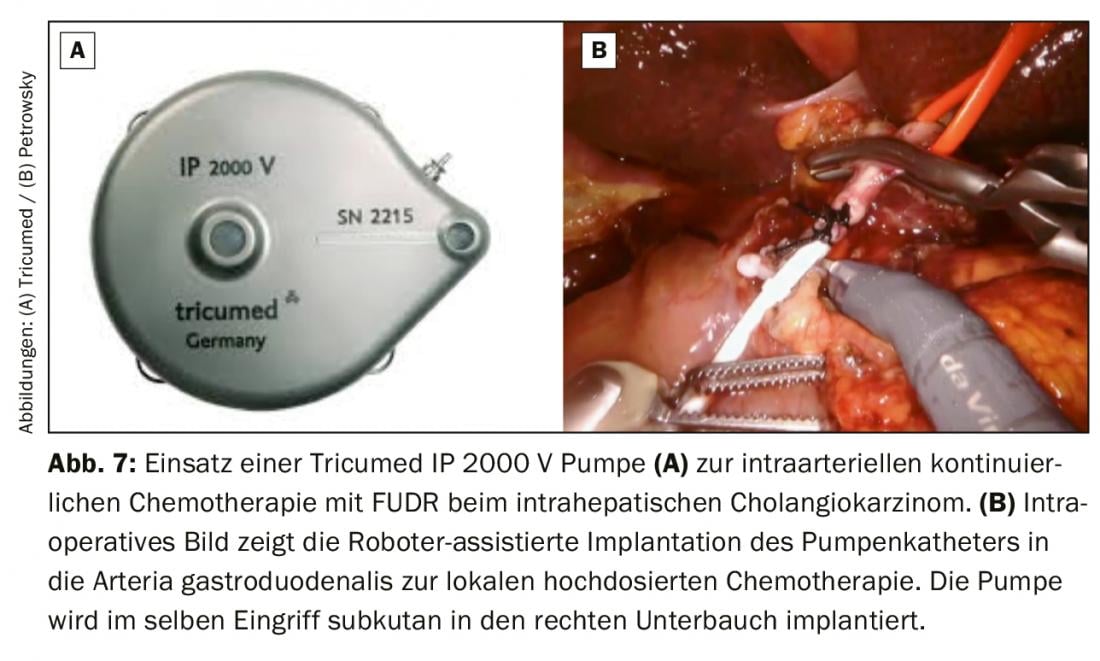
La transplantation hépatique est-elle une option thérapeutique ?
Bien que la transplantation hépatique offre techniquement la meilleure possibilité de résection R0, l’immunosuppression postopératoire constitue un risque élevé de récidive tumorale. Jusqu’à présent, il n’existe des critères établis pour la transplantation hépatique que dans le cas du cholangiocarcinome périhilaire. Celles-ci sont définies par une tumeur d’une taille maximale de 3 cm sans détection de ganglions lymphatiques locorégionaux ni de métastases à distance. Les patients, avec ou sans CSP, qui répondent à ces critères et qui ne sont pas résécables en premier lieu, doivent être évalués pour une transplantation hépatique précédée d’une radiochimiothérapie néoadjuvante. Des taux de survie élevés de 60-70% peuvent être obtenus 5 ans après la transplantation hépatique [19,20]. Les critères d’indication de la transplantation hépatique dans le cholangiocarcinome intrahépatique sont moins bien établis, bien que certaines études récentes rapportent de bonnes données de survie après transplantation chez des patients sélectionnés [21,22].
Chimiothérapie et immunothérapie – Qu’est-ce qui est établi et qu’est-ce qui est nouveau ?
En cas de maladie avancée ou métastatique, la chimiothérapie systémique reste le traitement standard des adénocarcinomes du tractus biliaire. Pour la chimiothérapie, aucune distinction n’a été faite jusqu’à présent entre les différents sous-groupes anatomiques. Le standard en première ligne de traitement est l’association gemcitabine-cisplatine sur la base des données de l’étude ABC02 [23], qui a démontré la supériorité de ce protocole par rapport à la gemcitabine mono. Pour les patients plus âgés et ceux dont le statut de performance est réduit, des protocoles plus légers sont plus appropriés, le plus probable étant la gemcitabine en monothérapie.
Les études sur le traitement de deuxième ligne sont encore peu nombreuses. Seule l’étude ABC0624 a démontré un avantage de survie pour les patients traités par FOLFOX en deuxième ligne par rapport à une surveillance active. Les protocoles alternatifs de traitement de seconde ligne, non validés par des études randomisées de grande envergure, mais couramment utilisés dans la pratique, sont le FOLFIRI et le 5-FU/capécitabine.
Cependant, la chimiothérapie systémique n’est pas seulement utilisée en cas de maladie non résécable ou métastatique, mais également pour le traitement post-opératoire. Dans ce cas, l’étude BILCAP a démontré un avantage de survie faible mais significatif pour le traitement ultérieur par capécitabine [25]. Les résultats de l’étude ACTICCA1, qui compare la capécitabine mono à l’association activée gemcitabine/cisplatine dans le traitement post-résection, sont très attendus. D’autres approches d’étude examinent le rôle de la thérapie néoadjuvante, notamment dans le cancer incident de la vésicule biliaire (AIO-HEP-0118, étude GAIN).
La réponse au traitement est actuellement évaluée en premier lieu par l’imagerie en coupe. Les paramètres d’évolution biochimiques sont principalement les marqueurs tumoraux établis CEA et CA19-9. Les sous-groupes moléculaires de tumeurs biliaires sont extrêmement passionnants et d’une importance clinique rapidement croissante. En fonction de la localisation primaire, on trouve dans les cholangiocarcinomes, à des fréquences variables, toute une série de pilotes oncogènes différents. Il existe de nouvelles substances ciblées sur le plan moléculaire contre un grand nombre de ces moteurs, dont certaines sont déjà bien avancées dans le développement clinique et dont l’autorisation de mise sur le marché est attendue prochainement. Les inhibiteurs du récepteur du facteur de croissance des fibroblastes (FGFR), qui présentent une excellente efficacité dans les carcinomes cholangiocellulaires avec altération oncogénique du FGFR (surtout des fusions du FGFR2, mais aussi des amplifications élevées), doivent être mentionnés en priorité (p. ex. pemigatinib ou TAS-120). Jusqu’à 20% des cholangiocarcinomes intrahépatiques présentent de telles altérations du FGFR, alors qu’elles sont rares dans les localisations tumorales extrahépatiques. Les mutations IDH1 et IDH2 constituent une autre cible thérapeutique. Ils sont également fréquents dans les cholangiocarcinomes intrahépatiques et les premières études randomisées montrent une efficacité selon [26]. Les autres cibles moléculaires sont BRAF-V600E, les altérations BRAF de classe II et III et HER2. Un petit groupe de cholangiocarcinomes présentent une instabilité des microsatellites (MSI-H) et répondent bien au blocage du point de contrôle immunitaire [27]. Des études sont en cours sur les combinaisons de thérapies moléculaires ciblées et d’immunothérapies (par exemple pembrolizumab plus lenvatinib).
Quand la radiothérapie stéréotaxique est-elle une option ?
Même si, dans le traitement des cancers des voies biliaires non résécables localement avancés, la thérapie systémique était jusqu’à présent au premier plan, la radiothérapie de l’atteinte locale a sa place dans le contrôle local de la tumeur et donc dans la prévention ou la réduction des symptômes ou des complications. De nouveaux développements techniques, comme la radiothérapie stéréotaxique, permettent de cibler la zone tumorale (Fig. 8) en quelques séances (généralement 5 à 8), avec un profil d’effets secondaires faible et sans interférence ou retard de la thérapie systémique [28–30].
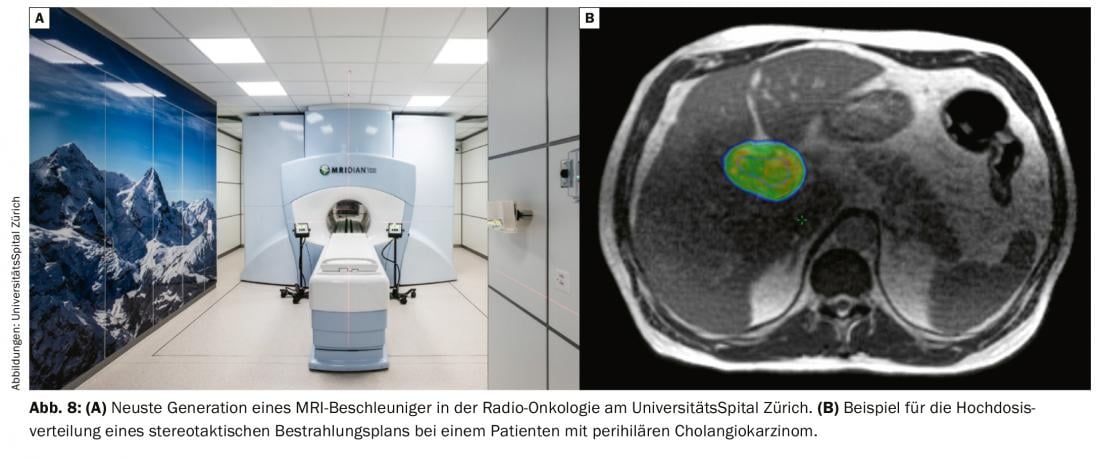
Le dernier développement dans ce domaine, l’irradiation assistée par IRM, n’est disponible en Suisse que sous la forme d’un accélérateur RM hybride à l’Hôpital universitaire de Zurich. (ill. 7). Cette technologie permet une détection optimale des tumeurs avec une meilleure préservation des organes à risque grâce à un meilleur contraste des tissus mous, une imagerie en temps réel pendant l’irradiation et la possibilité d’optimiser le plan quotidiennement en fonction de l’anatomie des organes adjacents au jour le jour.
Dans une grande étude rétrospective, on a également observé un avantage absolu en termes de survie grâce à l’ajout d’une radiothérapie au traitement systémique [28]. Par conséquent, chez les patients atteints d’un carcinome des voies biliaires non résécable qui ne présentent pas de métastases au cours du traitement systémique ultérieur, une radiothérapie locale supplémentaire doit toujours être discutée de manière interdisciplinaire.
Dans quelles structures le traitement du cholangiocarcinome est-il intégré à l’hôpital universitaire ?
Le traitement chirurgical du cholangiocarcinome, soit par résection du foie, soit par résection du pancréas, fait partie de la médecine hautement spécialisée (MHS) en Suisse. A l’hôpital universitaire, le traitement des cholangiocarcinomes est assuré par des spécialistes hautement qualifiés en collaboration avec tous les domaines médicaux. Il s’agit notamment de la chirurgie du foie et du pancréas, de l’oncologie médicale, de la gastroentérologie endoscopique, de la radiologie interventionnelle et de la radiothérapie. L’Hôpital universitaire de Zurich propose les traitements les plus récents et les plus efficaces pour ces tumeurs et est un centre certifié pour le cancer du foie, dont font partie les cholangiocarcinomes. Les traitements de tous les patients diagnostiqués avec un cholangiocarcinome sont intégrés dans les structures du Centre des tumeurs du foie du Comprehensive Cancer Center de Zurich (CCCZ) et du Centre suisse pour les maladies du foie, du pancréas et des voies biliaires (Swiss HPB Center). La discussion des patients a lieu chaque semaine lors d’un tumor board interdisciplinaire axé sur les tumeurs du foie, du pancréas et des voies biliaires. Les résultats post-thérapeutiques et les intervalles de contrôle nécessaires ou les thérapies secondaires sont également discutés. De plus, nos patients ont la chance de participer à des études scientifiques menées à l’hôpital universitaire et peuvent ainsi bénéficier d’innovations supplémentaires.
Messages Take-Home
- Les cholangiocarcinomes intrahépatiques montrent une augmentation mondiale tandis que les cholangiocarcinomes extrahépatiques ont tendance à diminuer.
- En cas de suspicion de tumeur des voies biliaires, le patient doit être adressé le plus tôt possible à un centre spécialisé ; la participation d’une équipe multidisciplinaire et d’un tumorboard est essentielle.
- Les résections tumorales des cholangiocarcinomes font partie de la médecine hautement spécialisée en Suisse et nécessitent souvent des procédures endoscopiques et radiologiques interventionnelles pour la préparation préopératoire.
- Les cholangiocarcinomes périhilaires (tumeurs de Klatskin), qui sont principalement localisés au niveau de la bifurcation des canaux biliaires, peuvent également être guéris par une transplantation hépatique dans des cas sélectionnés et en appliquant un concept thérapeutique multidisciplinaire.
- Pour les cholangiocarcinomes intrahépatiques, une chimiothérapie combinée systémique et locorégionale peut être envisagée ; les taux de réponse sont supérieurs à 60%.
- L’examen de pathologie moléculaire doit toujours être envisagé, en particulier dans le cas du cholangiocarcinome intrahépatique, afin d’identifier les pilotes oncogènes qui permettent une thérapie ciblée sur le plan moléculaire.
Littérature :
- Malhi H, Gores GJ : Cholangiocarcinoma : modern advances in understanding a deadly old disease. J Hepatol 45, 856-867, doi:10.1016/j.jhep.2006.09.001 (2006).
- Suisse K : Le cancer en Suisse : chiffres clés. (2018).
- Bertuccio P, et al : Tendances globales de la mortalité par cholangiocarcinome intrahépatique et extrahépatique. J Hepatol 71, 104-114, doi:10.1016/j.jhep.2019.03.013 (2019).
- Mazzaferro V, Gorgen A, Roayaie S, et al : Résection et transplantation hépatique pour cholangiocarcinome intrahépatique. J Hepatol 72, 364-377, doi:10.1016/j.jhep.2019.11.020 (2020).
- Dervin D : Edmond : existe-t-il une telle chose qu’un jeu malade ? Psychoanal Rev 73, 111-119 (1986).
- Chapman RW : Facteurs de risque de carcinogenèse du tractus biliaire. Ann Oncol 10 Suppl 4, 308-311 (1999).
- Olthof SC, et al : Imagerie du cholangiocarcinome. Visc Med 32, 402-410, doi:10.1159/000453009 (2016).
- Strongin A, Singh H, Eloubeidi MA, Siddiqui AA : Role of endoscopic ultrasonography in the evaluation of extrahepatic cholangiocarcinoma. Endosc Ultrasound 2, 71-76, doi:10.4103/2303-9027.117690 (2013).
- Petrowsky H, et al : Impact of integrated positron emission tomography and computed tomography on staging and management of gallbladder cancer and cholangiocarcinoma. J Hepatol 45, 43-50, doi:10.1016/j.jhep.2006.03.009 (2006).
- Rassam F, et al : Modern work-up and extended resection in perihilar cholangiocarcinoma : the AMC experience. Langenbecks Arch Surg 403, 289-307, doi:10.1007/s00423-018-1649-2 (2018).
- Abu-Hamda EM, Baron TH : Gestion endoscopique du cholangiocarcinome. Semin Liver Dis 24, 165-175, doi:10.1055/s-2004-828893 (2004).
- Ishida Y, Itoi T, Okabe Y : Can image-enhanced cholangioscopy distinguish benign from malignant lesions in the biliary duct ? Best Pract Res Clin Gastroenterol 29, 611-625, doi:10.1016/j.bpg.2015.05.007 (2015).
- Bird N, et al : Role of staging laparoscopy in the stratification of patients with perihilar cholangiocarcinoma. Br J Surg 104, 418-425, doi:10.1002/bjs.10399 (2017).
- Matull WR, et al : La résection R0 mais pas R1/R2 est associée à une meilleure survie que la thérapie photodynamique palliative dans le cancer du tractus biliaire. Liver Int 31, 99-107, doi:10.1111/j.1478-3231.2010.02345.x (2011).
- Petrowsky H, Hong JC : Gestion chirurgicale actuelle du cholangiocarcinome hilaire et intrahépatique : le rôle de la résection et de la transplantation hépatique orthotopique. Transplant Proc 41, 4023-4035, doi:10.1016/j.transproceed.2009.11.001 (2009).
- Hemming AW, Mekeel K, Khanna A, et al : Résection de la veine porte dans la gestion du cholangiocarcinome hilaire. J Am Coll Surg 212, 604-613 ; discussion 613-606, doi:10.1016/j.jamcollsurg.2010.12.028 (2011).
- Li J, et al : ALPPS for Locally Advanced Intrahepatic Cholangiocarcinoma : Did Aggressive Surgery Lead to the Oncological Benefit ? Une étude internationale multicentrique. Ann Surg Oncol, doi:10.1245/s10434-019-08192-z (2020).
- Konstantinidis IT, et al : Unresectable intrahepatic cholangiocarcinoma : systemic plus hepatic arterial infusion chemotherapy is associated with longer survival in comparison with systemic chemotherapy alone. Cancer 122, 758-765, doi:10.1002/cncr.29824 (2016).
- Darwish Murad S, et al : Efficacité de la chimioradiation néoadjuvante, suivie d’une transplantation hépatique, pour le cholangiocarcinome périhilaire dans 12 centres américains. Gastroenterology 143, 88-98 e83 ; quiz e14, doi:10.1053/j.gastro.2012.04.008 (2012).
- Ethun CG, et al : Transplantation Versus Resection for Hilar Cholangiocarcinoma : An Argument for Shifting Treatment Paradigms for Resectable Disease. Ann Surg 267, 797-805, doi:10.1097/SLA.0000000000002574 (2018).
- Sapisochin G, et al : Transplantation hépatique pour cholangiocarcinome intrahépatique “très précoce” : étude rétrospective internationale soutenant une évaluation prospective. Hepatology 64, 1178-1188, doi:10.1002/hep.28744 (2016).
- Lunsford KE, et al : Transplantation hépatique pour cholangiocarcinome intrahépatique localement avancé traité par thérapie néoadjuvante : une série de cas prospective. Lancet Gastroenterol Hepatol 3, 337-348, doi:10.1016/S2468-1253(18)30045-1 (2018).
- Valle J, et al : Cisplatine plus gemcitabine versus gemcitabine pour le cancer du tractus biliaire. N Engl J Med 362, 1273-1281, doi:10.1056/NEJMoa0908721 (2010).
- ABC-06 | Une étude randomisée de phase III, m.-c., en ouvert, de contrôle actif des symptômes (ASC) seul ou ASC avec chimiothérapie par oxaliplatine / 5-FU (ASC+mFOLFOX)
- Lamarca A, et al : Standards actuels et perspectives futures dans le traitement adjuvant des cancers du tractus biliaire. Cancer Treat Rev 84, 101936, doi:10.1016/j.ctrv.2019.101936 (2019).
- Abou-Alfa GK, Javle TMM, Kelley RK, et al. : Une étude globale, de phase 3, randomisée, en double aveugle de l’ivosidenib (IVO) vs placebo chez des patients atteints de cholangiocarcinome avancé (CC) avec une mutation de l’isocitrate déshydrogénase 1 (IDH1). Congrès de l’ESMO (2019).
- Le DT, et al : Le déficit de réparation des mésappariements prédit la réponse des tumeurs solides au blocage du PD-1. Science 357, 409-413, doi:10.1126/science.aan6733 (2017).
- Jackson MW, et al : Treatment Selection and Survival Outcomes With and Without Radiation for Unresectable, Localized Intrahepatic Cholangiocarcinoma. Cancer J 22, 237-242, doi:10.1097/PPO.0000000000000213 (2016).
- Gkika E, et al : Radiothérapie stéréotaxique corporelle (SBRT) pour les cholangiocarcinomes intrahépatiques et extrahépatiques localement avancés. BMC Cancer 17, 781, doi:10.1186/s12885-017-3788-1 (2017).
- Brunner TB, et al : Stereotactic body radiotherapy dose and its impact on local control and overall survival of patients for locally advanced intrahepatic and extrahepatic cholangiocarcinoma. Radiother Oncol 132, 42-47, doi:10.1016/j.radonc.2018.11.015 (2019).
InFo ONKOLOGIE & HÉMATOLOGIE 2020 ; 8(1) : 9-16