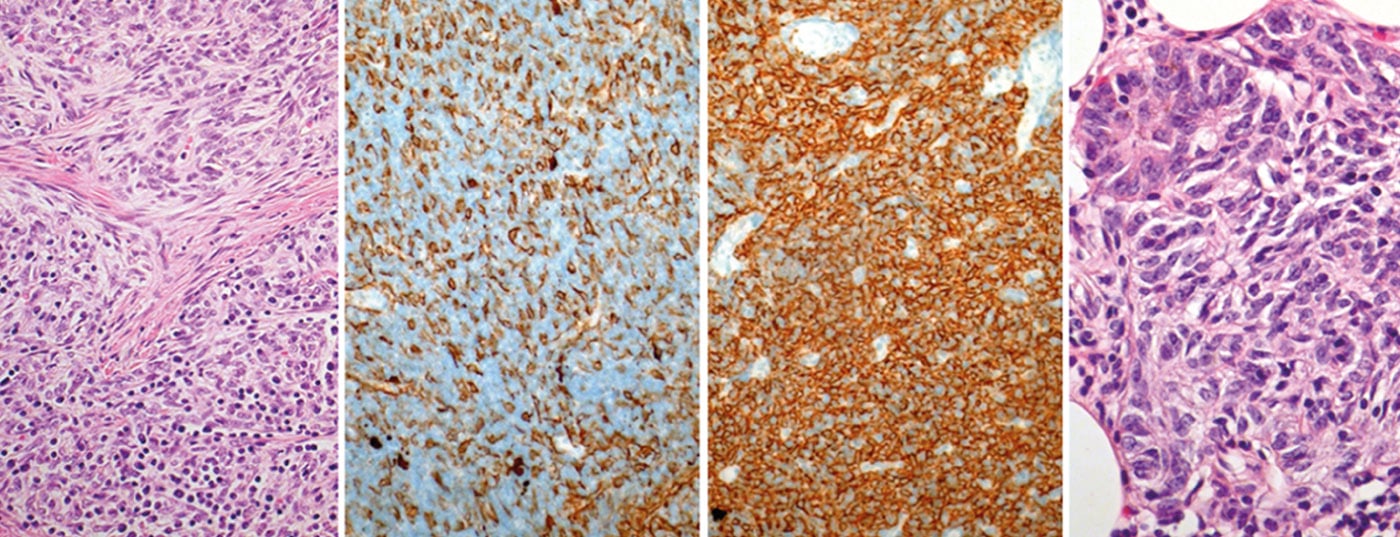
Les tumeurs du thymus sont rares et font partie des “maladies orphelines”. L’incidence annuelle est d’environ 0,15 pour 100 000 personnes. La classification la plus récente distingue trois grands groupes : Les thymomes, les carcinomes thymiques et les tumeurs neuroendocrines du thymus. En raison de leur rareté, la plupart des connaissances sur le diagnostic et le traitement proviennent de séries de cas et d’études monocentriques. Ce n’est qu’en 2010 qu’une société internationale et interdisciplinaire (International Thymic Malignancy Interest Group, ITMIG) a été créée pour promouvoir la collaboration mondiale et initier des recherches cliniques et fondamentales sur les tumeurs du thymus.
Les tumeurs du thymus sont rares : Leur incidence est de 0,15/100’000/an [1]. Ils peuvent survenir à tout âge, mais ils sont plus fréquents entre 30 et 40 ans pour les thymomes accompagnés d’une myasthénie grave ou d’une myasthénie chronique manifeste. de 60 à 70 ans sans myasthénie [2]. Les femmes et les hommes sont touchés à peu près à égalité. Environ un tiers des patients atteints d’un thymome sont asymptomatiques, alors qu’environ deux tiers des patients atteints d’un carcinome du thymus ou d’une tumeur neuroendocrine du thymus se distinguent principalement par des symptômes locaux.
Présentation clinique
Les symptômes les plus courants, tels que les douleurs thoraciques, la toux et l’essoufflement, sont causés par la croissance locale. Les tumeurs invasives peuvent également entraîner un syndrome de la veine cave supérieure ou une paralysie du nerf phrénique avec surélévation du diaphragme ou un enrouement dû au rétrécissement du nerf laryngé récurrent. De plus, les tumeurs du thymus sont souvent associées à des syndromes paranéoplasiques (tableau 1).

La myasthénie grave est de loin le syndrome paranéoplasique le plus fréquent. Dans les séries cliniques, il est rapporté qu’environ 30 à 50% des patients atteints de thymome, en particulier de thymome de type B2, présentent une myasthénie. Inversement, un thymome peut être détecté chez 10 à 15% des patients atteints de myasthénie. Environ 5% des patients atteints de myasthénie associée au thymome présentent d’autres syndromes paranéoplasiques, par exemple une thyroïdite auto-immune, une aplasie des cellules rouges pures, une encéphalopathie limbique, etc. La myasthénie grave est beaucoup plus rare dans les carcinomes du thymus – on ne l’observe pratiquement que dans les carcinomes avec une composante de thymome. Les tumeurs neuroendocrines du thymus sont parfois associées à des endocrinopathies.
Diagnostic
Le diagnostic des tumeurs du thymus repose sur les caractéristiques cliniques, les techniques d’imagerie et le traitement histopathologique des biopsies ou des prélèvements. de résections ou de coupes rapides. En ce qui concerne l’imagerie, la tomodensitométrie (TDM) est la principale modalité d’évaluation initiale et de suivi [3]. L’IRM peut être utilisée pour évaluer une invasion présumée du cœur et des gros vaisseaux sanguins [4]. Le TEP permet de distinguer le diagnostic de suspicion d’hyperplasie thymique de celui de thymome ou de cancer du sein. d’une tumeur moins agressive par rapport à une tumeur très agressive. La confirmation histologique préopératoire a perdu un peu de son importance, car les méthodes radiologiques récentes ont aujourd’hui une meilleure fiabilité diagnostique et l’objectif est de procéder à une résection complète des tumeurs correspondantes, quelle que soit l’entité exacte. En général, une biopsie doit être effectuée lorsque les résultats radiologiques ne sont pas clairs et qu’un lymphome ne peut être exclu, ou en cas de résultat non résécable avant l’introduction d’une chimiothérapie d’induction ou d’une radiochimiothérapie définitive [5].
Staging et classification histologique
Le système de staging le plus couramment utilisé pour les thymomes est la classification de Masoaka, dont la dernière révision date de 1994 (tableau 2) [6].

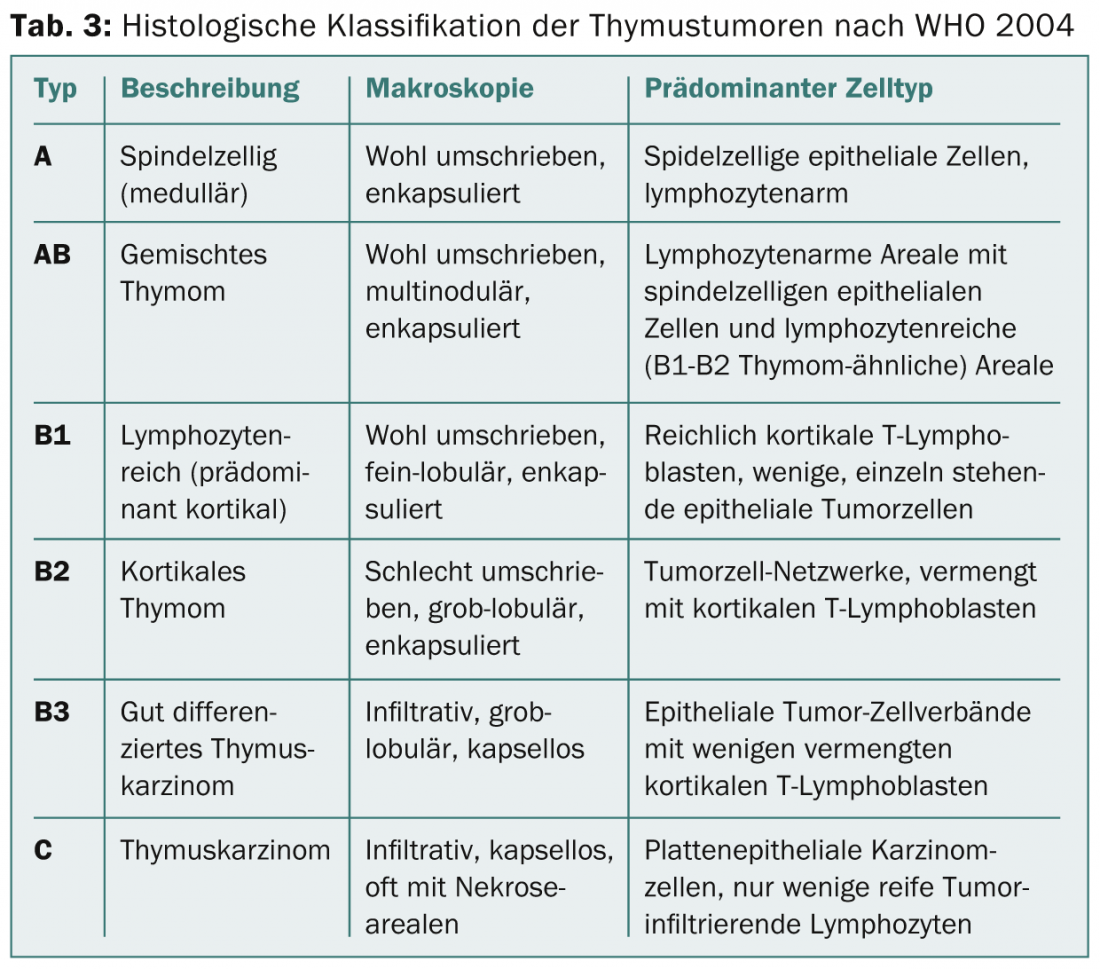
Dans les années à venir, un système de stadification basé sur le TNM sera établi. Pour la classification histologique, il existait auparavant différentes classifications. En 1999, l’OMS a introduit une classification histologique basée sur la morphologie et le rapport entre les lymphocytes et les cellules épithéliales. Cette classification a été révisée en 2004 (tab. 3) .
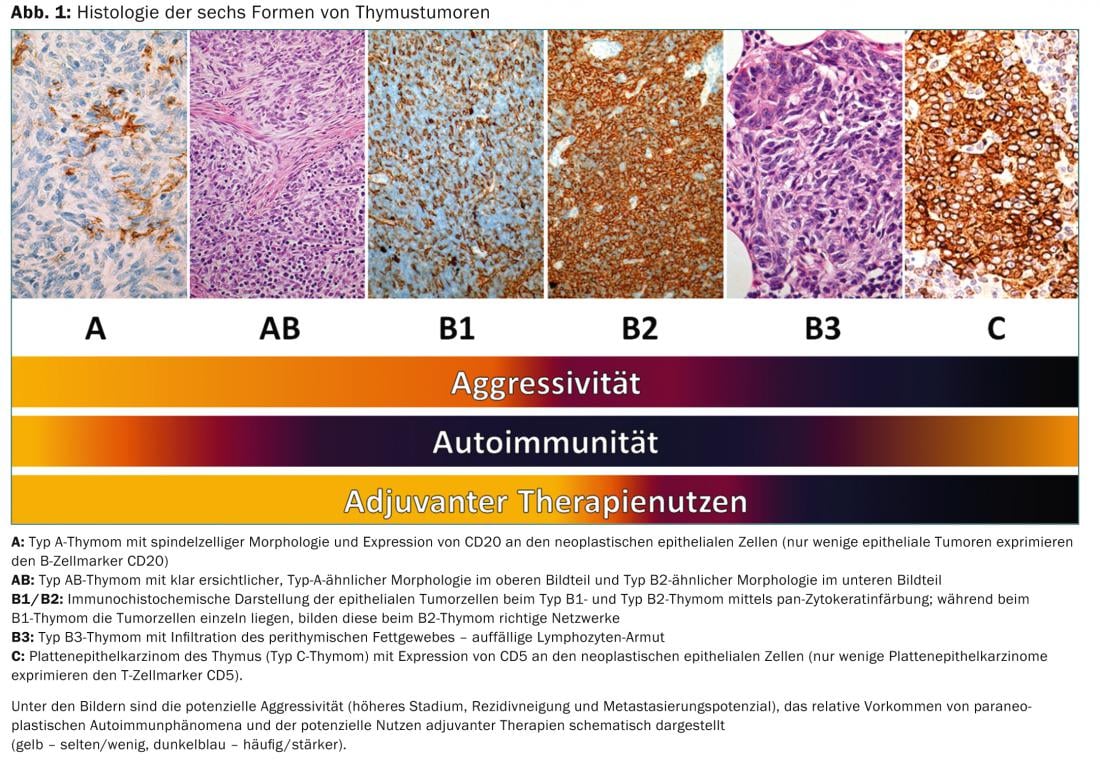
Elle reflète d’une part la biologie tumorale des tumeurs du thymus (par exemple, différentes origines cellulaires, différentes agressivités, différentes fréquences d’auto-immunité paranéoplasique), mais a également une importance pour les décisions thérapeutiques (Fig. 1).
Traitement des tumeurs du thymus
Plusieurs séries et études ont examiné les facteurs pronostiques potentiels des tumeurs du thymus. Les seuls facteurs pronostiques validés pour la survie et la probabilité de récidive sont (par ordre décroissant d’importance) le stade au moment du diagnostic, l’étendue de la résection tumorale et le sous-type histologique [7,8].
Chirurgie
La résection chirurgicale est la pierre angulaire du traitement et il faut toujours viser une résection complète. L’International Thymic Malignancy Interest Group (ITMIG) recommande une résection en bloc avec ablation complète du thymus et résection du tissu adipeux environnant en raison d’une possible infiltration du tissu adipeux non visible macroscopiquement. La survie à dix ans dépend du stade et est de 90, 70, 55 et 35% respectivement pour les stades I, II, III et IVa. Les taux de récidive correspondants après résection complète sont de 3, 11, 30 et 43% [9].
Radiothérapie
Les tumeurs du thymus ont tendance à récidiver localement, d’où l’importance de la radiothérapie postopératoire. Pour l’irradiation, on vise une dose totale de 50-54 Gy.
En cas de résection incomplète, des doses plus élevées (jusqu’à 60 Gy) sont recommandées. Il n’y a pas de bénéfice démontré pour la radiothérapie aux stades I et II du masoaka [7,10]; cela semble également être le cas pour les sous-types histologiques A, AB et B1 [11]. Néanmoins, au stade II, de nombreux centres pratiquent une radiothérapie postopératoire, comme l’a montré une enquête récemment publiée en Europe [12]. Au stade III, la radiothérapie adjuvante s’est établie et est également recommandée dans les directives internationales, même si les études cliniques ne fournissent que peu de preuves à ce sujet [7,13,14]. Pour les patients inopérables en première intention ou après une chimiothérapie d’induction, la radiothérapie définitive constitue une option thérapeutique, l’objectif étant d’administrer une dose allant jusqu’à 70 Gy. Le taux de réponse est d’environ 70% et la probabilité d’être encore en vie après cinq ans est de 70 à 80%, ce qui est comparable au taux de survie en cas de résection incomplète [15,16].
Chimiothérapie
La chimiothérapie a une place dans le cadre du traitement primaire, en situation de récidive et en cas de métastases [17]. Pour les tumeurs primaires non résécables de stade III et IV selon Masoaka, la chimiothérapie néoadjuvante ou la radiochimiothérapie combinée constituent le traitement de choix. Globalement, on peut s’attendre à un taux de réponse d’environ 70% (29-100%). La résection ultérieure est également possible dans environ 70% des cas [2]. Toutes les études ont porté sur des chimiothérapies combinées.
En situation postopératoire, la place de la chimiothérapie est moins bien établie. Le contrôle local de la tumeur est l’objectif thérapeutique le plus important, car les thymomes ont tendance à rarement métastaser (10-15%). C’est pourquoi la radiothérapie ou, le cas échéant, la radiochimiothérapie combinée (pour les tumeurs non résécables, les patients inopérables ou les tumeurs réséquées de manière incomplète) a la priorité sur la chimiothérapie seule en postopératoire. En situation métastatique ou en cas de récidive non résécable et déjà irradiée, la chimiothérapie peut être utilisée dans une intention palliative. On utilise généralement des chimiothérapies combinant une anthracycline et un dérivé du platine, avec des taux de réponse compris entre 50 et 90% [18]. Pour les tumeurs réfractaires au platine, il n’existe pas de traitement standard éprouvé, diverses substances en monothérapie et des combinaisons sans platine présentent des taux de réponse de 20 à 40% [19]. La thérapie locale (chirurgie / radiothérapie) a également sa place dans le contrôle des symptômes des tumeurs localement avancées ou en présence de métastases.
Thérapies ciblées
Ces dernières années, comme pour d’autres tumeurs solides, les thérapies ciblées ont été de plus en plus étudiées pour les tumeurs du thymus [19]. Une forte expression des récepteurs de la somatostatine est observée dans environ la moitié des tumeurs du thymus. Ces patients semblent bénéficier d’une thérapie ciblée à l’octréotide, le bénéfice étant plus important pour les thymomes que pour les carcinomes du thymus.
Une surexpression de la tyrosine kinase c-KIT est présente dans environ 2% des thymomes et 80% des carcinomes du thymus. Les mutations activatrices, telles que celles trouvées dans les tumeurs stromales gastro-intestinales (GIST), sont rares dans les tumeurs du thymus. Le traitement par l’imatinib (Glivec®), un inhibiteur multikinase ciblant notamment c-KIT, a permis de stabiliser la maladie dans les tumeurs avancées, en particulier celles présentant une mutation c-KIT.
Le récepteur du facteur de croissance épithélial (EGFR) est surexprimé dans 70% des thymomes et environ 50% des carcinomes du thymus. Les mutations activatrices, telles qu’elles se produisent dans l’adénocarcinome du poumon, sont toutefois rares. Le traitement par inhibiteurs de la tyrosine kinase EGFR n’a montré qu’un bénéfice modeste. Le cetuximab, un anticorps anti-EGFR, fait actuellement l’objet d’un essai clinique.
Comme pour d’autres tumeurs, la néoangiogenèse joue un rôle dans les tumeurs du thymus. Des substances anti-angiogéniques (bevacizumab, sunitinib) ont permis d’obtenir une réponse tumorale dans de petites études. Le récepteur 1 du facteur de croissance analogue à l’insuline (IGFR-1) est surexprimé dans environ 20% des tumeurs du thymus. Le traitement par cixutumumab, un anticorps anti-IGFR-1, a permis d’obtenir un taux élevé de stabilisation de la maladie.
Take-home-messages
- Les tumeurs du thymus sont des maladies rares du médiastin antérieur et se divisent en thymomes avec différents sous-groupes histologiques, carcinomes du thymus et tumeurs neuroendocrines du thymus.
- Les thymomes sont souvent associés à des syndromes paranéoplasiques, dont le plus fréquent est la myasthénie grave, alors que les carcinomes du thymus et les tumeurs neuroendocrines du thymus se manifestent le plus souvent par des symptômes locaux.
- La base du traitement est la résection chirurgicale complète ; en fonction du stade et éventuellement du sous-type, une radiothérapie postopératoire peut être évaluée.
- La chimiothérapie est utilisée dans les tumeurs localement avancées (éventuellement en combinaison avec une radiothérapie) comme traitement d’induction avant une opération programmée.
- En cas de tumeur inopérable ou de récidive locale, une radiochimiothérapie est effectuée.
- Dans le cas de tumeurs métastatiques, une chimiothérapie associant une anthracycline et une substance contenant du platine peut entraîner un taux de réponse élevé.
- A l’avenir, une meilleure compréhension de la biologie moléculaire des tumeurs du thymus permettra de cibler les traitements sur certains sous-groupes.
Littérature :
- Engels EA, Pfeiffer RM : Thymome malin aux États-Unis : modèles démographiques de l’incidence et associations avec des malignités ultérieures. Int J Cancer 2003 ; 105(4) : 546-551. doi:10.1002/ijc.11099.
- Venuta F, et al.:Thymome et carcinome thymique.Eur J Cardiothorac Surg 2010 ; 37(1) : 13-25. doi:10.1016/j.ejcts.2009.05.038.
- Marom EM : Advances in thymoma imaging. J Thorac Imaging 2013 ; 28(2) : 69-80. quiz 81-83. doi:10.1097/RTI.0b013e31828609a0.
- Sadohara J, et al : Tumeurs épithéliales thymiques : comparaison des résultats du scanner et de l’IRM des thymomes à faible risque, des thymomes à haut risque et des carcinomes thymiques. Eur J Radiol 2006 ; 60(1) : 70-79. doi:10.1016/j.ejrad.2006.05.003.
- Detterbeck FC, Parsons AM : Tumeurs thymiques. Ann Thorac Surg 2004 ; 77(5) : 1860-1869. doi:10.1016/j.athoracsur.2003.10.001.
- Koga K, et al : A review of 79 thymomas : modification of staging system and reappraisal of conventional division into invasive and non-invasive thymoma. Pathol Int 1994 ; 44(5) : 359-367. www.ncbi.nlm.nih.gov/pubmed/8044305. Accessed December 2, 2014.
- Kondo K, Monden Y : Traitement des tumeurs épithéliales thymiques : une étude clinique de 1 320 patients japonais. Ann Thorac Surg 2003 ; 76(3) : 878-884 ; discussion 884-885. www.ncbi.nlm.nih.gov/pubmed/12963221. Accessed December 2, 2014.
- Ströbel P, et al : Récurrence tumorale et survie chez les patients traités pour des thymomes et des carcinomes épidermoïdes thymiques : une analyse rétrospective. J Clin Oncol 2004 ; 22(8) : 1501-1509. doi:10.1200/JCO.2004.10.113.
- Koppitz H, et al : State-of-the-art classification and multimodality treatment of malignant thymoma. Cancer Treat Rev 2012 ; 38(5) : 540-548. doi:10.1016/j.ctrv.2011.11.010.
- Ruffini E, et al : Recurrence of thymoma : analysis of clinicopathologic features, treatment, and outcome. J Thorac Cardiovasc Surg 1997 ; 113(1) : 55-63. www.ncbi.nlm.nih.gov/pubmed/9011702. Accessed December 2, 2014.
- Chen G, et al : La nouvelle classification histologique de l’OMS prédit le pronostic des tumeurs épithéliales thymiques : une étude clinicopathologique de 200 cas de thymome en Chine. Cancer 2002 ; 95(2) : 420-429. doi:10.1002/cncr.10665.
- Ruffini E, et al : Management of thymic tumors : a survey of current practice among members of the European Society of Thoracic Surgeons. J Thorac Oncol 2011 ; 6(3) : 614-623. doi:10.1097/JTO.0b013e318207cd74.
- Korst RJ, et al : Radiothérapie adjuvante pour les tumeurs épithéliales thymiques : une revue systématique et une méta-analyse. Ann Thorac Surg 2009 ; 87(5) : 1641-1647. doi:10.1016/j.athoracsur.2008.11.022.
- Forquer JA, et al : Radiothérapie postopératoire après résection chirurgicale du thymome : rôles différents dans les maladies localisées et régionales. Int J Radiat Oncol Biol Phys 2010 ; 76(2) : 440-445. doi:10.1016/j.ijrobp.2009.02.016.
- Loehrer PJ, et al : Cisplatine, doxorubicine, et cyclophosphamide plus radiothérapie thoracique pour le thymome limited-stage unresectable : an intergroup trial. J Clin Oncol 1997 ; 15(9) : 3093-3099. www.ncbi.nlm.nih.gov/pubmed/9294472. Accessed December 2, 2014.
- Girard N, Mornex F : Le rôle de la radiothérapie dans la gestion des tumeurs thymiques. Thorac Surg Clin 2011 ; 21(1) : 99-105, vii. doi:10.1016/j.thorsurg.2010.08.011.
- Girard N, et al : Définitions de la chimiothérapie et politiques pour les tumeurs thymiques. J Thorac Oncol 2011 ; 6(7 Suppl 3) : S1749–1755. doi:10.1097/JTO.0b013e31821ea5f7.
- Girard N : Thymome : de la chimiothérapie à la thérapie ciblée. Am Soc Clin Oncol Educ Book 2012 : 475-479. doi:10.14694/EdBook_AM.2012.32.475.
- Berardi R, et al : Thymic neoplasms : an update on the use of chemotherapy and new targeted therapies. Une revue de la littérature. Cancer Treat Rev 2014 ; 40(4) : 495-506. doi:10.1016/j.ctrv.2013.11.003.
InFo ONKOLOGIE & HÄMATOLOGIE 2015 ; 3(2) : 16-20