Le fer est essentiel à plusieurs fonctions biochimiques et physiologiques. La carence en fer est très répandue et constitue l’une des principales causes d’anémie. En prévention, il est important d’avoir un apport suffisant en ferritine par le biais de l’alimentation. En présence d’une carence en fer, il est possible de procéder à une substitution par voie orale ou intraveineuse, l’efficacité et la tolérance variant d’un individu à l’autre.
Le fer est l’un des quatre éléments les plus abondants dans la croûte terrestre. C’est un oligo-élément important pour tous les êtres vivants, y compris les humains. Il doit son rôle essentiel en biologie à sa capacité à transporter des électrons et à se lier de manière réversible. Ainsi, dans l’hémoglobine, il est responsable du transport efficace de l’oxygène fortement électronégatif. Pour la même raison, le fer est un élément central de nombreux systèmes enzymatiques qui assurent de nombreuses fonctions biochimiques et physiologiques.
Plus de 1,2 milliard de personnes dans le monde souffrent d’une carence en fer [1]. Celui-ci est l’une des principales causes d’anémie [2]. En Europe, les données recueillies auprès des femmes en âge de procréer indiquent une prévalence de la carence en fer de 10 à 32%, avec une prévalence de l’anémie estimée à 2-5%. Le pourcentage de femmes ayant une faible réserve en fer est estimé à 40-55% [3]. Les prévalences de carence en fer chez les jeunes enfants ont été enregistrées localement et ont montré des valeurs de 4 à 48%. Les jeunes enfants constituent donc un autre groupe à risque de carence en fer [4].
Pourquoi l’un des éléments les plus répandus est-il en même temps responsable d’une importante carence mondiale ? La raison en est la capacité du fer à favoriser la formation de radicaux réactifs toxiques. En outre, le fer est pratiquement insoluble sous forme libre au pH physiologique (c’est-à-dire partout dans le corps sauf dans l’acide gastrique). L’absorption du fer est donc naturellement limitée. Pour être utilisé, il doit être absorbé sous forme liée : associé à des protéines qui peuvent le lier fortement mais de manière réversible.
Métabolisme et absorption du fer
A ce jour, aucun mécanisme actif d’excrétion du fer n’est connu ; l’excrétion rénale n’est pas pertinente pour l’équilibre du fer. L’équilibre du fer humain doit donc être activement régulé lors de l’absorption des aliments dans l’intestin grêle, où les entérocytes jouent un rôle clé.
Le fer dans l’alimentation existe sous deux formes principales : Le fer héminique (dans les produits d’origine animale) et le fer non héminique (dans les produits d’origine animale et non animale). Il est principalement absorbé dans l’intestin grêle, où le pH du contenu intestinal augmente successivement le long d’un gradient jusqu’à atteindre un niveau proche de la neutralité. Le fer non héminique provenant de l’alimentation devient plus insoluble le long de ce gradient, c’est pourquoi l’absorption dans l’intestin distal joue probablement un rôle secondaire. La solubilité du fer dans l’intestin grêle est un facteur important dans l’absorption du fer provenant des aliments et peut être influencée de manière significative par la composition d’un repas.
Au niveau cellulaire, le fer héminique et le fer non héminique sont absorbés par différents transporteurs. Tous deux contribuent à la concentration de fer dans les entérocytes, qui est déterminante pour la régulation cellulaire du fer. Elle a une influence directe sur la conformation des “Iron Response Proteins” (IRPs), qui contrôlent la synthèse des protéines de transport cellulaire. Ainsi, le fer intervient directement dans la synthèse des mécanismes de transport qui l’importent ou l’exportent dans la cellule. Cela est particulièrement important pour le contrôle de l’équilibre systémique du fer dans les entérocytes, les macrophages et les hépatocytes.
Un deuxième composant régulateur à action systémique est l’hormone hepcidine, qui est synthétisée dans le foie. L’hepcidine est régulée par différents signaux : Une érythropoïèse accrue ou une hypoxie entraînent de faibles concentrations, tandis que les stimuli inflammatoires/infectieux (interleukine-6) et le statut du fer de l’organisme (saturation de la transferrine) augmentent la synthèse. L’hepcidine se lie à la ferroportine, le seul exportateur cellulaire de fer connu, ce qui entraîne sa dégradation. Ainsi, le fer reste dans les cellules et ne peut plus passer dans la circulation sanguine, ce qui a un impact sur les IRP et leur cascade de réactions. Comme ce processus est régulé de manière systémique, il concerne tous les types de cellules. Un bilan ferrique équilibré est donc le résultat des processus de tous les bilans ferriques cellulaires individuels et de leur orchestration systémique par l’hepcidine [5]. La découverte de cette hormone dans les années 2000 a considérablement élargi la compréhension de la régulation du fer : une augmentation chronique de l’hepcidine entraîne une anémie prononcée qui ne peut pas être corrigée, ou seulement en partie, par la prise de fer par voie orale ; c’est le cas, par exemple, d’une anémie provoquée par des maladies inflammatoires ou infectieuses chroniques.
Production de fer par recyclage
La quantité de fer chez l’adulte est de ≈4 g et se trouve principalement dans les globules rouges (≈2,8 g). 90% des besoins quotidiens sont couverts par la récupération à partir de vieux globules rouges. Ce cycle de recyclage a lieu entre la moelle osseuse, les globules rouges et les macrophages. Les globules rouges (≈300 mg) sont produits dans la moelle osseuse, les macrophages absorbent les anciens érythrocytes, les décomposent et libèrent le fer dans la circulation sanguine, où il peut à nouveau être utilisé par la moelle osseuse (≈600 mg). Les réserves de fer varient d’une personne à l’autre et se trouvent principalement dans le foie. Le fer à transporter dans la circulation sanguine est lié à la transferrine, qui représente une part dynamique mais faible (3-4 mg) de la teneur totale en fer. Cette fraction est responsable du transport entre les cellules et les tissus et est donc d’une grande importance fonctionnelle.
10 à 20% des besoins quotidiens en fer (1 à 2 mg) doivent être apportés par l’alimentation afin de compenser les pertes quotidiennes naturelles de fer (par exemple en raison de petits saignements, par les muqueuses, etc. La quantité de fer ingérée par jour étant très faible par rapport au contenu du corps, la carence en fer ne peut résulter que d’un déficit prolongé en fer. Les jeunes femmes, les femmes enceintes ou les enfants sont le plus souvent concernés, car les pertes de sang lors des menstruations ainsi que la croissance entraînent une augmentation des besoins en fer.
L’anémie augmente le risque de complications de la grossesse et peut entraîner des naissances prématurées. La carence en fer peut être chronique et asymptomatique. Il se manifeste de manière symptomatique par de la fatigue, un manque de concentration, de l’irritabilité, une diminution de la tolérance au froid, des difficultés respiratoires lors d’activités physiques, le syndrome de Pica et le syndrome des jambes sans repos. Les autres symptômes sont la pâleur de la peau et des conjonctives, la stomatite et la koïlonychie.
Biomarqueurs de la carence en fer
Les mesures biochimiques du statut en fer reflètent la taille relative des différents compartiments et fournissent également des informations sur le statut global en fer de l’organisme. L’étalon-or est la mesure du taux de fer dans la moelle osseuse. Si elle est trop basse, il y a trop peu de fer réutilisé ou recyclé dans la circulation corporelle. ce déficit ne peut pas être compensé par le régime ou le stock hépatique, ce qui entraîne une érythropoïèse réduite et une anémie.
L’augmentation de l’hémoglobine après l’administration de fer chez les patients anémiques est également un signe d’anémie ferriprive.
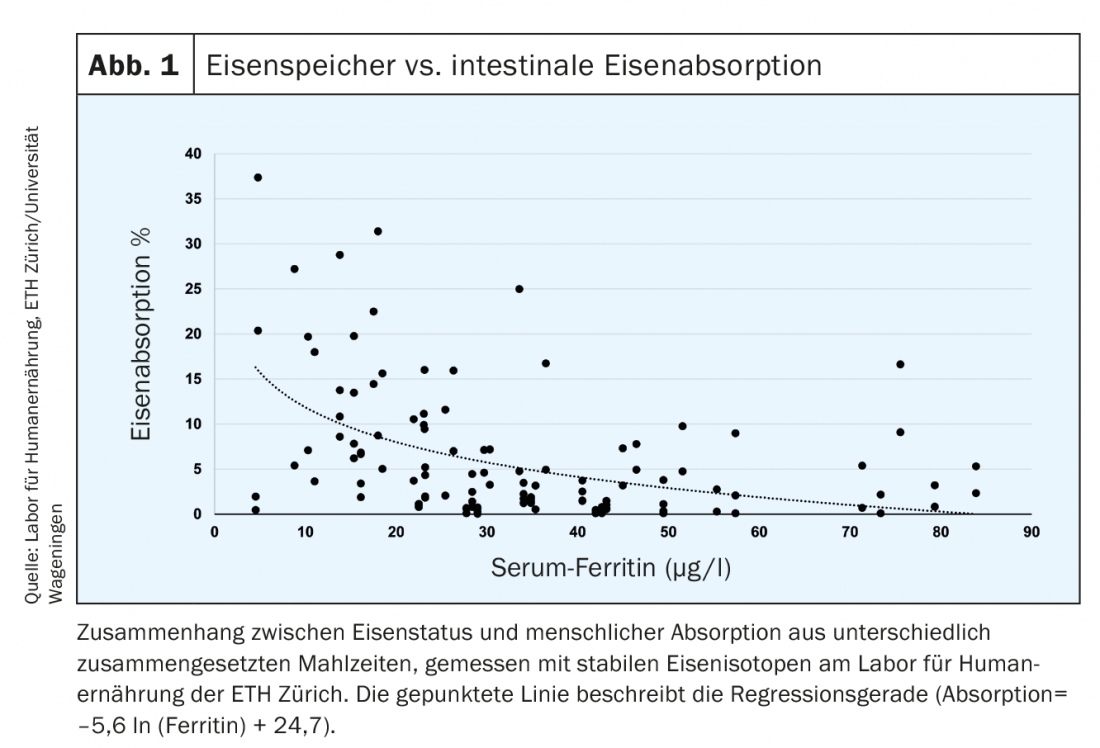
De plus, chez les patients souffrant d’une carence en fer, l’absorption du fer mesurée à l’aide d’isotopes radioactifs ou stables du fer est plus élevée (Fig. 1) [6]. Chez les personnes en bonne santé, les valeurs limites de la ferritine sérique (SF) sont linéairement liées aux réserves de fer. 1 µg/l SF correspond à environ 120 µg de réserves de fer/kg de poids corporel ou à environ 8-10 mg de réserves de fer [7]. Le seuil défini de 15 µg/l indique l’absence de fer détectable dans la moelle osseuse et reflète des réserves vides. Une nouvelle baisse de la valeur en dessous de 15 µg/l n’a donc pas de signification quantitative. Biochimiquement, SF est la molécule de stockage intracellulaire du fer et reflète l’accumulation de ferritine intracellulaire dans les macrophages et les hépatocytes. Chez les patients sains, SF reflète donc les réserves de fer dans le foie. En cas d’érythropoïèse défectueuse (thalassémie), il y a une accumulation de fer intercellulaire dans les macrophages, ce qui entraîne également une augmentation de la ferritine. Pendant une infection ou une inflammation, le taux d’hepcidine augmente. Le fer cellulaire n’est exporté qu’en quantité réduite et doit être stocké au niveau cellulaire (dans des molécules de ferritine). Cela peut entraîner une “fausse” augmentation de la ferritine, ce qui, dans ce cas, n’indique pas une augmentation des réserves de fer.
Chez les patients atteints de maladies infectieuses ou inflammatoires, il convient donc de déterminer un autre marqueur : le récepteur de la transferrine soluble dans le sérum (sTfR), qui est proportionnel aux besoins en fer des cellules. En pratique, cette valeur reflète la “faim” de fer des cellules de la moelle osseuse. Le quotient de la SF et du sTfR s’est avéré très prédictif [8]. Malheureusement, le marqueur très utile sTfR n’est pas bien standardisé ; les différentes méthodes définissent des seuils différents pour la carence en fer.
La saturation de la transferrine est un autre marqueur utile qui représente la disponibilité instantanée du fer systémique et qui est abaissée en cas de carence. Ce marqueur peut donner des indications sur une carence fonctionnelle en fer, en particulier dans le contexte d’une SF élevée due à une infection ou à une inflammation. Pour un aperçu des biomarqueurs établis et expérimentaux pour le fer, voir Lynch et al. [8].
Prévention par une bonne alimentation
La biodisponibilité du fer dans le régime est définie à la fois par sa teneur en fer et sa composition [9]. Des teneurs moyennes à élevées en fer se trouvent dans les légumineuses, la viande, les œufs, les céréales complètes, les aliments fortifiés, les noix et les graines. Le fer héminique est absorbé en quantités accrues (intactes) (20-50%). L’absorption est moins sensible aux inhibiteurs et promoteurs d’absorption du fer et est moins influencée par le statut personnel en fer. En revanche, le fer non héminique est plus sensible à la composition du régime et au statut du fer, d’où une forte variabilité de l’absorption du fer (2 à 50 %). Malgré la faible quantité de fer héminique consommée dans le régime, il représente un pourcentage élevé du fer apporté par l’alimentation, car il est plus biodisponible.
Différents composants définissent l’absorption du fer dans l’intestin grêle, qui est également influencée par la solubilité : La viande musculaire ou l’acide ascorbique (vitamine C) sont des facteurs favorisants. Les céréales et les produits à base de céréales complètes, qui sont en fait riches en fer, contiennent toutefois de l’acide phytique, ce qui réduit le pourcentage d’absorption. Les polyphénols et les tanins du thé et du café ont un effet similaire. L’acide ascorbique présent dans les fruits et les légumes contrecarre cette inhibition. Les combinaisons d’aliments riches en fer et en vitamine C sont particulièrement recommandées (aperçu 1). Un régime varié riche en acide ascorbique, en viande musculaire ou en poisson présente une absorption de 15 à 17% [10].

Supplémentation par voie orale et intraveineuse
Bien que l’optimisation du régime alimentaire puisse être efficace pour la prévention primaire de la carence en fer, en cas de carence en fer avérée, une supplémentation est recommandée afin de corriger rapidement l’anémie, d’annuler la carence en fer dans les tissus et de reconstituer les réserves de fer.
Les suppléments de fer sont efficaces, mais peuvent également provoquer des effets secondaires liés à la dose. Dans une étude sur des patients âgés, 15, 50 ou 150 mg de Fe ont été administrés pendant trois mois. Alors que l’efficacité était similaire à la fin de l’étude, les groupes recevant 50 et 150 mg de Fe ont montré plus d’effets secondaires [11].
Le fer augmente la concentration d’hepcidine pendant plusieurs heures. À des doses ≥60 mg Fe, l’hepcidine augmente de façon dose-dépendante après l’administration d’un supplément de fer et reste élevée jusqu’à 24 heures. Cette augmentation est associée à une diminution de l’absorption d’environ 35%. Pour cette raison, les suppléments de fer peuvent être administrés un jour sur deux pour augmenter l’efficacité de l’absorption tout en maintenant la dose [12]. En outre, il a été démontré qu’un fractionnement du dosage au cours de la même journée (par exemple 2× 60 mg de Fe au lieu de 1× 120 mg de Fe) ne présente aucune valeur ajoutée en termes d’augmentation de l’absorption [13].
Les doses <60 mg Fe ont probablement un effet moindre sur l’hepcidine. En outre, de plus petites doses peuvent non seulement prévenir efficacement la carence en fer, mais elles ont également moins d’effets secondaires [14].
Il convient de noter que la supplémentation orale à petites doses augmente le pourcentage d’absorption, mais diminue la quantité totale de fer absorbée. Le statut du fer doit donc également être pris en compte lors de la recommandation d’une administration alternée de fer. Les effets secondaires possibles doivent être mis en balance avec l’effet à obtenir.
En cas de carence en fer marquée et symptomatique accompagnée d’une anémie, le fer intraveineux est recommandé comme traitement de première intention [1]. Celle-ci est généralement bien tolérée et ne présente que rarement des effets secondaires. Les éventuels effets négatifs sur l’écosystème intestinal, par exemple chez les patients prédisposés, sont contournés. En Suisse, l’utilisation plus fréquente des thérapies intraveineuses a toutefois suscité des critiques, principalement en raison des coûts plus élevés [15]. L’Office fédéral de la santé publique a maintenant lancé un “Health Technology Assessment”.
Le traitement de la carence en fer et de l’anémie ferriprive doit être personnalisé. Le choix du “bon” traitement doit prendre en compte les causes possibles, le degré de carence en fer, les comorbidités, la durée de la carence et les préférences du patient. Outre les raisons cliniques/physiologiques, l’alimentation et le mode de vie (sport, contraception) jouent un rôle important dans la prévention des carences et le maintien d’un statut en fer sain après le traitement.
Messages Take-Home
- Pour prévenir la carence en fer, il convient de recommander un régime varié, riche en fer et présentant une biodisponibilité élevée du fer.
- Dans le cas d’une supplémentation orale, les faibles doses (entre 30 et 60 mg de Fe/jour) sont mieux absorbées en pourcentage et sont très susceptibles de provoquer moins d’effets secondaires.
- Le traitement de supplémentation en fer doit être aussi personnalisé que possible. Il convient de recommander un traitement oral à jours alternés (par exemple, si la carence en fer n’est pas grave : 60 mg/jour, un jour sur deux).
Littérature :
- Camaschella C : Déficience en fer. Blood 2019 ; 133(1) : 30-39.
- Zimmermann MB, Hurrell RF : Carence nutritionnelle en fer. Lancet 2007 ; 370(9586) : 511-520.
- Milman N, et al : Statut en fer chez les femmes enceintes et les femmes en âge de procréer en Europe. Am J Clin Nutr 2017 ; 106(Suppl 6) : 1655S-1662S.
- Van der Merwe LF, Eussen SR : Iron status of young children in Europe. Am J Clin Nutr 2017 ; 106(Suppl 6) : 1663S-1671S.
- Hentze MW, et al : Two to tango : regulation of Mammalian iron metabolism. Cell 2010 ; 142(1) : 24-38.
- Daru J, et al : La ferritine sérique comme indicateur de l’état du fer : que devons-nous savoir ? Am J Clin Nutr 2017 ; 106(Suppl 6) : 1634S-1639S.
- Cook JD : Diagnostic et prise en charge de l’anémie ferriprive. Best Pract Res Clin Haematol 2005 ; 18(2) : 319-332.
- Lynch S, et al : Biomarkers of Nutrition for Development (BOND)-Iron Review. J Nutr 2018 ; 148(Suppl 1) : 1001S-1067S.
- Hurrell R, Egli I : Biodisponibilité du fer et valeurs nutritionnelles de référence. Am J Clin Nutr 2010 ; 91(5) : 1461s-1467s.
- OMS/FAO : Exigences en vitamines et minéraux dans l’alimentation humaine : rapport d’une consultation d’experts conjointe FAO/OMS. Genève : OMS/FAO 2004.
- Rimon E, et al. : Doit-on donner trop de fer ? La thérapie à faible dose de fer est efficace chez les octogénaires. American J Med 2005 ; 118(10) : 1142-1147.
- Moretti D, et al : Les suppléments oraux de fer augmentent l’hepcidine et réduisent l’absorption du fer à partir de doses quotidiennes ou journalières chez les jeunes femmes appauvries en fer. Blood 2015 ; 126(17) : 1981-1989.
- Stoffel NU, et al : Absorption de fer à partir de suppléments oraux de fer donnés sur des jours consécutifs ou alternés et sous forme de doses matinales uniques versus twice-daily split dosing chez les femmes supplémentées en fer : deux essais contrôlés randomisés en open-label. Lancet Haematol 2017 ; 4(11) : e524-e533.
- Bialkowski W, et al : Estimates of total body iron indicate 19 mg and 38 mg oral iron are equivalent for the mitigation of iron deficiency in individuals experiencing repeated phlebotomy. Am J Hematol 2017 ; 92(9) : 851-857.
- Giger M, Achermann R : [Iron substitution in outpatients in Switzerland : Increase of costs associated with intravenous administration]. Z Evid Fortibld Qual Gesundhwes 2013 ; 107(4-5) : 320-326.
PRATIQUE DU MÉDECIN DE FAMILLE 2019 ; 14(2) : 15-18
CARDIOVASC 2020 ; 19(3) : 6-9