Le traitement du cancer du poumon non à petites cellules est individualisé et repose sur le stade de la tumeur, l’histologie et les marqueurs moléculaires prédictifs, en tenant compte du profil du patient. Afin de maximiser le résultat thérapeutique pour chaque patient, la coordination des différentes modalités de traitement par un tumor board est indispensable. Cela vaut pour les situations curatives mais aussi pour les situations palliatives.
Le diagnostic, le staging et le traitement du cancer du poumon non à petites cellules (“non small cell lung cancer”, NSCLC) nécessitent la collaboration de différentes disciplines. Les différentes modalités de traitement doivent être combinées pour obtenir un régime thérapeutique personnalisé. Pour cela, le tumorboard est la plate-forme centrale de coordination. Il serait souhaitable que tous les patients soient présentés et discutés au sein d’un tumor board avant la mise en place d’un traitement curatif ou palliatif, afin de définir un concept thérapeutique individualisé et donc optimal grâce à la coordination des différentes modalités de traitement. Pour cela, il faut prendre en compte les facteurs suivants : le stade, l’histologie, les analyses moléculaires, les comorbidités, la qualité de vie et les souhaits et besoins personnels du patient. Pneumologues, chirurgiens thoraciques, oncologues médicaux, radiothérapeutes, pathologistes, radiologues et médecins nucléaires élaborent une décision commune qui définit le traitement. Une collaboration aussi étroite est également importante au cours de l’évolution d’une maladie, afin de pouvoir proposer à nouveau le meilleur traitement individuel en cas de nouvelle situation pathologique, comme une récidive par exemple.
La discussion du tumor board en cas de nouveau diagnostic de carcinome bronchique non à petites cellules peut être décrite comme suit : Les tumeurs limitées aux poumons sont réséquées en premier lieu. En cas d’atteinte des ganglions lymphatiques médiastinaux et/ou d’infiltration dans les environs, un traitement néo- ou adjuvant doit toujours être discuté. Dans les stades localement avancés, les patients sont traités par des approches multimodales, c’est-à-dire par une chimiothérapie combinée suivie d’une chirurgie ou par une chimiothérapie et une radiothérapie. Pour les cancers du poumon métastatiques, le traitement est déterminé en fonction de l’histologie et des caractéristiques moléculaires.
Staging par PET-CT
Évaluation des ganglions lymphatiques médiastinaux : Dans les stades précoces de la tumeur, il faut exiger un diagnostic des ganglions lymphatiques du médiastin avec une sensibilité et une spécificité élevées, car son résultat a une grande pertinence pour la suite des opérations. L’importance clinique du PET-CT pour le staging des ganglions lymphatiques réside dans sa valeur prédictive négative élevée. Si le PET-CT est négatif, il n’est pas nécessaire de procéder à un autre diagnostic invasif des ganglions lymphatiques.
En revanche, la valeur prédictive positive est plus faible. Les ganglions médiastinaux positifs au PET doivent donc être évalués plus avant. Pour cela, des techniques peu invasives sont aujourd’hui utilisées en premier lieu par des ponctions bronchoscopiques (sonographie endobronchique [EBUS], endosonographie [EUS]), ou si nécessaire une médiastinoscopie.
Manifestations extrathoraciques : Un autre point fort du PET-CT est la possibilité de détecter des métastases extrathoraciques. Pour un staging adéquat du SNC, une IRM du crâne doit être réalisée en cas de suspicion clinique ou de métastases ganglionnaires médiastinales avérées [1].
Traitement des stades précoces
Les cancers bronchiques non à petites cellules limités au poumon et sans métastases extrathoraciques peuvent être traités par résection chirurgicale à visée curative. La survie médiane après chirurgie est de 46 mois – contre 14 mois seulement sans traitement – mais elle dépend essentiellement de la taille initiale de la tumeur et de l’atteinte des ganglions lymphatiques. Le critère le plus important pour un bon résultat de traitement est l’expérience de l’équipe traitante. Il a également été démontré que les centres pratiquant de nombreuses opérations (>150 par an) pouvaient obtenir une meilleure survie globale que ceux pratiquant moins de cas (<70 par an) [2].
Dans les stades I et II, une lobectomie incluant une lymphadénectomie médiastinale est envisagée. La mortalité à 30 jours après lobectomie est faible (1%) et n’augmente pas, même chez les patients âgés présentant des comorbidités, si la sélection est rigoureuse. L’opération peut être réalisée de manière peu invasive par thoracoscopie.
Les pneumonectomies ne sont aujourd’hui nécessaires que dans des cas exceptionnels, mais peuvent avoir une place dans une approche curative globale [3]. Il est possible de les éviter en pratiquant une résection sélective des bronches ou des artères atteintes à la manière d’une manchette et en réanastomosant le tissu pulmonaire restant (résection de la manchette, “sleeve resection”). Ces résections sont de plus en plus fréquentes. Exemple : dans le cas d’un cancer du lobe supérieur central, après sa résection, les lobes moyen et inférieur restants sont réanastomosés à la bronche principale.
D’autres interventions visant à économiser les tissus pulmonaires, telles que les segmentectomies, ne sont recommandées que pour les petites tumeurs périphériques (<2 cm) sans métastases ganglionnaires (N0) [4].
La lobectomie mini-invasive (thoracoscopique) est une technique chirurgicale envisageable en cas de cancer bronchique localisé et est utilisée dans des centres spécialisés à des stades plus précoces. Les patients ayant subi une lobectomie thoracoscopique ont une survie à 5 ans comparable à (ou, dans certaines études, supérieure à) celle des patients ayant subi une lobectomie ouverte [5]. De plus, la chimiothérapie adjuvante est plus tôt et mieux supportée.
Chez les patients présentant de petites tumeurs et des comorbidités importantes, une radiothérapie à visée curative doit être envisagée, avec un diagnostic de valeur intrinsèque préalable dans la mesure du possible. Le prélèvement de tissus est notamment important pour pouvoir proposer ultérieurement un autre traitement optimal sur la base des caractéristiques moléculaires de la tumeur. La radiothérapie stéréotaxique (SBRT) ainsi que les techniques de haute précision (par ex. Gamma Knife®, LINAC) sont utilisées ici, ce qui permet un bon contrôle local de la tumeur avec une toxicité limitée des rayons [6].
Traitement des stades localement avancés avec intention curative
Chez les patients atteints de tumeurs de stade IIIA (N2), définies par la présence de métastases des ganglions lymphatiques médiastinaux ipsilatéraux, un concept multimodal et curatif peut être élaboré si le patient est en bon état général.
Une chimiothérapie néoadjuvante peut être recommandée dans le sens d’une chimiothérapie d’induction si la situation est jugée potentiellement opérable. Comme la chimiothérapie est un élément important du concept thérapeutique dans cette situation, l’administration néoadjuvante garantit que le traitement systémique peut être administré sans réduction de dose et avec une bonne tolérance [7, 8].
Chez les patients présentant des tumeurs primaires non opérables, une radiochimiothérapie définitive peut être recommandée, avec une radiothérapie/chimiothérapie concomitante chez les patients en bon état général [9].
Actuellement, une étude menée en Suisse vise à déterminer si, en situation très avancée et non métastatique (IIIB), l’ajout d’une radiothérapie préopératoire associée au cetuximab à la chimiothérapie présente un avantage (SAKK 16/08).
Traitement adjuvant après chirurgie
Chez les patients ayant subi une résection complète d’un cancer bronchique non à petites cellules de stade II et III, quatre cycles de chimiothérapie combinée adjuvante à base de cisplatine sont aujourd’hui considérés comme le traitement standard. Sur la base d’analyses rétrospectives (CALGB 9633), un traitement adjuvant peut également être recommandé au stade IB et lorsque la taille de la tumeur est supérieure à 4 cm.
Chez les patients ayant subi une résection complète de la tumeur au stade IB-IIB, trois grandes études randomisées démontrent aujourd’hui une augmentation significative du taux de survie grâce aux chimiothérapies combinées adjuvantes à base de platine [10–12].
La radiothérapie post-opératoire (PORT) reste controversée. Là encore, des études sont en cours pour mieux décrire l’importance de ce poste. Par exemple, l’étude LungART teste PORT pour les patients présentant une atteinte N2 après résection complète (Abstract 7658, ASCO 2007).
Cependant, seule une partie des personnes traitées bénéficie d’un traitement adjuvant. La question se pose donc de savoir quelles sont les caractéristiques biologiques qui pourraient permettre d’identifier ces patients à l’avance. Des recherches sont en cours pour déterminer dans quelle mesure les signatures d’expression génique permettent d’identifier des sous-groupes au pronostic différent et si cela permet de cibler les thérapies adjuvantes sur les patients au pronostic défavorable (CALGB-30506). Une autre approche consiste à utiliser des études pharmacogénomiques pour tenter de prédire la capacité de certains agents chimiothérapeutiques à influencer la tumeur. Cependant, aucun marqueur prédictif n’a pu être caractérisé jusqu’à présent.
Traitement palliatif basé sur l’histologie et la biologie moléculaire
Les stratégies thérapeutiques en matière de soins palliatifs ont évolué au cours des dernières années. Les nouvelles stratégies sont basées sur la pertinence “redécouverte” de la morphologie différenciée et sur de nouvelles découvertes moléculaires. Le terme générique de “cancer bronchique non à petites cellules” ne suffit plus pour décider du traitement. Le terme de “non-petite cellule” regroupe des entités extrêmement hétérogènes sur le plan histologique et moléculaire. Il ne répond plus aux besoins du choix moderne des médicaments, adapté à la morphologie et à la biologie moléculaire de chacun.
Dans la pratique quotidienne de l’oncologie, une thérapie ciblée selon l’histologie exacte et, pour les adénocarcinomes, le statut de mutation du récepteur du facteur de croissance épidermique (EGFR) et le statut de translocation de l’ALK (“anaplastic lymphoma kinase”) (EML4-ALK positif) a été introduite. Dans ce cas, les inhibiteurs de tyrosine kinase (ITK) peuvent être utilisés avec un bénéfice thérapeutique.
Décisif : le statut mutationnel des cellules tumorales
Aujourd’hui, les cancers bronchiques non à petites cellules doivent être testés pour déterminer leur statut mutationnel avant d’entamer un traitement palliatif. Tous les cancers du poumon non épidermoïdes doivent être classés en fonction de la présence ou non de mutations de l’EGFR. Les mutations peuvent entraîner l’activation de la tyrosine kinase intracellulaire de l’EGFR, ce qui donne aux cellules tumorales un signal de croissance permanent. On parle alors de mutation activatrice. Ces mutations sont le plus souvent présentes chez les non-fumeurs [13]. Les mutations les plus pertinentes de l’EGFR sont une délétion dans l’exon 19 et les mutations ponctuelles L858R (exon 21) et G719X (exon 18). Mais il existe aussi des mutations, comme la T790M (exon 20), qui confèrent une résistance au traitement par ITK. Les médicaments utilisés peuvent être le gefitinib et l’erlotinib, qui inhibent la tyrosine kinase de l’EGFR [14]. L’afatinib est déjà autorisé en deuxième ligne aux États-Unis et dans l’UE. En plus du récepteur du facteur de croissance épidermique (EGFR/ErbB1), l’afatinib bloque le récepteur du facteur de croissance épidermique humain 2 (HER2/ErbB2) et ErbB4. Chez les patients présentant une mutation activatrice connue de l’EGFR, l’inhibiteur de tyrosine kinase doit être utilisé en première ligne.
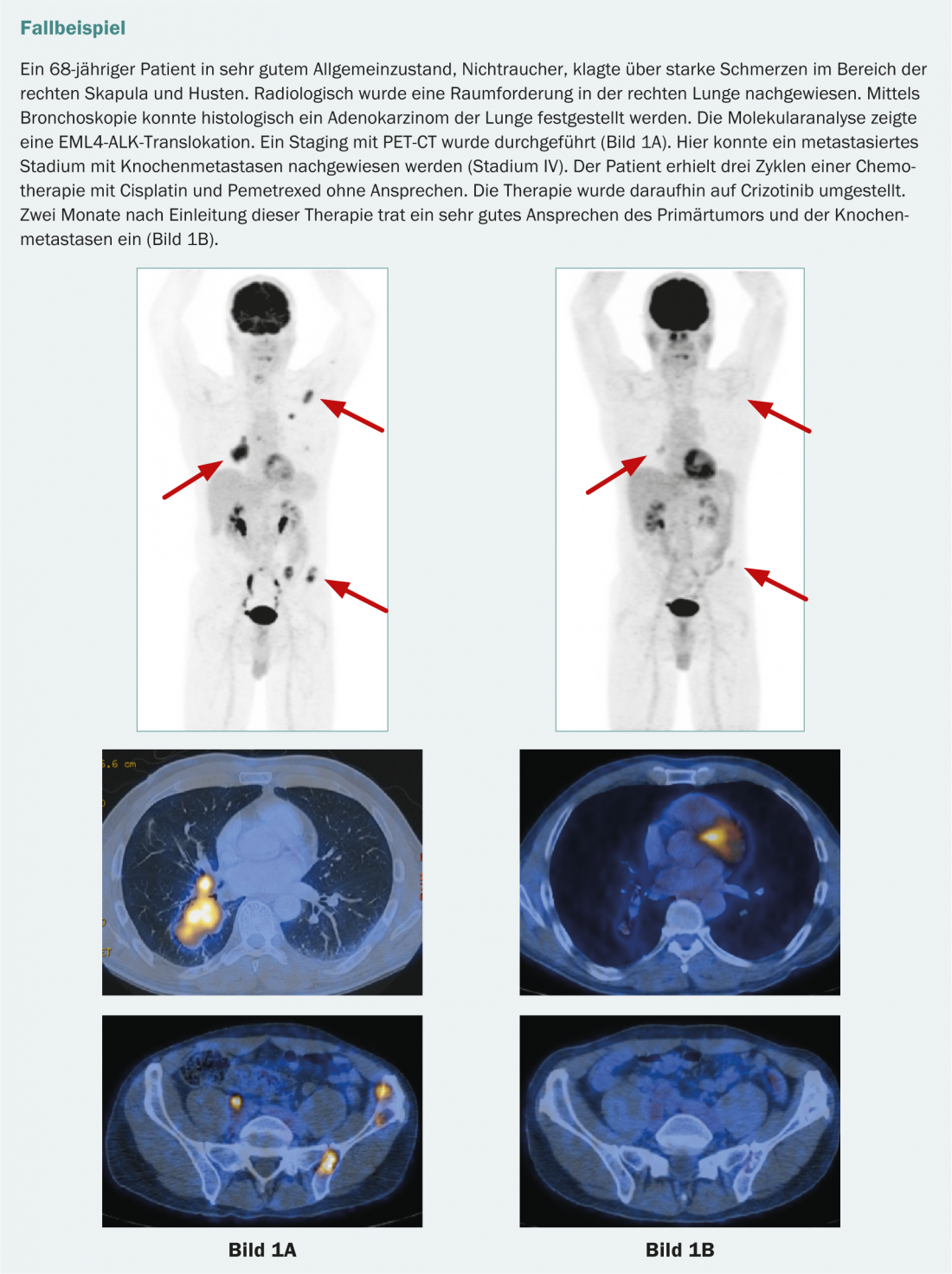
De même, dans l’adénocarcinome du poumon, il peut y avoir une protéine de fusion pathologique composée de la “anaplastic lymphoma kinase” (ALK) et de la “Echinoderm Micro-tubule-associated Protein-like 4” (EML4). Celui-ci entraîne également un signal de croissance incontrôlé dans les cellules tumorales. Cette mutation est beaucoup moins fréquente (environ 4 à 7%). Elle affecte principalement les non-fumeurs et ne se produit presque jamais en combinaison avec d’autres mutations [15]. Les patients présentant un EML4-ALK positif bénéficient d’un traitement par crizotinib. Actuellement, le crizotinib est autorisé en Suisse comme traitement de deuxième ligne chez les patients présentant une translocation ALK.
D’autres mutations rares pour lesquelles il existe des inhibiteurs potentiels de la tyrosine kinase concernent le récepteur EGF-2 (HER2) et BRAF. On observe également des mutations de l’oncogène KRAS (transversion G en T) presque exclusivement dans les adénocarcinomes des fumeurs. La présence d’une mutation KRAS est corrélée à un pronostic globalement moins bon. Mais pour l’instant, aucune conséquence thérapeutique ne peut être tirée de cette mutation [16].
L’histologie guide la chimiothérapie
La classification histologique de l’adénocarcinome du poumon a été renouvelée, remplaçant ainsi le terme mal défini de “carcinome broncho-alvéolaire (BAC)”. Pour les petites lésions pré-invasives, on parle désormais d'”adénocarcinome in situ”. Pour les lésions invasives >5 cm, on parle de “carcinome lépidique”. Les carcinomes entre 3 et 5 cm sont considérés comme “peu invasifs” [17].
En outre, la chimiothérapie combinée à base de platine – avec des substances telles que la vinorelbine, la gemcitabine, le pemetrexed et le paclitaxel – doit être considérée comme le traitement standard ou de première ligne du cancer bronchique avancé [18].
Malgré de gros efforts, il n’a pas été possible jusqu’à présent de définir des marqueurs prédictifs fiables pour les médicaments de chimiothérapie 19, 20].
Le pemetrexed est autorisé dans le traitement des carcinomes épidermoïdes non Le pemetrexed est un nouveau représentant de la famille des antagonistes de l’acide folique. En 2008, une étude randomisée a montré que les patients présentant une histologie non épidermoïde tiraient un meilleur bénéfice d’un traitement combiné par pemetrexed et cisplatine par rapport à la combinaison gemcitabine/cisplatine. Le profil d’effets secondaires de la nouvelle combinaison s’est également révélé supérieur en termes de toxicité hématologique et de neutropénie fébrile [21].
Le bevacizumab est un anticorps monoclonal dirigé contre le “vascular endothelial growth factor” (VEGF). Le bevacizumab est autorisé en Suisse en association avec la chimiothérapie pour le traitement du cancer bronchique non à petites cellules en cas d’histologie non épidermoïde. Deux études randomisées ont servi de base à cet égard : d’une part, l’ajout de bevacizumab à la combinaison carboplatine/paclitaxel a amélioré la réponse tumorale et prolongé la survie médiane de 12,3 mois – c’est-à-dire plus que la chimiothérapie seule (10,3 mois) [22]. D’autre part, le bevacizumab a obtenu une réponse tumorale significativement plus élevée en association avec le cisplatine/gemcitabine [23]. Cependant, cela n’a pas conduit à une augmentation de la survie globale [24].
Thérapie d’entretien
Le traitement du cancer bronchique non à petites cellules avancé consistait généralement en quatre (jusqu’à six au maximum) cycles de chimiothérapie à base de platine. Les résultats de nouveaux essais randomisés ont montré pour la première fois que, dans certaines situations, la poursuite du traitement avec un traitement d’entretien ultérieur peut prolonger la survie. On distingue deux formes de traitement d’entretien (tableau 1). Pour l’entretien de continuation, des données sont disponibles pour la gemcitabine [25] et le pemetrexed plus bevacizumab [26], qui ont montré un avantage en termes de survie sans progression. Le switch maintenance a été testé positivement pour le pemetrexed [27], le docétaxel [28], l’erlotinib [25] et le gefitinib [29].

Chirurgie des métastases
Dans le cas du cancer bronchique non à petites cellules métastasé, c’est-à-dire au stade IV, la chirurgie n’a qu’un rôle limité et relève toujours d’une décision au cas par cas. En cas de métastase cérébrale unique d’un cancer bronchique opérable, une résection neurochirurgicale est pratiquée dans les cas appropriés. Celle-ci est suivie d’une irradiation du cerveau entier et d’une résection chirurgicale de la tumeur primaire s’il n’y a pas d’autres métastases ailleurs. En cas de résection radicale, cette procédure permet d’atteindre un taux de survie à 5 ans d’environ 40%.
Dans des situations particulières de métastases d’organes isolées, en particulier les métastases surrénaliennes, une résection chirurgicale à visée curative a également été évaluée [30]. De telles interventions sont généralement associées à une thérapie systémique adjuvante ou néo-adjuvante.
CONCLUSION POUR LA PRATIQUE
- Un staging précis, un diagnostic histologique et une analyse moléculaire sont la clé d’un traitement individualisé et donc d’un résultat thérapeutique optimisé.
- Le terme “cancer bronchique non à petites cellules” englobe de nombreuses entités différentes sur le plan morphologique et moléculaire, qui devraient être décrites avec précision dans un seul diagnostic.
- Aujourd’hui, une différenciation histologique précise et le statut de la mutation permettent d’individualiser un traitement palliatif de première ligne. Après quatre cycles de traitement de première ligne à base de platine, un traitement d’entretien améliore la survie sans progression et peut se traduire par une amélioration de la survie globale. Dans ce cas, ce sont surtout les patients dont la maladie est stabilisée et dont l’état général est bon qui semblent en bénéficier.
- Dans le cas du cancer bronchique localisé, les lobectomies mini-invasives (thoracoscopiques) sont aujourd’hui privilégiées. Pour les tumeurs situées au centre, on opte de plus en plus souvent pour une résection manchette/sleeve préservant les tissus pulmonaires.
- La chimiothérapie combinée adjuvante à base de cisplatine fait aujourd’hui partie intégrante du traitement après la résection des tumeurs de stade IB (>4 cm), II et IIIA.
PD Dr. med. Ulf Petrausch
Dr. med. Alessandra Curioni-Fontecedro
Littérature :
- Silvestri GA, et al : Methods for staging non-small cell lung cancer : Diagnosis and management of lung cancer, 3rd ed : American College of Chest Physicians evidence-based clinical practice guidelines. Chest 2013 ; 143(5 Suppl) : e211S-50S.
- Luchtenborg M, et al : Un volume de procédure élevé est fortement associé à une amélioration de la survie après une chirurgie du cancer du poumon. J Clin Oncol 2013 ; 31(25) : 3141-3146.
- Riquet M, et al : A review of 250 ten-year survivors after pneumonectomy for non-small-cell lung cancer. European journal of cardio-thoracic surgery : journal officiel de l’Association européenne de chirurgie cardio-thoracique 2013.
- Yendamuri S, et al : Temporal trends in outcomes following sublobar and lobar resections for small (≤2 cm) non-small cell lung cancers – a Surveillance Epidemiology End Results database analysis. The Journal of surgical research 2013 ; 183(1) : 27-32.
- Lee PC, et al : Long-term survival after lobectomy for non-small cell lung cancer by video-assisted thoracic surgery versus thoracotomy. The Annals of thoracic surgery 2013 ; 96(3) : 951-960 ; discussion 960-961.
- Powell JW, et al : Treatment advances for medically inoperable non-small-cell lung cancer : emphasis on prospective trials. The lancet oncology 2009 ; 10(9) : 885-894.
- Scagliotti GV, et al : Étude randomisée de phase III de la chirurgie seule ou de la chirurgie plus cisplatine préopératoire et gemcitabine dans les stades IB à IIIA du cancer du poumon non à petites cellules. J Clin Oncol 2012 ; 30(2) : 172-178.
- Strauss GM : Chimiothérapie d’induction et chirurgie pour le cancer du poumon non à petites cellules au stade précoce : que nous ont appris les essais randomisés ? J Clin Oncol 2012 ; 30(2) : 128-131.
- Auperin A, et al : Meta-analysis of concomitant versus sequential radiochemotherapy in locally advanced non-small-cell lung cancer. J Clin Oncol 2010 ; 28(13) : 2181-2190.
- 10. Winton TL, et al : A prospective randomised trial of adjuvant vinorelbine (VIN) and cisplatin (CIS) in completely resected stage 1B and II non small cell lung cancer (NSCLC) Intergroup JBR.10. J Clin Oncol 2004 ; 22(14) : 621s-621s.
- 11. Le Chevalier T, et al : Chimiothérapie adjuvante à base de cisplatine chez les patients atteints de cancer du poumon non à petites cellules entièrement réséqué. NEJM 2004 ; 350(4) : 351-360.
- Pignon JP, et al : Lung adjuvant cisplatin evaluation : a pooled analysis by the LACE Collaborative Group. J Clin Oncol 2008 ; 26(21) : 3552-3559.
- Rosell R, et al : Screening for epidermal growth factor receptor mutations in lung cancer. The New England journal of medicine 2009 ; 361(10) : 958-967.
- Rosell R, Bivona TG, Karachaliou N : Génétique et biomarqueurs dans la personnalisation du traitement du cancer du poumon. Lancet 2013 ; 382(9893) : 720-731.
- Shaw AT, et al : Caractéristiques cliniques et résultats des patients atteints de cancer du poumon non à petites cellules qui hébergent EML4-ALK. J Clin Oncol 2009 ; 27(26) : 4247-4253.
- Roberts PJ, Stinchcombe TE : KRAS Mutation : Should We Test for It, and Does It Matter ? J Clin Oncol 2013 ; 31(8) : 1112-1121.
- Travis WD, Brambilla E, Riely GJ : New pathologic classification of lung cancer : relevant for clinical practice and clinical trials. J Clin Oncol 2013 ; 31(8) : 992-1001.
- Schiller JH, et al : Comparaison de quatre régimes de chimiothérapie pour le cancer du poumon non à petites cellules en phase avancée. NEJM 2002 ; 346(2) : 92-98.
- Cobo M, et al : Customizing cisplatin based on quantitative excision repair cross-complementing 1 mRNA expression : a phase III in non-small-cell lung cancer. J Clin Oncol 2007 ; 25(19) : 2747-2754.
- Bepler G, et al : Randomized international phase III trial of ERCC1 and RRM1 expression-based chemotherapy versus gemcitabine/carboplatin in advanced non-small-cell lung cancer. J Clin Oncol 2013 ; 31(19) : 2404-2412.
- Scagliotti GV,et al : Étude de phase III comparant le cisplatine plus gemcitabine au cisplatine plus pemetrexed chez des patients naïfs de chimiothérapie atteints de cancer du poumon non à petites cellules en phase avancée. J Clin Oncol 2008 ; 26(21) : 3543-3551.
- Sandler A, et al : Paclitaxel-carboplatine seul ou avec bevacizumab pour le cancer du poumon non à petites cellules. NEJM 2006 ; 355(24) : 2542-2550.
- Reck M, et al : Phase III trial of cisplatin plus gemcitabine with either placebo or bevacizumab as first-line therapy for nonsquamous non-small-cell lung cancer : AVAil. J Clin Oncol 2009 ; 27(8) : 1227-1234.
- Reck M, et al : Overall survival with cisplatin-gemcitabine and bevacizumab or placebo as first-line therapy for nonsquamous non-small-cell lung cancer : results from a randomised phase III trial (AVAiL). Annals of oncology : official journal of the European Society for Medical Oncology/ESMO 2010 ; 21(9) : 1804-1809.
- Perol M, et al : Étude randomisée de phase III du traitement de maintenance par gemcitabine ou erlotinib versus observation, avec traitement de deuxième ligne prédéfini, après chimiothérapie d’induction par cisplatine et gemcitabine dans le cancer du poumon non à petites cellules en phase avancée. J Clin Oncol 2012 ; 30(28) : 3516-3524.
- Barlesi F, et al : Essai randomisé de phase III du bevacizumab d’entretien avec ou sans pemetrexed après une première ligne d’induction avec bevacizumab, cisplatine, et pemetrexed dans le cancer du poumon non à petites cellules en progression : AVAPERL (MO22089). J Clin Oncol 2013 ; 31(24) : 3004-3011.
- Belani CP, et al : Quality of life in patients with advanced non-small-cell lung cancer given maintenance treatment with pemetrexed versus placebo (H3E-MC-JMEN) : results from a randomised, double-blind, phase 3 study. Lancet Oncology 2012 ; 13(3) : 292-299.
- Fidias PM, et al : Étude de phase III du docétaxel immédiat comparé au docétaxel différé après le traitement de première ligne par gemcitabine plus carboplatine dans le cancer du poumon avancé à cellules non petites. J Clin Oncol 2009 ; 27(4) : 591-598.
- Zhang L, et al : Gefitinib versus placebo en tant que traitement d’entretien chez les patients atteints de cancer du poumon non à petites cellules localement avancé ou métastatique (INFORM ; C-TONG 0804) : une phase 3 randomisée, multicentrique et en double aveugle. Lancet Oncology 2012 ; 13(5) : 466-475.
- Salah S, Tanvetyanon T, Abbasi S : Métastasectomie pour métastases solitaires de cancer du poumon non à petites cellules extra-crâniennes : revue systématique et analyse des cas rapportés. Lung Cancer-J Iaslc 2012 ; 75(1) : 9-14.
InFo Oncologie & Hématologie 2013 ; 1(1) : 16-21











