Bien que la genèse de la polyarthrite rhumatoïde (PR) reste en grande partie inconnue, on sait aujourd’hui qu’elle est due à des facteurs environnementaux. Cependant, l’introduction des nouveaux médicaments biologiques, après des décennies de recherche en immunologie, a enfin permis de développer de nouvelles stratégies de traitement révolutionnaires pour cette maladie qui n’était jusqu’à présent qu’incomplètement traitée.
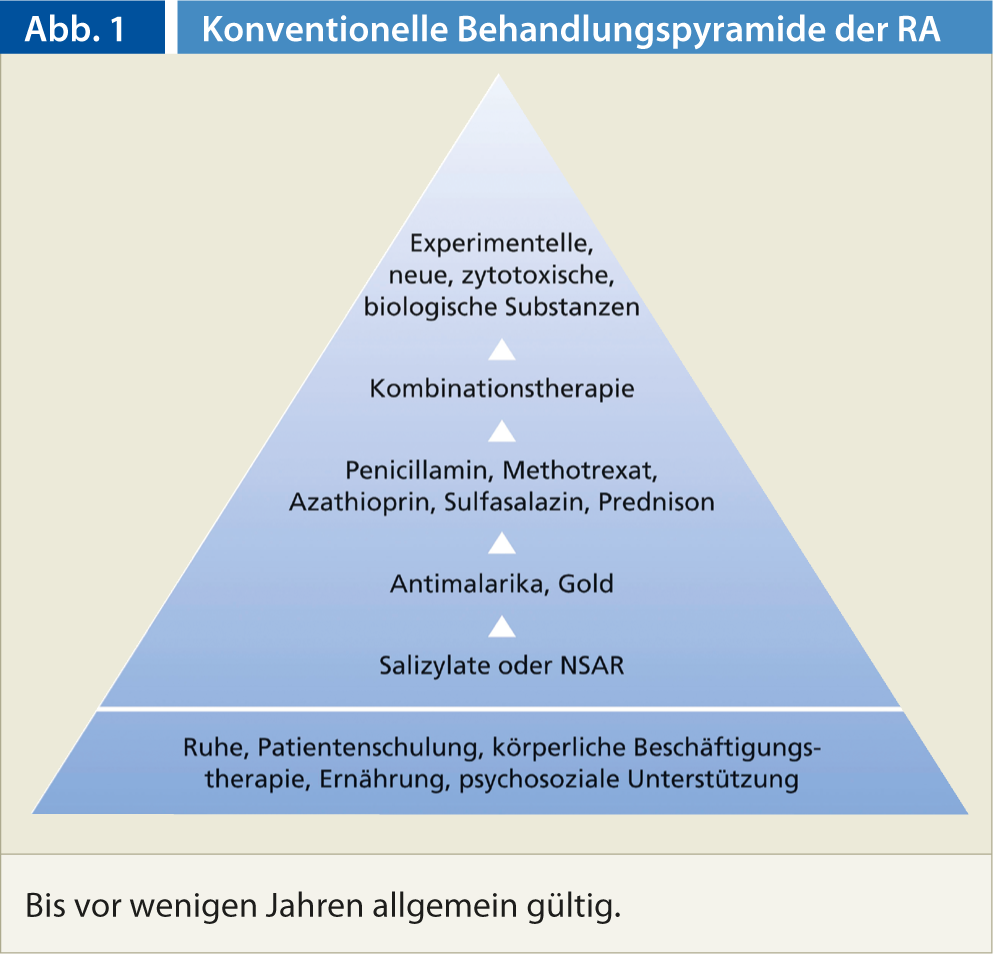
Jusqu’à présent, le traitement médicamenteux de la polyarthrite rhumatoïde était basé sur la pyramide de traitement conventionnelle (figure 1). Le modèle pyramidal se base d’une part sur le concept risque/bénéfice et d’autre part sur l’hypothèse que le pronostic de la PR est généralement favorable. Aujourd’hui, la pyramide des traitements a été modifiée de telle sorte que le traitement par les médicaments de base modifiant la maladie (“Disease-Modifying Antirheumatic Drugs”, DMARD) et les produits biologiques commence beaucoup plus tôt.
Les raisons en sont multiples : d’une part, la polyarthrite rhumatoïde n’est pas une maladie bénigne. De plus, les anti-inflammatoires non stéroïdiens (AINS) ne sont pas inoffensifs, leur toxicité gastro-intestinale et d’autres effets secondaires entraînent une morbidité et une mortalité considérables. Il faut également tenir compte du fait que les traitements de fond ne sont pas plus toxiques que les AINS entre des mains expertes. Last but not least, l’utilisation précoce de médicaments biologiques permet de s’attaquer aux formes agressives de polyarthrite rhumatoïde à un stade précoce, d’influer considérablement sur la maladie et même, dans certains cas, de la mettre en rémission.
Thérapeutiques de base modifiant la maladie (DMARD)
Les “Disease-Modifying Antirheumatic Drugs” (DMARD)(tableau 1) sont utilisés en cas de polyarthrite cliniquement et humoralement active, bien avant l’apparition de modifications biologiques. Ceci en particulier dès que le diagnostic de polyarthrite rhumatoïde est confirmé. Actuellement, le méthotrexate est le traitement de base de premier choix, qui a complètement remplacé l’or, autrefois utilisé en premier lieu. Entre des mains expertes, le méthotrexate n’est pas plus toxique que les AINS ou les corticostéroïdes. Un autre avantage de ce médicament est son large éventail d’administration (per os, i.v., i.m., s.c., en seringue prête à l’emploi pour l’auto-injection).
Les produits biologiques actuels
Pour un aperçu des médicaments biologiques, voir Tableau 2.
inhibiteurs du TNF-α (fig. 2, 3) : En 1998, un premier antagoniste du facteur de nécrose tumorale α (inhibiteur du TNF-α) a été enregistré comme médicament. Actuellement, les substances actives disponibles sont l’étanercept (Enbrel®), l’infliximab (Remicade®) ainsi que l’adalimumab (Humira®) et, depuis 2010, le golimumab (Simponi®) et le certolizumab (Cimzia®). Ils se distinguent d’une part par leur durée d’action et d’autre part par leur mode d’administration (s.c. hebdomadaire, s.c. bihebdomadaire, s.c. quadrihebdomadaire et perfusion i.v. bi- ou tri-mensuelle).
Les inhibiteurs du TNF-α réduisent à la fois le gonflement et la douleur des articulations jusqu’à >50% et réduisent les paramètres de l’inflammation. On pense que ces agents peuvent également inhiber la progression des modifications radiologiques, mais pas les empêcher complètement. Les inhibiteurs du TNF-α sont particulièrement efficaces en association avec le méthotrexate. Ils sont utilisés après une réponse insuffisante (3-6 mois) ou des effets secondaires du traitement DMARD. La prescription doit être approuvée par le médecin-conseil de l’assureur-maladie.
Les contre-indications sont les infections florissantes ou latentes (VIH, hépatite, tuberculose) ainsi que les tumeurs malignes ou un traitement récent contre les tumeurs malignes. Avant d’entamer un traitement, il est donc nécessaire de rechercher, ou plutôt d’identifier, les personnes qui ont besoin d’un traitement. l’exclusion des infections latentes est nécessaire. Le certolizumab (Cimzia®), nouvel inhibiteur du TNF-α, peut même être utilisé pendant la grossesse.
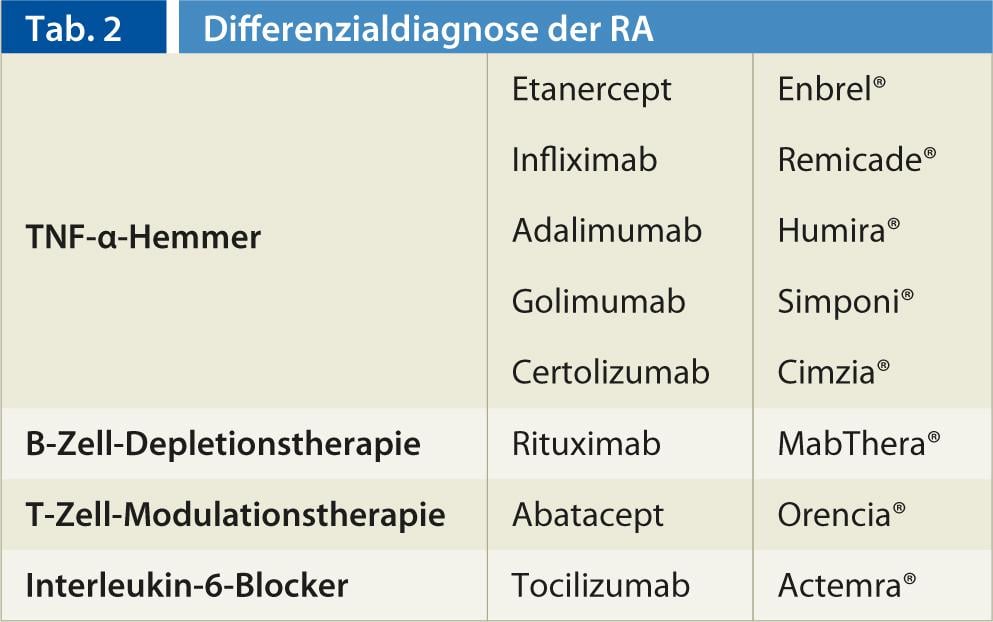
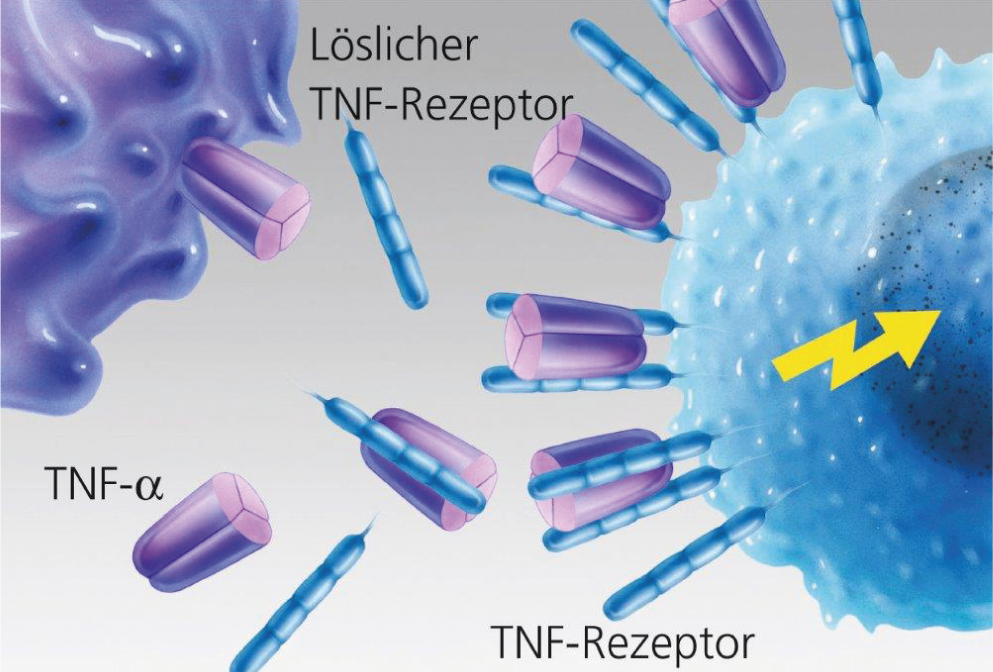
Fig. 2 : liaison non entravée du TNF-α à la cellule cible
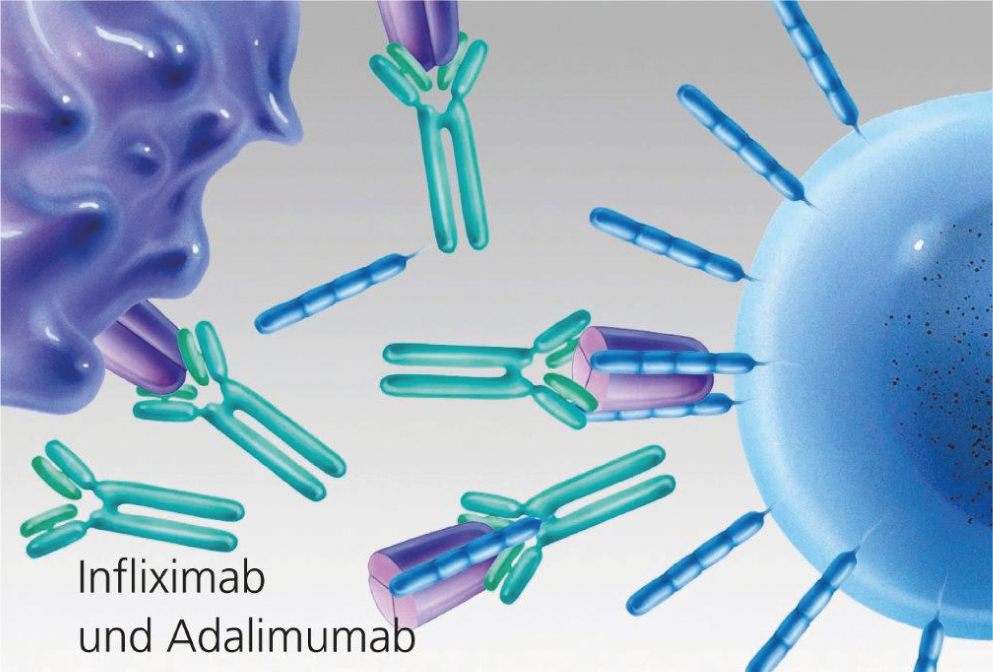
Fig. 3 : Blocage du TNF par des anticorps monoclonaux (infliximab et adalimumab).
Traitement par déplétion des cellules B : l’introduction en 2006 du rituximab (MabThera®), un anticorps monoclonal hautement spécifique dirigé contre les cellules B, dans le traitement des rhumatismes a apporté une nouvelle perspective à la gamme Biological. Le rituximab est un anticorps monoclonal chimérique murin/humain qui se lie spécifiquement à l’antigène transmembranaire CD20, présent en grand nombre à la surface des cellules B. Le rituximab est un anticorps monoclonal chimérique murin/humain qui se lie spécifiquement à l’antigène transmembranaire CD20. Le rituximab est utilisé depuis 1997 dans le traitement des lymphomes non hodgkiniens. L’avantage du rituximab par rapport au traitement par TNF-α est qu’on n’observe pas une augmentation des infections opportunistes ou autres. Le rituximab est administré en perfusion (2 perfusions à 14 jours d’intervalle), le traitement peut être répété à des intervalles de six à douze mois. Toutefois, l’effet maximal n’apparaît qu’après quelques semaines ou mois.
Thérapie de modulation cellulaire : une autre thérapie biologique est disponible avec le modulateur des cellules T, l’abatacept (Orencia®). L’abatacept est une protéine de fusion entièrement humaine qui lie les molécules co-modulatrices CD-80 et CD-86 aux lymphocytes T, les empêchant ainsi d’être activés. Il est donc appelé bloqueur de la co-stimulation des cellules T. L’abatacept est autorisé en Suisse sous forme de traitement par perfusion mensuelle depuis août 2007 et, depuis avril 2012, également sous forme d’application sous-cutanée (seringue prête à l’emploi hebdomadaire). Un ralentissement de l’activité de la maladie ainsi que de la progression radiologique est suspecté. En général, l’abatacept semble présenter un profil d’effets secondaires favorable, les réactions à la perfusion et les infections opportunistes sont rares, mais les données actuelles ne permettent pas de se prononcer clairement sur le risque de malignité. Un petit inconvénient est peut-être que les effets ne se manifestent qu’avec une certaine latence (3 à 6 mois), mais qu’ils durent ensuite très longtemps et ne diminuent pas ou peu par la suite.
Bloqueurs de l’interleukine-6 : l’interleukine-6 (IL-6) est une cytokine clé dans le processus inflammatoire et est spécifiquement présente dans les tissus de la synovite rhumatismale, parallèlement à l’activité inflammatoire. L’anticorps monoclonal tocilizumab (Actemra®) se lie aux récepteurs solubles et membranaires de l’IL-6 et inactive l’IL-6, qui ne peut plus exercer d’effet pro-inflammatoire sur la cellule. Le tocilizumab est autorisé en Suisse depuis 2009. Le tocilizumab est administré en perfusions mensuelles. Un grand avantage est le début très rapide et convaincant de l’effet.
L’expérience acquise jusqu’à présent avec les produits biologiques
Depuis 1998, de plus en plus de patients atteints d’arthrite sont traités par les nouveaux produits biologiques en Europe et en Suisse, notamment par les inhibiteurs du TNF-α, qui sont utilisés de plus en plus tôt dans le traitement de la PR. Une supervision de ces thérapeutiques par des spécialistes expérimentés est nécessaire pour identifier et traiter les effets secondaires à temps. Pourtant, les infections graves non maîtrisables restent les effets secondaires les plus redoutés de ce groupe de médicaments. Les effets secondaires légers sont la douleur et la sensation de brûlure au site d’injection, une transpiration accrue, des variations de la pression artérielle.
Dans le cas du traitement par inhibiteur du TNF-α, on a observé ces dernières années dans certains cas la formation d’anticorps qui entraînent une diminution ou une perte d’efficacité, de sorte qu’il faut passer à un autre produit biologique. Les traitements par perfusion, en particulier avec des anticorps monoclonaux, peuvent très rarement provoquer des réactions allergiques plus graves, pouvant aller jusqu’à l’anaphylaxie. Actuellement, ces thérapies par perfusion sont effectuées sous stricte surveillance et par un personnel formé à cet effet. Dans notre propre dossier médical, aucune de ces thérapies n’a dû être interrompue en raison d’effets secondaires graves.
Perspectives
Pour tous les médicaments biologiques, des études supplémentaires sont nécessaires concernant les effets secondaires, l’efficacité et la tolérance, en particulier pour les administrations à long terme. Compte tenu de la nature hétérogène des maladies rhumatismales inflammatoires, il devrait être possible à l’avenir de mieux définir quels patients bénéficient le plus de quelle substance active ; il n’existe pas encore de véritables directives à ce sujet. Les préparations existantes sont continuellement complétées ou remplacées par de nouvelles générations d’anticorps monoclonaux et les travaux se poursuivent pour simplifier le mode d’administration.
CONCLUSION POUR LA PRATIQUE
- L’inflammation articulaire est réversible, mais pas les dommages articulaires secondaires.
- Plus le diagnostic de la PR est précoce et plus la maladie est traitée efficacement, plus il est possible d’éviter les lésions articulaires permanentes et de ralentir, voire d’empêcher la progression radiologique.
- Dans le traitement actuel de la PR, le concept de traitement conventionnel (pyramide de traitement) est adapté à l’activité de la maladie.
- Avec les médicaments biologiques, une nouvelle ère s’est ouverte dans le traitement des maladies inflammatoires rhumatismales. La rémission est devenue un objectif thérapeutique réaliste.
Littérature :
- Bartelds GM, et al : Dtsch Med Wochenschrift 2011 ; 136 : 1410.
- Ernst J : Acta Rheumatol 2005 ; 30 : 119-124.
- Forster A : Ars Medici 1/2009.
- Kyburz D : Rheuma Schweiz, numéro 4, juillet 2011.
- Visser K, et al : Ann Rheum Dis 2010 ; 69 : 1333-1337.
- Grigor C, et al : Lancet 2004 ; 364 : 263-269.
- Goekoop-Ruiterman YP, et al : Ann Intern Med 2007 ; 146 : 406-415.
- Goekoop-Ruiterman YP, et al : Ann Rheum Dis 2007 ; 6 : 1227-1232.
- Quinn MA, et al : Arthritis Rheum 2005 ; 52 : 27-35.
- Smolen JS, et al : Arthritis Rheum 2006 ; 54 : 702-710.











