L’anémie préopératoire est un prédicteur indépendant d’un risque accru d’infection et de thromboembolie et d’une mortalité accrue. Les transfusions sanguines allogéniques contribuent à leur tour à la détérioration des résultats en raison de risques non spécifiques et spécifiques. Une approche de l’anémie basée sur un algorithme est utile. Le volume des cellules EC (MCV) et les réticulocytes permettent de classer et de traiter les anémies légères à modérées dans le cadre périopératoire. Les anémies graves doivent être évaluées et prises en charge par un expert. En cas de perte de sang importante prévue dans le cadre d’une chirurgie majeure, les besoins en fer peuvent être évalués et substitués dès la phase préopératoire. Selon les données actuelles, une anémie sévère est considérée comme une contre-indication à une intervention chirurgicale élective.
Il est de médecine factuelle et désormais largement accepté que l’anémie est associée à des risques multiples [1] : L’anémie préopératoire est un facteur prédictif indépendant d’un risque accru d’infection et de thromboembolie (TE) [2], d’une mortalité accrue et d’une hospitalisation prolongée [3]. L’anémie est donc un facteur de risque sérieux et pertinent pour le résultat de la guérison ou le résultat des patients dans le cadre d’une chirurgie élective et doit être traitée [4]. Malgré la clarté de la littérature, le problème de l’anémie pré- ou périopératoire est encore très souvent “réglé” de nos jours par l’administration de transfusions sanguines allogéniques, avec tous les risques supplémentaires spécifiques et non spécifiques que cela implique [5].
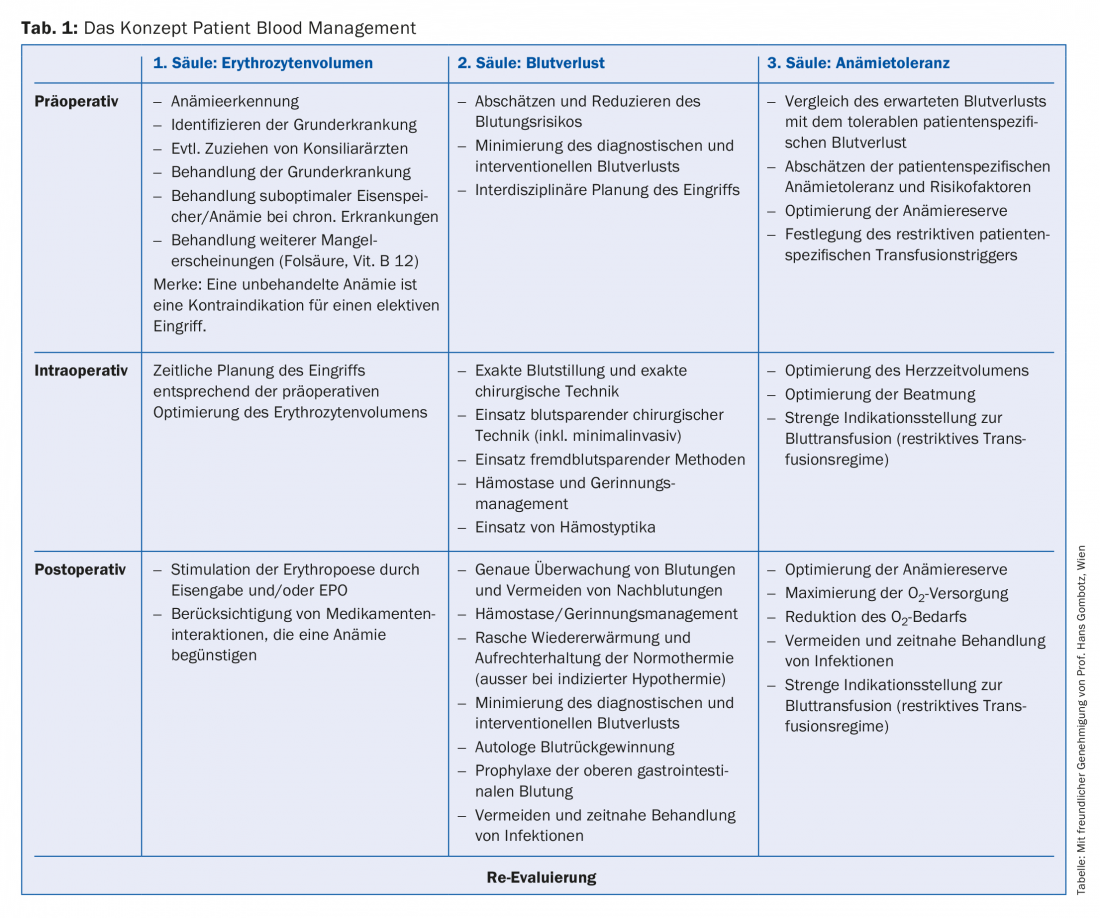
Le concept clinique de la gestion du sang du patient (Patient Blood Management – PBM) est une réponse interdisciplinaire basée sur les preuves et axée sur le patient, en tant qu’approche moderne du traitement de l’anémie, dans laquelle l’accent n’est plus mis sur la transfusion sanguine mais sur l’utilisation des ressources propres au patient. La PBM repose sur trois piliers (tableau 1), dont le premier consiste principalement à optimiser le volume des érythrocytes dans le cadre pré- et périopératoire. Il s’agit d’identifier l’anémie en tant que symptôme, de diagnostiquer la maladie sous-jacente et, dans la mesure du possible, de la traiter. Une anémie non traitée est aujourd’hui considérée comme une contre-indication à une intervention chirurgicale élective.
Algorithme d’évaluation et de traitement
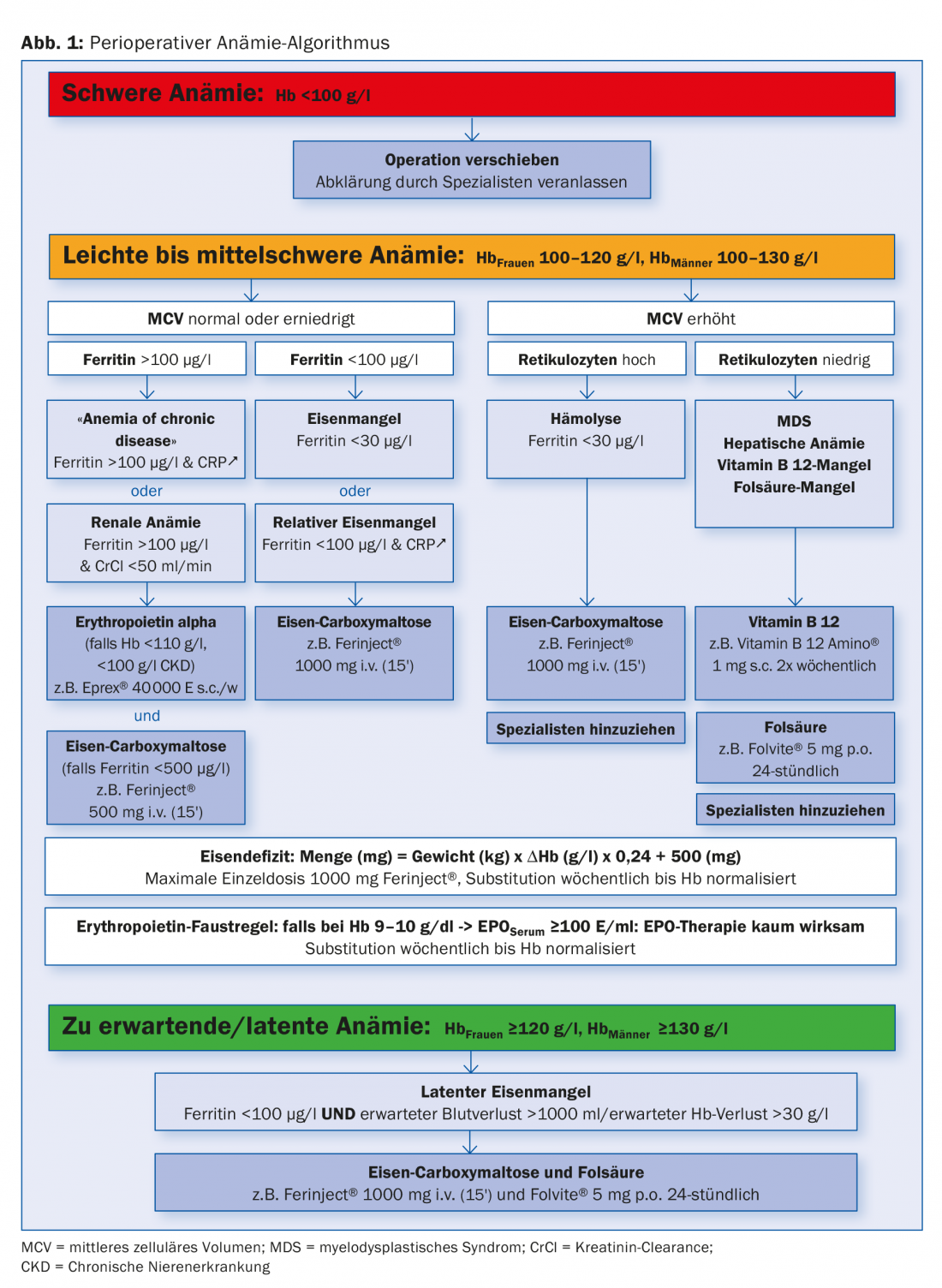
Un algorithme est extrêmement utile dans cette situation, car il peut prendre en compte les caractéristiques spécifiques au site du médecin traitant, telles que l’accessibilité des spécialistes et la disponibilité d’examens de laboratoire complémentaires. Un algorithme d’évaluation et de traitement (Fig. 1 et Tab. 2) permet de diagnostiquer, de classer et de traiter la majorité des anémies préopératoires dans un collectif standard. En conséquence, les patients arrivent à l’heure et parfaitement préparés pour l’opération prévue.
Le plus grand défi reste de trouver un équilibre entre l’exactitude médicale d’une part et la concision ou la simplicité d’autre part.
Les causes de l’anémie varient en fonction du contexte clinique de l’opération prévue. Les causes fréquentes d’anémies préexistantes en préopératoire sont la carence en fer, une utilisation limitée du fer dans le cadre de syndromes inflammatoires ou de maladies malignes, ainsi qu’une synthèse insuffisante d’érythropoïétine en cas d’insuffisance rénale chronique [6].
En nous basant sur la définition de l’anémie donnée par l’OMS, nous définissons trois niveaux de gravité dans notre algorithme :
- anémie sévère (Hb <100 g/l)
- anémie légère à modérée (Hb 100-120 ou 130 g/l)
- anémie latente ou attendue (Hb >120 ou 130 g/l).
Anémie sévère
En cas d’anémie sévère <100 g/l, l’opération prévue doit être reportée et le patient doit être évalué par un spécialiste.
Anémie légère à modérée
Selon l’OMS, l’anémie légère à modérée se définit par un taux d’Hb de 100-120 g/l chez les femmes et de 100-130 g/l chez les hommes.
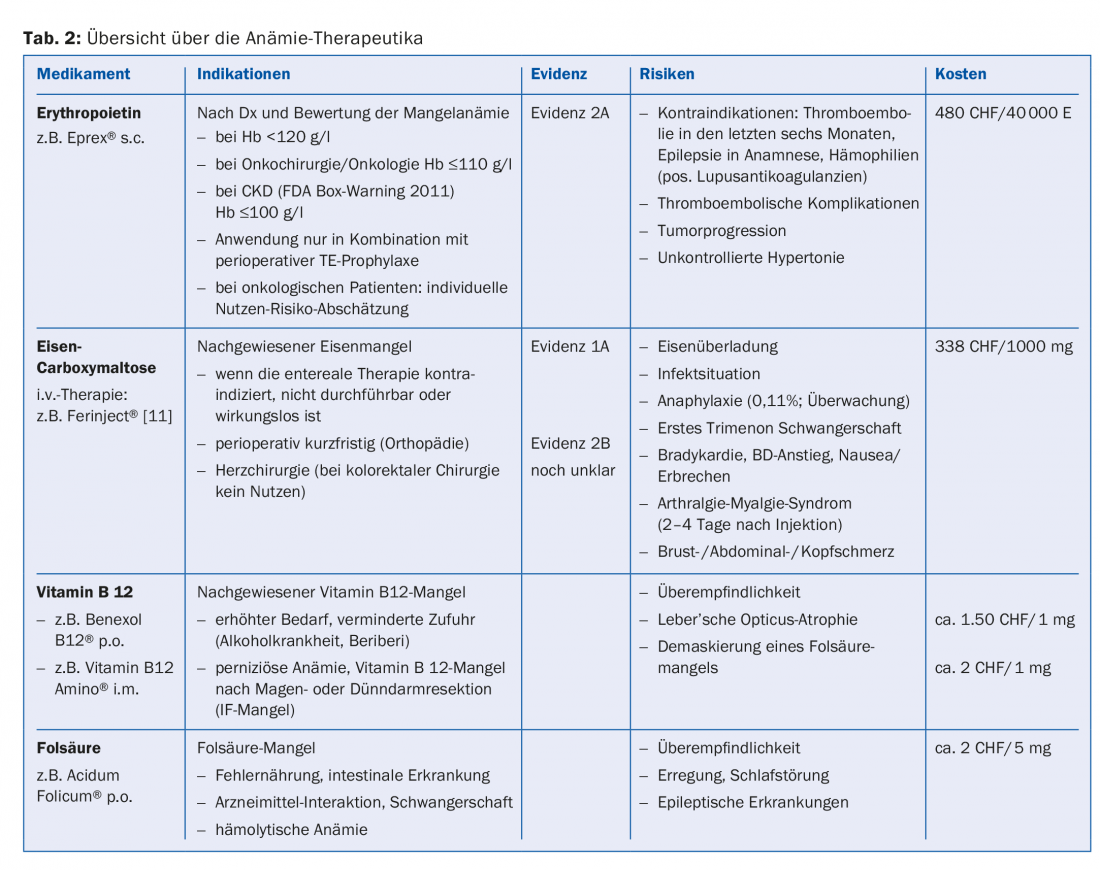
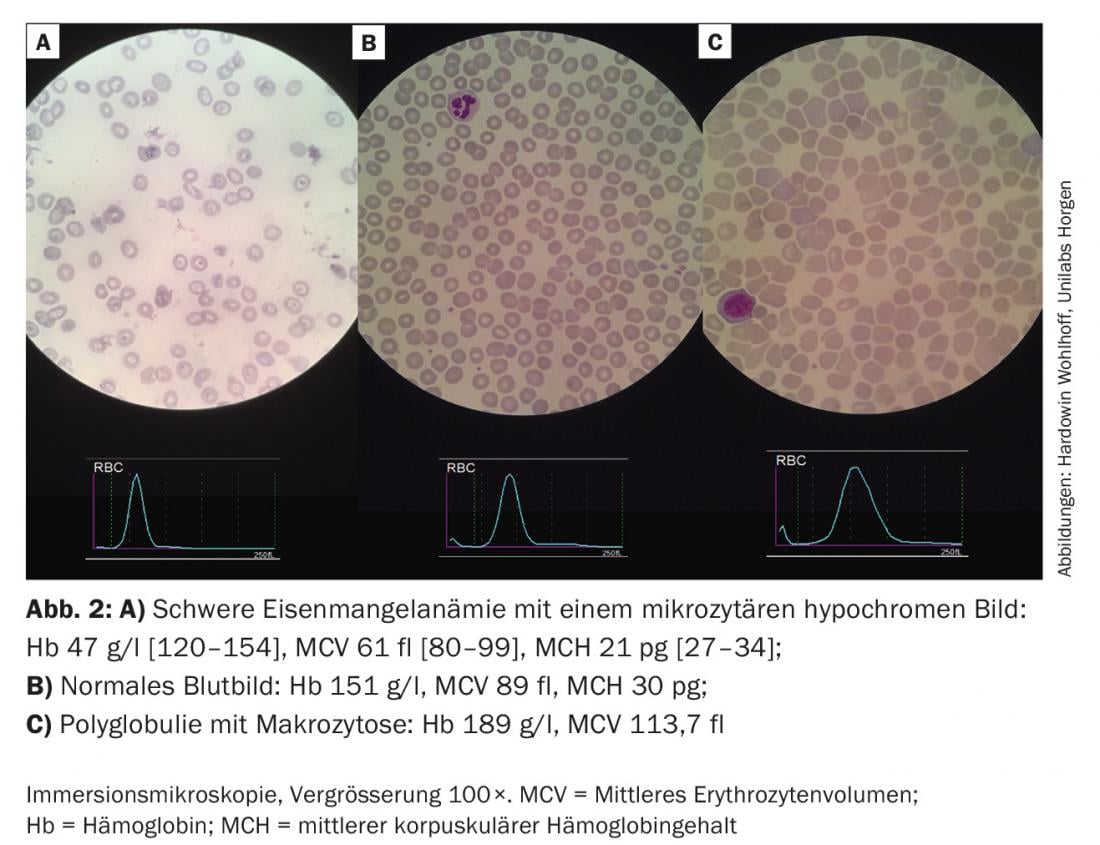
Pour cette anémie, nous nous basons en premier lieu sur le volume cellulaire moyen (MCV). Un MCV normal ou bas indique dans la plupart des cas une carence en fer manifeste ou cachée. (Fig.2A). Si la ferritine est supérieure à 100 μg/l avec une CRP élevée au sens d’une “anémie de maladie chronique” ou avec une fonction rénale réduite au sens d’une “anémie rénale”, nous recommandons un traitement combiné d’érythropoïétine (Epo) et de fer au dosage indiqué dans l’algorithme. La fréquence et le dosage idéaux d’une thérapie à l’épo n’ont pas été établis. Trois jours après une première dose, les réticulocytes augmentent, et après sept jours, la quantité de sang d’un concentré de CE est générée (après 28 jours de cinq concentrés de CE). Si le taux de ferritine est inférieur à 30 μg/l ou à 100 μg/l en combinaison avec des signes d’inflammation, nous recommandons la substitution isolée du fer dans le sens d’une carence absolue ou relative en fer.
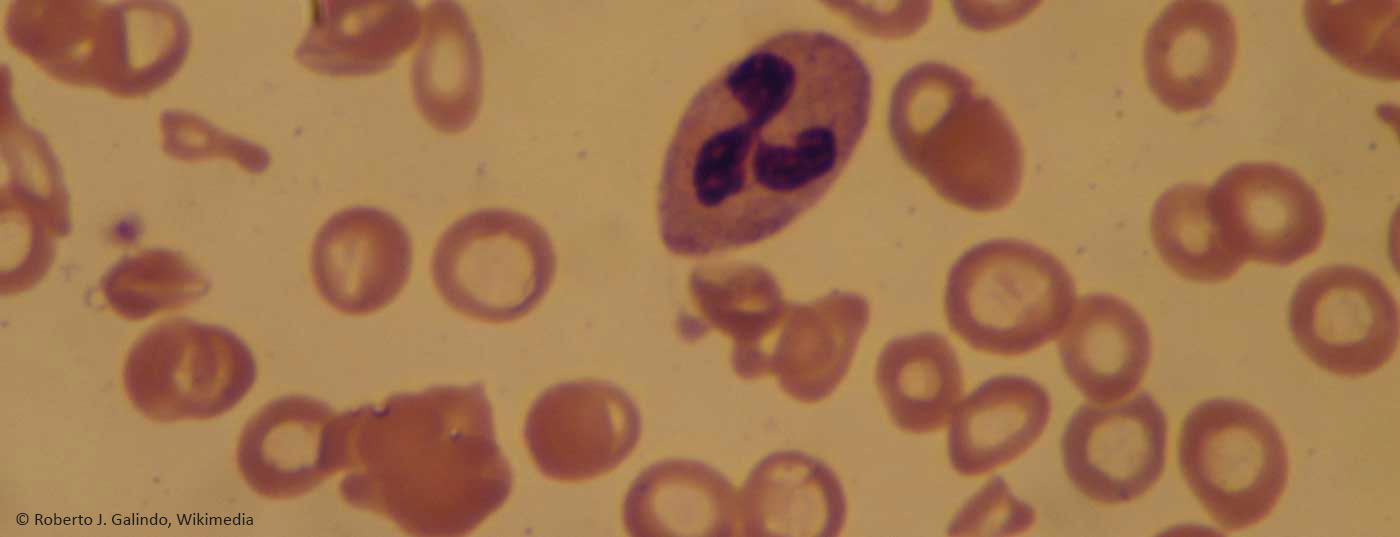
La figure 2B montre la référence normale entre les deux frottis sanguins pathologiques.
Dans les anémies macrocytaires (figure 2C), les réticulocytes permettent de déterminer s’il s’agit d’une forme d’anémie hyper- ou hypo-régénérative. Les anémies hyporégénératives sont généralement dues à des carences (fer, acide folique, vitamine B 12). Plus rarement, ils indiquent une insuffisance de la moelle osseuse. Les anémies hyperrégénératives sont la conséquence d’une production accrue (hémolyse) et/ou perturbée (néoplasies myéloprolifératives, thalassémies).
Nous recommandons que l’évaluation et la substitution d’une carence en fer “simple” soient effectuées par les médecins de famille et les médecins traitants. Pour les formes d’anémie et les concepts de traitement plus complexes, le recours à un hématologue peut s’avérer utile.
Le traitement par fer peut en principe être administré par voie entérale si la tolérance gastro-intestinale est bonne et si un délai suffisant est respecté. Néanmoins, des données montrent que la substitution parentérale en fer est associée à une meilleure observance et entraîne une augmentation plus précoce et plus marquée de l’hémoglobine [7–12].
La tolérance du fer administré par voie parentérale est proche de celle d’un traitement entéral, sans les effets secondaires gastro-intestinaux fréquents. Les réactions d’hypersensibilité redoutées, y compris les réactions anaphylactiques, surviennent de manière imprévisible et avec une fréquence de 0,1 à 1% pour Ferinject® selon le Compendium. Une surveillance adéquate des patients est donc impérative.
En ce qui concerne l’anémie pendant la grossesse, il faut garder à l’esprit que la substitution orale en fer est souvent insuffisante dans ce contexte. Des publications ou des lignes directrices nationales et internationales recommandent le traitement par fer intraveineux au cours des deuxième et troisième trimestres [13–15].
L’administration d’érythropoïétine dans le cadre préopératoire est recommandée par les sociétés savantes NATA, ESA, STS et ASA avec un niveau de preuve 2A. Le débat sur les risques et les effets secondaires de l’érythropoïétine se concentre actuellement sur trois thèmes :
Le risque accru de complications thromboemboliques est de plus en plus accepté dans la littérature et les sociétés savantes y répondent en recommandant une prophylaxie systématique du TE [16–20].
Les données relatives à l’influence de l’Epo sur la progression tumorale ne sont pas encore totalement concluantes. Bohlius a démontré en 2009, dans une revue portant sur plus de 14 000 patients, une influence négative de l’Epo sur la progression tumorale [21]. L’ESA recommande donc une évaluation individuelle des risques pour chaque patient et limite son utilisation aux anémies avec une Hb <110 g/l. En cas d’augmentation de l’Hb à des valeurs supérieures à 120 ou 130 g/l, le traitement doit être immédiatement suspendu.
L’utilisation de l’Epo en cas d’insuffisance rénale chronique est limitée à l’anémie sévère en raison d’une mortalité accrue, de complications cardiovasculaires graves et d’un risque accru d’accident vasculaire cérébral [22,23].
En raison de ces risques qui ne sont pas encore clarifiés dans tous les détails, l’obligation de remboursement de l’érythropoïétine est actuellement limitée au cadre orthopédique. Seuls les patients présentant une anémie symptomatique préopératoire ou une anémie modérée (Hb 100-130 g/l) et une perte de sang attendue de 900-1800 ml, pour lesquels les mesures de récupération du sang ne sont pas disponibles, sont insuffisantes ou contre-indiquées, peuvent bénéficier d’un remboursement.
Anémie attendue/latente
Le troisième groupe de patients présentant une hémoglobine normale avec une ferritine limite de <100 μg/l, chez lesquels on peut s’attendre à une perte de sang de plus de 1000 ml ou à une chute de l’Hb de plus de 30 g/l, devrait être traité de manière préemptive avec 1000 mg de Fe et, pour des raisons pragmatiques, conjointement avec 5 mg d’acide folique.
Facteur temps
Cet algorithme s’adresse aux patients avant une chirurgie majeure élective. Il va de soi qu’il ne peut être utilisé avec succès que si les patients sont dépistés et examinés à temps en préopératoire. C’est pourquoi nous recommandons un premier diagnostic et la mise en place d’un traitement approprié directement après la pose de l’indication chirurgicale, idéalement au moins 28 jours avant la date de l’opération.
Perspectives
Les données relatives à l’influence de l’anémie sur le résultat des patients en chirurgie élective semblent claires. Il faut cependant tenir compte du fait que des données de grande qualité sur le résultat du traitement de l’anémie sont encore manquantes et contradictoires. Alors que la thérapie ferrique à court terme réduit le taux de transfusion et la mortalité chez les patients en milieu orthopédique [24], la thérapie anémique préopératoire chez les patients atteints de cancer colorectal n’apporte, selon les connaissances actuelles, aucune amélioration du résultat [25].
En revanche, la correction d’une anémie par le fer et l’érythropoïétine dans le cadre d’un rétrécissement aortique et d’une insuffisance cardiaque entraîne une amélioration de la fonction de pompage du ventricule gauche, une baisse du BNP et une réduction de la mortalité, avec ou sans intervention chirurgicale [26].
Les études qui examinent cette approche [27], nous l’espérons, apporteront bientôt plus de clarté.
Le traitement de l’anémie sans transfusion de sang étranger avant une intervention chirurgicale élective fait partie intégrante d’une gestion moderne du sang du patient, est scientifiquement “à la pointe du progrès”, améliore la sécurité du patient et favorise positivement le processus de guérison [28].
Remerciements : Les auteurs remercient le professeur Hans Gombotz pour sa présentation non bureaucratique et amicale du concept de Patient Blood Management et Hardowin Wohlhoff, Unilabs Horgen, pour les images hématologiques illustratives.
Déclaration de l’auteur : les auteurs déclarent qu’ils n’ont aucun lien financier avec une entreprise dont le produit joue un rôle important dans cet article, ni aucune relation avec une entreprise qui commercialise un produit concurrent.
Littérature :
- Shander A, et al : Iron deficiency anemia – bridging the knowledge and practice gap. Transfus Med Rev 2014 ; 28 : 156-166.
- Musallam KM, et al : Anémie préopératoire et résultats postopératoires en chirurgie non cardiaque : une étude de cohorte rétrospective. Lancet 2011 ; 378 (9800) : 1396-1407
- Baron DM, et al : L’anémie préopératoire est associée à de mauvais résultats cliniques chez les patients ayant subi une chirurgie non cardiaque. Br J Anaesth 2014 ; 113(3) : 416-423.
- Karkouti k, et al : Risk associated with preoperative anemia in cardiac surgery : a multicenter cohort study. Circulation 2008 ; 117(4) : 478-484.
- Lasocki S, et al. : PREPARE : la prévalence de l’anémie périopératoire et le besoin de gestion du sang du patient en chirurgie orthopédique élective : une étude observationnelle multicentrique. Eur J Anaesthesiol 2015 ; 32(3) : 160-167.
- Clevenger B, et al : Anémie préopératoire. Anesthésie 2015 ; 70(Suppl 1) : 20-28.
- Ng O, et al : Iron therapy for pre-operative anaemia. Cochrane Database Syst Rev 2015 ; 12 : CD011588
- Pattakos G, et al : Outcome of patients who refused transfusion after cardiac surgery : a natural experiment with severe blood conservation. Arch Intern Med 2012 ; 172(15) : 1154-1160.
- Murphy MF, et al : Transfusion practice and safety : current status and possibilities for improvement. Vox Sang 2011 ; 100(1) : 46-59.
- Nat Kidney Foundation KDOQI : Lignes directrices de pratique clinique et recommandations de pratique clinique pour l’anémie dans la maladie rénale chronique chez l’adulte. Am J Kidney Dis 2006 ; 47(5 Suppl 3) : 16-85.
- Gupta A, et al : Pathogenesis of anaphylactoid reactions to intravenous iron. Am J Kidney Dis 2000 ; 35(2) : 360-361.
- Elhenawy AM, et al : Role of preoperative intravenous iron therapy to correct anemia before major surgery : study protocol for systematic review and meta-analysis. Syst Rev 2015 ; 4 : 29.
- Khalafallah AA, et al : Three-year follow-op of a randomised clinical trial of intravenous versus oral iron for anaemia in pregnancy. BMJ Open 2012 ; 2(5) : piie000998.
- Pavord S, et al : UK guidelines on the management of iron deficiency in pregnancy. Br J Haematol 2012 ; 2156(5) : 588-600.
- Christoph P, et al : Traitement intraveineux du fer pendant la grossesse : comparaison du ferric carboxymaltose à haute dose vs. le sucrose de fer. J Perinat Med 2012 ; 40(5) : 469-474.
- Kumar A, et al : Gestion périopératoire de l’anémie : limites de la transfusion sanguine et alternatives à celle-ci. Cleve Clin J Med 2009 ; 76(Suppl 4) : 112-118.
- Stowell CP, et al : An open-label, randomized, parallel-group study of perioperative epoetin alfa versus standard of care for blood conservation in major elective spinal surgery : sefety analysis. Spine 2009 ; 34(23) : 2479-2485.
- Lippi G, et al : Complications thrombotiques des agents stimulant l’érythropoïèse. Semin Thromb Hemost 2010 ; 36(5) : 537-549.
- Goodnough LT, et al : Détection, évaluation, et prise en charge de l’anémie préopératoire chez le patient orthopédique sélectif : lignes directrices NATA. Br J Anaesth 2011 ; 106(1) : 13-22.
- Kozek-Langenecker SA, et al : Management of severe perioperative bleeding : guidelines from the European
- Société d’anesthésiologie. Eur J Anaesthesiol 2013 ; 30(6) : 270-382.
- Bohlius J, et al : Recombinant human erythropoiesis-stimulating agents and mortality in patients with cancer : a meta-analysis of randomised trials. Lancet 2009 ; 373(9674) : 1532-1542.
- Saran R, et al : Establishing a national chronic kidney disease surveillance system for the United States. Clin J Am Soc Nephrol 2010 ; 5(1) : 152-161.
- Cody JD, et al : érythropoïétine humaine recombinante versus placebo ou absence de traitement pour l’anémie de la maladie rénale chronique chez les personnes ne nécessitant pas de dialyse. Cochrane Database Syst Rev 2016 ; CD 003266.
- Munoz M, et al : Very-short-term perioperative intravenous iron administration and postoperative outcome in major orthopedic surgery : a pooled analysis of observational data from 2547 patients. Transfusion 2014 ; 54(2) : 289-299.
- Hallet J, et al : The impact of perioperative iron on the use of red blood cell transfusions in gastrointestinal surgery : a systematic review and meta-analysis. Transfus Med Rev 2014 ; 28(4) : 205-211.
- Gomez M, et al : Effet de la correction de l’anémie sur les paramètres échocardiographiques et cliniques chez les patients atteints de sténose aortique impliquant une valve aortique à trois cavités et une fraction d’éjection du ventricule gauche normale. Am J Cardiol 2015 ; 116(2) : 270-274.
- Elhenawy AM, et al : Role of preoperative intravenous iron therapy to correct anemia before major surgery : study protocol for systematic review and meta-analysis. Syst Rev 2015 ; 4 : 29.
- Choorapoikayil S, et al. : Gestion du sang du patient : cela vaut-il la peine d’être employé ? Curr Opin Anesthesiol 2016 ; 29(2) : 186-191.
PRATIQUE DU MÉDECIN DE FAMILLE 2016 ; 11(5) : 23-28