Le psoriasis est une maladie auto-immune inflammatoire chronique à médiation par les cellules T, qui touche particulièrement la peau et les articulations. Elle est donc devenue de plus en plus importante pour tous les domaines médicaux, bien au-delà de la dermatologie et de la rhumatologie. L’introduction des produits biologiques a entraîné un profond bouleversement de la dermatologie, dont ont bénéficié non seulement les personnes atteintes de psoriasis, mais aussi les patients souffrant d’autres affections dermatologiques inflammatoires. L’article suivant donne un aperçu de la pathogenèse du psoriasis et du mode d’action des produits biologiques.
Le psoriasis est une maladie inflammatoire chronique qui touche particulièrement la peau et les articulations. Il touche environ 2 à 3 % de la population, ce qui fait du psoriasis l’une des maladies inflammatoires de la peau les plus courantes [1]. Cependant, le psoriasis est également une maladie multisystémique avec plusieurs manifestations systémiques et des maladies associées. Les patients présentent un risque cardiovasculaire accru [2,3], la prévalence du syndrome métabolique est plus élevée [4]. La dépression est fréquente et le psoriasis peut représenter un stress psychologique prononcé [5,6]. Le risque de cancer, notamment de lymphome et de cancer de la peau, est accru [7]. De plus, le psoriasis est souvent associé à d’autres maladies inflammatoires à médiation immunitaire. L’incidence de la maladie de Crohn, par exemple, est quatre à huit fois plus élevée que dans la population générale [8]. En effet, les maladies inflammatoires chroniques de l’intestin, le diabète et le psoriasis ont été associés à des gènes de risque identiques ou similaires [9,10]. Le psoriasis est aujourd’hui considéré comme une maladie génétique avec une interaction complexe de facteurs génétiques et externes qui conduisent au développement de la maladie.
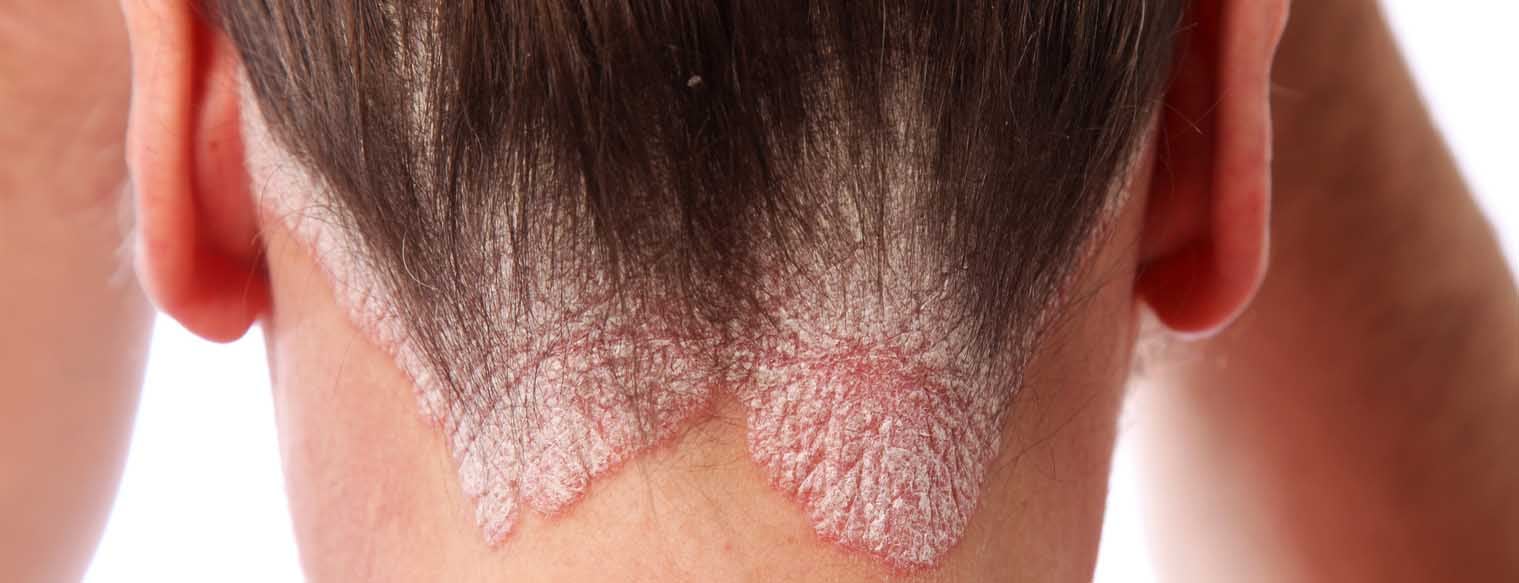
Psoriasis vulgaire
La forme classique du psoriasis, le psoriasis vulgaire, se présente typiquement sous forme de plaques rouges bien délimitées, recouvertes de squames blanc-argenté. La clinique se traduit histologiquement par un épiderme élargi (acanthose), des réticulations allongées (papillomatose), une couche cornée épaissie (hyperkératose) et une différenciation anormale des kératinocytes avec rétention des noyaux dans la couche cornée (para-kératose). Cela explique l’apparition de plaques squameuses cliniquement visibles. La rougeur reflète une augmentation du nombre de capillaires dilatés et tortueux. L’infiltrat inflammatoire est principalement composé de macrophages, de diverses cellules dendritiques, de lymphocytes T et de granulocytes neutrophiles.
Premières approches thérapeutiques
Le psoriasis étant caractérisé par une hyperkératose et des squames blanches épaissies, dues à des kératinocytes qui prolifèrent trop rapidement, il a longtemps été considéré comme une maladie des kératinocytes. Ce n’est qu’à la fin des années 1970 que l’utilisation réussie de la ciclosporine A et d’autres approches thérapeutiques ciblant les cellules T ont entraîné un changement de paradigme [11,12]. Bien que l’importance des cellules immunitaires n’ait plus été mise en doute par la suite, on ne sait toujours pas quel type de cellule est à l’origine du psoriasis. Des recherches récentes suggèrent que le psoriasis est provoqué par une combinaison d’un défaut primaire dans les kératinocytes et d’une réponse immunitaire excessive [13–16].
Compréhension de la pathogenèse
Chez les personnes ayant une prédisposition génétique, différents facteurs externes tels que les traumatismes (phénomène dit de Köbner), les infections, le stress ou les médicaments peuvent déclencher ou aggraver ultérieurement le psoriasis. Ces facteurs déclencheurs initiaux activent le système immunitaire inné.
Des complexes d’acides nucléiques (ADN et ARN) et de peptides antimicrobiens comme le LL-37, libérés par les kératinocytes après un traumatisme épidermique, activent les cellules dendritiques plasmacytoïdes et entraînent la production de grandes quantités d’interféron alpha (IFN-α) [14,15,17]. Dans des conditions physiologiques, les cellules dendritiques plasmacytoïdes reconnaissent les acides nucléiques viraux et jouent un rôle essentiel dans l’induction d’une immunité protectrice [18]. Dans le psoriasis, l’augmentation de la production d’IFN-α est cruciale dans le développement précoce de la maladie, car elle alimente la réponse auto-immune [15]. L’IFN-α entraîne l’activation et la maturation des cellules dendritiques conventionnelles qui, à leur tour, stimulent les lymphocytes T. Ainsi, l’IFN-α relie la réponse immunitaire innée à la réponse immunitaire acquise. Par la suite, les cellules T autoréactives prolifèrent, migrent dans l’épiderme et déclenchent finalement les caractéristiques épidermiques du psoriasis telles que l’hyperprolifération des kératinocytes et l’épaississement de l’épiderme [16].
Dans le psoriasis, ces cellules T autoréactives sont principalement des cellules T auxiliaires de type 1 (Th1) et des cellules T Th17, qui produisent respectivement l’interféron gamma et les interleukines (IL)-17 et IL-22 [19,20]. Il est intéressant de noter que les deux cytokines Th17, en particulier, sont essentielles pour lier la réponse immunitaire acquise à la dérégulation épidermique caractéristique du psoriasis [21–23]. L’IL-22 induit une hyper-prolifération des kératinocytes, et l’IL-17 et l’IL-22 augmentent toutes deux la production de peptides antimicrobiens [24–26]. Comme décrit ci-dessus, les peptides antimicrobiens entraînent une activation continue du système immunitaire et donc, par une boucle de rétroaction positive, une chronicisation de la maladie. En résumé, l’activation continue de l’axe LL-37/IFN-α/Th17 est essentielle à la pathogenèse du psoriasis [18]. En fait, plusieurs gènes de susceptibilité offrent une base génétique à la pertinence de cet axe dans le psoriasis. Les gènes de susceptibilité tels que RAGE et l’IFN “regulatory factor” 5 sont impliqués dans l’activation des cellules dendritiques plasmacytoïdes et la production d’IFN-α respectivement [27], les gènes du CMH I sont impliqués dans l’activation des cellules T autoréactives [27,28], et les gènes de l’IL-23 et du récepteur de l’IL-23 sont directement impliqués dans la polarisation et l’expansion des cellules T Th17 [29,30].
Le triomphe des produits biologiques
Au cours des 15 dernières années, cette compréhension de plus en plus détaillée de la pathogenèse a fondamentalement modifié le traitement du psoriasis. Sur la base de ces connaissances, une nouvelle génération de médicaments, appelés biologics, a été développée. Cette classe de médicaments est basée sur la technologie de l’ADN recombinant et comprend des anticorps monoclonaux et des protéines de fusion de récepteurs qui ciblent spécifiquement l’activation des lymphocytes T ou des cytokines essentielles. Comme les produits biologiques interviennent de manière très spécifique dans la réponse immunitaire, il est possible que d’autres organes soient moins affectés et que les effets secondaires soient ainsi réduits. La compréhension croissante du psoriasis a ouvert la voie à de nombreuses nouvelles approches thérapeutiques potentielles et, en conséquence, de nombreux produits biologiques sont aujourd’hui en cours de développement clinique ou sont déjà disponibles en tant que médicaments pour les médecins et les patients [31].
Le facteur de nécrose tumorale (TNF) est une cytokine qui joue un rôle important dans les réactions inflammatoires [32]. Comme les niveaux de TNF sont élevés dans le sérum, les lésions cutanées et les articulations affectées des patients atteints de psoriasis, le TNF était un candidat évident pour une première intervention immunitaire ciblée dans les maladies inflammatoires chroniques telles que la maladie de Crohn, l’arthrite ou le psoriasis. Alors que les premières études étaient basées sur une expérience anecdotique chez un patient souffrant à la fois de la maladie de Crohn et de psoriasis [33], le traitement anti-TNF est ensuite devenu le gold standard absolu dans le traitement du psoriasis. Aujourd’hui, trois anti-TNF différents figurent parmi les dix médicaments les plus vendus au monde, et Humira® arrive en tête avec des ventes de 10 milliards de dollars.
Il y a de plus en plus de
Depuis que l’importance fonctionnelle de l’axe IFN-α/IL-23/Th17 dans le psoriasis a été reconnue, un nombre croissant de produits biologiques ciblant cet axe sont en cours de développement clinique. L’ustékinumab, qui bloque simultanément l’IL-12 et l’IL-23, empêchant ainsi la différenciation des cellules Th1 et Th2 respectivement, a été testé dans le cadre d’un essai clinique. Th17-T, est le premier médicament de ce groupe à être disponible sur le marché [34,35]. L’efficacité est absolument comparable à celle des inhibiteurs du TNF [36]. En revanche, le briakinumab, un autre anticorps anti-IL-12/23, a été retiré avant même son lancement, malgré une efficacité impressionnante [37], en raison de la survenue fréquente d’événements cardiovasculaires graves. Bien qu’une méta-analyse indépendante n’ait pas démontré d’association entre le blocage de l’IL-12/23 et l’augmentation du risque cardiovasculaire [38], il subsiste une certaine incertitude quant à la sécurité cardiovasculaire de ce groupe de préparations. Récemment, une étude a montré que des taux sériques d’IL-17 plus bas chez les patients ayant subi un infarctus aigu du myocarde entraînaient un risque accru d’autres événements cardiovasculaires [39]. En conséquence, les anticorps anti-IL12/23 et, à l’avenir, les inhibiteurs de l’IL-17 doivent être utilisés avec prudence après leur mise sur le marché, au moins chez les patients présentant un risque cardiovasculaire élevé. Néanmoins, les anticorps anti-IL-17 et les produits biologiques qui interfèrent avec l’axe IL-23/Th17 devraient faire partie des produits biologiques les plus utilisés dans le psoriasis dans les années à venir, avec les inhibiteurs du TNF déjà bien établis.
Une meilleure compréhension de la pathogenèse du psoriasis a conduit ces dernières années à une multitude de nouvelles approches thérapeutiques potentielles [31]. Bien que les produits biologiques actuellement disponibles soient efficaces et bien tolérés, certains problèmes subsistent quant à leur efficacité et leur sécurité à long terme. Avec les progrès futurs, la disponibilité de données génomiques complètes sur les patients atteints de psoriasis et éventuellement l’identification d’auto-antigènes dans le psoriasis, on peut s’attendre à de nouvelles percées dans l’immunothérapie et à un arsenal de traitements améliorés et encore plus ciblés.
Biologics en dehors de l’indication du psoriasis
Le succès des produits biologiques dans le psoriasis a entraîné un changement de mentalité dans l’ensemble de la dermatologie et l’utilisation croissante de thérapies ciblées axées sur la pathogenèse dans d’autres indications. En raison de l’importance du TNF dans la plupart des réactions inflammatoires chroniques, les inhibiteurs du TNF ont été testés dans d’autres indications très tôt après leur mise sur le marché. Ils sont aujourd’hui utilisés avec succès dans de nombreuses dermatoses inflammatoires : Le blocage du TNF, par exemple, montre une très bonne efficacité dans le pyoderma gangraenosum résistant aux traitements [40] et a même fait son entrée dans les lignes directrices pour le traitement de l’hidradénite suppurative. Aujourd’hui, les anticorps anti-IgE sont utilisés dans l’urticaire chronique [41], et le blocage de l’IL-1 est le traitement standard des syndromes auto-inflammatoires [42]. En outre, sur la base de la compréhension fondamentale des maladies et de la réponse immunitaire, de plus en plus de produits biologiques sont développés pour des maladies dermatologiques spécifiques. Ainsi, l’immunothérapie ciblée avec des anticorps contre CTLA-4 et PD-1/PD-L1 dans le mélanome a ouvert une nouvelle ère dans le traitement antitumoral. Le traitement repose sur le blocage des molécules qui régulent négativement une réponse antitumorale efficace des cellules T (ce que l’on appelle l’inhibition du point de contrôle des cellules T). En particulier, les stratégies combinées permettent aujourd’hui d’obtenir des taux de réponse élevés et des rémissions durables dans le mélanome [43].
CONCLUSION POUR LA PRATIQUE
- La compréhension de plus en plus détaillée de l’origine de la maladie a fondamentalement modifié le traitement du psoriasis au cours de la dernière décennie et a conduit à l’introduction des produits biologiques en dermatologie.
- Aujourd’hui, le psoriasis est considéré comme une maladie modèle pour d’autres maladies inflammatoires chroniques et est souvent utilisé dans le cadre d’études dites de “preuve de concept” pour étudier de nouvelles approches thérapeutiques ciblées sur la pathogenèse.
- Le succès des produits biologiques dans le psoriasis a entraîné un changement de mentalité dans l’ensemble de la dermatologie. L’utilisation de thérapies ciblées orientées vers la pathogenèse dans d’autres indications est en augmentation.
Littérature :
- Christophers E : Psoriasis – épidémiologie et spectre clinique. Clin Exp Dermatol 2001 ; 26(4) : 314-320.
- Mehta NN, et al : Les patients atteints de psoriasis sévère présentent un risque accru de mortalité cardiovasculaire : étude de cohorte utilisant la base de données de recherche sur la pratique générale. Eur Heart J 2010 ; 31(8) : 1000-1006.
- Gelfand JM, et al : Risque d’infarctus du myocarde chez les patients atteints de psoriasis. JAMA 2006 ; 296(14) : 1735-1741.
- Gisondi P, et al : Prevalence of metabolic syndrome in patients with psoriasis : a hospital-based case-control study. Br J Dermatol 2007 ; 157(1) : 68-73.
- Kurd SK, et al : The risk of depression, anxiety, and suicidality in patients with psoriasis : a population-based cohort study. Arch Dermatol 2010 ; 146(8) : 891-895.
- Krueger G, et al : The impact of psoriasis on quality of life : results of a 1998 National Psoriasis Foundation patient-membership survey. Arch Dermatol 2001 ; 137(3) : 280-284.
- Gelfand JM, et al : Le risque de lymphome chez les patients atteints de psoriasis. J Invest Dermatol 2006 ; 126(10) : 2194-2201.
- Najarian DJ, Gottlieb AB : Connections between psoriasis and Crohn’s disease. J Am Acad Dermatol 2003 ; 48(6) : 805-821.
- Wolf N, et al : Le psoriasis est associé à des loci de susceptibilité pléiotropique identifiés dans le diabète de type II et la maladie de Crohn. J Med Genet 2008 ; 45(2) : 114-116.
- Nair RP, et al : Evidence for two psoriasis susceptibility loci (HLA and 17q) and two novel candidate regions (16q and 20p) by genome-wide scan. Hum Mol Genet 1997 ; 6(8) : 1349-1356.
- Mueller W, Herrmann B : Cyclosporine A pour le psoriasis. N Engl J Med 1979 ; 301(10) : 555.
- Gottlieb SL, et al : Response of psoriasis to a lymphocyte-selective toxin (DAB389IL-2) suggests a primary immunity, but not keratinocyte, pathogenic basis. Nat Med 1995 ; 1(5) : 442-447.
- Sano S, et al. : Stat3 lie les kératinocytes activés et les immunocytes nécessaires au développement du psoriasis dans un nouveau modèle de souris transgénique. Nat Med 2005 ; 11(1) : 43-49.
- Lande R, et al : Plasmacytoid dendritic cells sense self-DNA coupled with antimicrobial peptide. Nature 2007 ; 449(7162) : 564-569.
- Nestle FO, et al : Les cellules prédendritiques plasmacytoïdes initient le psoriasis par la production d’interféron-alpha. J Exp Med 2005 ; 202(1) : 135-143.
- Conrad C, et al : L’intégrine alpha1bêta1 est essentielle à l’accumulation de cellules T épidermiques et au développement du psoriasis. Nat Med 2007 ; 13(7) : 836-842.
- Ganguly D, et al : Self-RNA-antimicrobial peptide complexes activate human dendritic cells through TLR7 and TLR8. J Exp Med 2009 Aug 31 ; 206(9) : 1983-1994.
- Conrad C, Meller S, Gilliet M : Cellules dendritiques plasmacytoïdes dans la peau : à détecter ou non à détecter les acides nucléiques. Semin Immunol 2009 ; 21(3) : 101-109.
- Uyemura K, et al : Le réseau de cytokines dans la peau psoriasique avec et sans lésions est caractérisé par une réponse médiée par les cellules T-helper de type 1. J Invest Dermatol 1993 ; 101(5) : 701-705.
- Lowes MA, et al : Les lésions de psoriasis vulgaire contiennent des populations discrètes de cellules T Th1 et Th17. J Invest Dermatol 2008 ; 128(5) : 1207-1211.
- Tonel G, Conrad C : Interaction entre les kératinocytes et les cellules immunitaires—recent sur la pathogenèse du psoriasis. Int J Biochem Cell Biol 2009 ; 41(5) : 963-968.
- Zheng Y, et al : L’interleukine-22, une cytokine T(H)17, médiatise l’inflammation dermique et l’acanthose induites par l’IL-23. Nature 2007 ; 445(7128) : 648-651.
- Tonel G, et al : Cutting edge : A critical functional role for IL-23 in psoriasis. J Immunol 2010 ; 185(10) : 5688-5691.
- Liang SC, et al : L’interleukine (IL)-22 et l’IL-17 sont coexprimées par les cellules Th17 et coopèrent à l’expression de peptides antimicrobiens. J Exp Med 2006 ; 203(10) : 2271-2279.
- Wolk K, et al : IL-22 augmente l’immunité innée des tissus. Immunité 2004 ; 21(2) : 241-254.
- Peric M, et al : IL-17A enhances vitamin D3-induced expression of cathelicidin antimicrobial peptide in human keratinocytes. J Immunol 2008 ; 181(12) : 8504-8512.
- Sánchez FO, et al : Les variantes du gène du facteur 5 régulateur de l’IFN interagissent avec le locus du CMH de classe I dans la population suédoise atteinte de psoriasis. J Invest Dermatol 2008 ; 128(7) : 1704-1709.
- Nair RP, et al : Sequence and haplotype analysis supports HLA-C as the psoriasis susceptibility 1 gene. Am J Hum Genet 2006 ; 78(5) : 827-851.
- Cargill M, et al : A large-scale genetic association study confirms IL12B and leads to the identification of IL23R as psoriasis-risk genes. Am J Hum Genet 2007 ; 80(2) : 273-290.
- Capon F, et al : Sequence variants in the genes for the interleukin-23 receptor (IL23R) and its ligand (IL12B) confer protection against psoriasis. Hum Genet 2007 ; 122(2) : 201-206.
- Flatz L, Conrad C : Role of T-cell-mediated inflammation in psoriasis : pathogenesis and targeted therapy. Psoriasis : Cibles et traitement 2013 ; 3 : 1-10.
- Baugh JA, Bucala R : Mécanismes de modulation du TNF alpha dans les maladies immunitaires et inflammatoires. Curr Opin Drug Discov Devel 2001 ; 4(5) : 635-650.
- Oh CJ, Das KM, Gottlieb AB : Le traitement par un anticorps monoclonal anti-tumor necrosis factor alpha (TNF-alpha) réduit de manière spectaculaire l’activité clinique des lésions psoriasiques. J Am Acad Dermatol 2000 ; 42(5 Pt 1) : 829-830.
- Leonardi CL, et al. (investigateurs de l’étude PHOENIX 1) : PHOENIX Efficacité et sécurité de l’ustekinumab, un anticorps monoclonal humain contre l’interleukine-12/23, chez les patients atteints de psoriasis : 76-week results from a randomised, double-blind, placebo-controlled trial (PHOENIX 1). Lancet 2008 ; 371(9625) : 1665-1674.
- Papp KA, et al. (investigateurs de l’étude PHOENIX 2) : Efficacité et sécurité de l’ustekinumab, un anticorps monoclonal humain contre l’interleukine-12/23, chez les patients atteints de psoriasis : 52-week results from a randomised, double-blind, placebo-controlled trial (PHOENIX 2). Lancet 2008 ; 371(9625) : 1675-1684.
- Griffiths CE, et al. (Groupe d’étude ACCEPT) : Comparaison de l’ustekinumab et de l’etanercept pour le psoriasis modéré à sévère. N Engl J Med 2010 ; 362(2) : 118-128.
- Reich K, et al : A 52-week trial comparing briakinumab with methotrexate in patients with psoriasis. N Engl J Med 2011 ; 365(17) : 1586-1596.
- Ryan C, et al : Association entre les thérapies biologiques pour le psoriasis chronique en plaques et les événements cardiovasculaires : une méta-analyse des essais contrôlés randomisés. JAMA 2011 ; 306(8) : 864-871.
- Simon T, et al : Niveaux circulants d’interleukine-17 et résultats cardiovasculaires chez les patients atteints d’infarctus aigu du myocarde. Eur Heart J 2013 Feb ; 34(8) : 570-577.
- Conrad C, Trueb RM : Pyoderma gangrenosum. J Dtsch Dermatol Ges 2005 ; 3(5) : 334-342.
- Maurer M, et al : Omalizumab pour le traitement de l’urticaire chronique idiopathique ou spontanée. N Engl J Med 2013 Mar 7 ; 368(10) : 924-935.
- Caorsi R, Federici S, Gattorno M : Médicaments biologiques dans les syndromes auto-inflammatoires. Autoimmun Rev 2012 Nov ; 12(1) : 81-86.
- Ott PA, Hodi FS, Robert C : Blocage de CTLA-4 et PD-1/PD-L1 : nouvelles modalités immunothérapeutiques avec un bénéfice clinique durable chez les patients atteints de mélanome. Clin Cancer Res 2013 Oct 1 ; 19(19) : 5300-5309.
DERMATOLOGIE PRATIQUE 2014 ; 24(5) : 6-8