La connaissance des marqueurs moléculaires des leucémies pourrait aider à l’avenir à identifier les patients à haut risque. De plus, cela offre la possibilité de développer d’autres approches thérapeutiques ciblées. Certains produits thérapeutiques déjà approuvés montrent à quel point cette voie vers la thérapie personnalisée en vaut la peine.
Lorsqu’on s’intéresse à la pathogenèse des leucémies, la première chose qui saute aux yeux est généralement que le processus est très hétérogène, tout comme la multitude de maladies leucémiques qui en résultent. Les leucémies sont principalement le résultat d’altérations génétiques moléculaires. Les gènes et produits géniques de BCR-ABL, p53, DNMT3A et autres sont particulièrement régulièrement touchés. Mais quel est le rôle diagnostique et surtout thérapeutique de telles mutations génétiques ?
Les mutations génétiques et les aberrations chromosomiques apparaissent naturellement avec l’âge chez toute personne en bonne santé. Au-delà de 70 ans, 10 à 50 % des personnes testées présentent des mutations génétiques de ce type. Néanmoins, toutes ces personnes âgées ne sont pas atteintes de leucémie. Dans de nombreux cas, l’élément déclencheur de la maladie est une accumulation clonale des mutations dans l’hématopoïèse. Cela signifie que les cellules sanguines modifiées forment un clone plus grand en nombre et deviennent ainsi déterminantes pour l’hémogramme. Cette hématopoïèse clonale (“clonal hematopoiesis of indeterminate potential”, CHIP) est, selon les connaissances actuelles, un facteur de risque décisif pour une néoplasie hématologique. En outre, les aberrations chromosomiques dans le sang périphérique et, chez les hommes âgés, la perte du chromosome Y dans les cellules sanguines sont considérées comme des facteurs de risque de leucémie.
Des marqueurs génétiques et des gènes marqueurs
La leucémie myéloïde aiguë (LMA) est encore souvent associée à un très mauvais pronostic. De plus, il n’existe souvent pas ou peu d’options thérapeutiques ciblées, en particulier pour les patients âgés. Cependant, les cibles génétiques (telles que FLT3, IDH1/2, BCL2) permettent désormais de mieux cibler les patients et leurs pronostics respectifs (favorable, intermédiaire, défavorable) et de les traiter à l’aide des premiers agents thérapeutiques ciblés.
Une modification génétique assez fréquente est la mutation FLT3. Environ 25% des patients atteints de LAM présentent un ou plusieurs allèles pour ce gène. La mutation est considérée comme instable et entraîne donc des sensibilités thérapeutiques différentes, ce qui est important pour les futurs régimes de traitement. Néanmoins, la première étude de phase III spécifique au génotype au monde, appelée RATIFY [1], a montré que la midostaurine, un inhibiteur de tyrosine kinase multicible, associée à une chimiothérapie, augmentait le taux de survie chez les patients atteints de LAM et présentant une mutation FLT3. La survie sans événement a en outre été prolongée de 3,2 à 8,2 mois. Ainsi, après plus de 30 ans, la midostaurine, désormais autorisée, est considérée comme une véritable percée dans le traitement de la LAM.
L’un des “blockbusters” des futures options thérapeutiques dans la LAM est le vénétoclax, un médicament qui agit comme une cible de cellules souches pour BCL2 et qui est actuellement en phase III d’une éventuelle autorisation de mise sur le marché. Déjà en monothérapie, les études ont montré jusqu’ici de bons taux de réponse (20% ORR) sous vénétoclax chez les patients atteints de LAM R/R. De plus, 70% des répondants ont vécu plus de douze mois. La réponse au vénétoclax a été rapide et durable, avec peu de récidives.
Comme pour la LAM, la leucémie lymphoïde aiguë (LLA) est très hétérogène d’un point de vue moléculaire (plus de dix sous-groupes différents), ce qui explique pourquoi la chimiothérapie standard, basée sur l’approche “one fits all”, ne peut pas vraiment être utile. Le traitement de ces entités tumorales va certainement évoluer à l’avenir, par exemple dans la recherche d’ITK appropriés et, surtout, d’approches issues de l’immunothérapie ou de la thérapie cellulaire CAR-T. Les chercheurs de l’université d’Utrecht (Allemagne) ont déjà commencé à travailler sur ce sujet. Le blinatumomab (anti-CD19) et l’inotuzumab ozogamicin (anti-CD22) sont les premières thérapies autorisées sur le marché.
Après la survie, la qualité de vie
Après l’introduction des ITK dans le traitement de la leucémie myéloïde chronique (LMC), le taux de survie à 10 ans pour cette maladie atteint aujourd’hui 83%, ce qui signifie que les chances de survie avec la LMC sont proches de celles de la population générale. Les patients atteints de LMC ne sont donc plus uniquement concernés par la survie. De même, la survie sans progression, le profil d’effets secondaires, la toxicité à long terme et surtout la qualité de vie jouent un rôle important pour eux. Pour les oncologues, la possibilité d’atteindre une rémission sans traitement chez les patients atteints de LMC est au premier plan, car cela conduit effectivement à une meilleure qualité de vie, à moins d’effets secondaires et à une toxicité à long terme réduite.
Il existe actuellement cinq médicaments originaux dans le monde, dont l’imatinib, également autorisé dans notre pays, constitue certainement l’un des “points forts” connus du traitement moderne de la LMC. Ainsi, l’imatinib a montré une survie à 5 ans de plus de 95% dans la LMC. Cependant, des aberrations cytogénétiques (chromosomiques) supplémentaires peuvent réduire le succès du traitement. Par conséquent, outre la PCR, la ponction de moelle osseuse reste recommandée pour détecter les modifications chez les patients atteints de LMC.
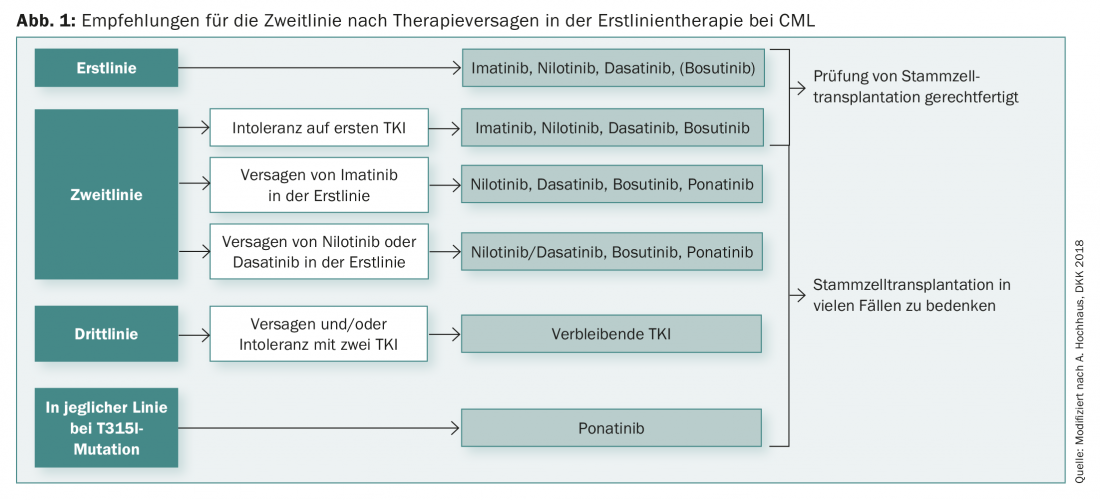
Le choix du traitement de première ligne de la LMC ne dépend toutefois pas uniquement de la génétique. En outre, les objectifs thérapeutiques individuels devraient jouer un rôle, de même que les éventuelles maladies concomitantes (comorbidités). Pour de nombreux patients, la question de la déductibilité de la thérapie est également très importante. Il existe également des premières recommandations à ce sujet qui, selon les études actuelles, permettent d’arrêter le traitement en cas de rémission moléculaire profonde supérieure à 18 mois, afin de réduire les effets secondaires par exemple.
La durée de la rémission moléculaire profonde (pendant au moins deux ans) est alors également un facteur déterminant pour la prévention des récidives. Cependant, dans de nombreux cas, le traitement est à nouveau possible même après une récidive et le patient peut à nouveau atteindre la rémission sous traitement. Après l’échec du traitement de première ligne, il existe désormais toute une série d’options de deuxième ligne pour la LMC (figure 1).
Source : 33e Congrès allemand sur le cancer, 21-24 février 2018, Berlin
Littérature :
- Stone RM, et al : N Engl J Med 2017 ; 377 : 454-464.











