Dans le traitement du cancer de l’œsophage, il convient de veiller à un apport calorique suffisamment élevé dès le premier jour de traitement. Dans le cas du cancer de l’œsophage localement avancé, la chimioradiothérapie néoadjuvante (essai CROSS) s’est établie. La technique chirurgicale du cancer de l’œsophage n’est pas standardisée au niveau international et doit faire l’objet d’une évaluation plus approfondie. La reconstruction de l’œsophage se fait en premier lieu par une remontée gastrique. La technique mini-invasive peut être utilisée comme alternative à la résection ouverte. Une résection de l’œsophage de sauvetage peut être envisagée en cas de récidive locorégionale d’un cancer de l’œsophage traité par CRT définitive.
Le cancer de l’œsophage est une tumeur rare au mauvais pronostic. Selon le Registre national du cancer (NICER), 15 nouveaux cas (m/f, 11/4) sont diagnostiqués pour 100 000 habitants et douze (m/f, 9/3) décès liés au cancer de l’œsophage sont enregistrés pour 100 000 habitants par an (2007-2011). Au niveau mondial, le carcinome épidermoïde domine (70%) par rapport à l’adénocarcinome (25%). Dans les pays industrialisés occidentaux, on constate toutefois une prédominance des adénocarcinomes et leur fréquence atteint désormais 60% en Suisse. Cela semble aller de pair avec le changement de comportement à risque lié à l’éradication de l’Helicobacter.
L’approche thérapeutique individualisée et multimodale est aujourd’hui considérée comme la norme. Chaque patient atteint d’un cancer de l’œsophage doit être évalué par une équipe interdisciplinaire lors d’un tumor board avant que le traitement ne soit mis en place.
Staging, évaluation des risques
Outre l’endoscopie et l’histologie, un scanner thoracique/abdominal est indispensable dans la stadification du cancer de l’œsophage. L’endosonographie est supérieure à toutes les autres méthodes pour différencier les cancers précoces T1, T2 et est donc obligatoire. Pour les adénocarcinomes de la jonction œsophagienne (AEG), la classification de Siewert est nécessaire et doit être exigée par l’endoscopiste, non seulement en ce qui concerne le pronostic, mais aussi et surtout en ce qui concerne l’approche thérapeutique. Comme le PET-CT donne des résultats supplémentaires dans 5-10% des cas, nous le considérons comme obligatoire, surtout pour les tumeurs localement avancées, ce qui rend le scanner normal inutile. Cependant, cela n’a pas encore été intégré dans les lignes directrices courantes. Si la tumeur est liée au système trachéobronchique, une bronchoscopie supplémentaire doit être effectuée. Dans le cas des carcinomes épidermoïdes, on trouve dans 10% des cas une deuxième tumeur dans la région ORL, raison pour laquelle une panendoscopie supérieure est indiquée. La laparoscopie de stadification est recommandée pour les adénocarcinomes distaux afin d’exclure une carcinose péritonéale et peut en outre être utilisée sans problème pour la mise en place d’une sonde jéjunale pour l’administration nocturne d’aliments supplémentaires.
Le traitement du cancer de l’œsophage – ne serait-ce que par une opération seule – est riche en complications et en contraintes, c’est pourquoi il est extrêmement important de procéder à une évaluation préopératoire des risques, avec des examens fonctionnels préopératoires, des préparatifs et une information du patient. Une alimentation supplémentaire et/ou une jéjunostomie d’alimentation doivent être évaluées rapidement et mises en place comme mesures de soutien, le patient et ses proches devant être informés de l’importance d’une alimentation suffisante et soutenus dans cette démarche.
Approche thérapeutique
Stades précoces : les carcinomes limités à la muqueuse par endosonographie (uTm1, uTm2) sont aujourd’hui clairement le domaine du traitement endoscopique (résection endoscopique de la muqueuse, REM), car ils ne métastasent pratiquement pas par voie lymphogène, comme le montrent les données rétrospectives de Hölscher et de son groupe [1]. Si une infiltration plus profonde est détectée lors de l’EMR (pTm3, pT1sm1-3), la suite de la procédure peut se faire à l’aide de ces résections ou de ces curetages. Les biopsies étendues peuvent être définies de manière plus approfondie et dans le sens d’un meilleur staging. Un “overtreatment” est évité. Si la sous-muqueuse est atteinte, il faut s’attendre à un risque de métastases lymphogènes pouvant atteindre 43% et le seul traitement local est certainement insuffisant [2].
Les carcinomes UT1sm1-3, uT2N0 sont opérés directement, y compris une lymphadénectomie adéquate.
Tumeurs localement avancées : Tous les patients atteints d’une tumeur localement avancée sont aujourd’hui prétraités par une chimioradiothérapie néoadjuvante (CRT) avant d’être opérés après un intervalle sans traitement de six à huit semaines, bien que des données récentes suggèrent d’attendre plutôt plus longtemps (jusqu’à douze semaines). Le CRT (Cross Trial Group) basé sur les taxanes s’est clairement imposé et établi comme standard. Dans cette étude, la CRT néoadjuvante vs. la chirurgie seule a donné un avantage de survie à 3 ans statistiquement significatif de 59% vs. 48%, avec une rémission pathologique complète de 32,6%.
Gestion opérationnelle
La chirurgie œsophagienne est associée à un taux élevé de complications (40-60%) et de mortalité (4-8%). La gestion périopératoire nécessite une collaboration routinière et exercée entre tous les spécialistes impliqués et le chirurgien. Les progrès dans l’évolution postopératoire sont en grande partie dus aux progrès de la médecine intensive, avec une amélioration de l’analgésie, une substitution liquidienne adaptée, une prophylaxie de l’aspiration, etc. et une collaboration interdisciplinaire standardisée. Il n’est donc pas étonnant que, là aussi, l’expérience d’une équipe de traitement et donc le nombre plus élevé de cas (>10 par an) conduisent à de meilleurs résultats – comme le montrent différentes études épidémiologiques. Une nouvelle étude européenne [3] montre qu’il est possible d’atteindre un taux de mortalité à 30 jours de 1,9% (Suède). En chirurgie œsophagienne, ces données doivent être analysées de manière très précise, car de nombreux patients survivent à des complications pendant 30 jours, mais meurent ensuite à l’hôpital, car ils ne se remettent pas des autres complications. C’est pourquoi le taux de mortalité à 30 jours n’a qu’une signification limitée. Un taux de mortalité hospitalière serait beaucoup plus transparent.
Opération, lymphnodectomie
Différentes techniques chirurgicales sont utilisées dans la chirurgie œsophagienne :
- résections transhiatales
- résections transthoraciques (Ivor-Lewis) avec une phase abdominale et thoracique et une anastomose intrathoracique
- résection thoraco-abdomino-cervicale (3 incisions, type McKeown) avec anastomose cervicale.
Le choix de la procédure de résection dépend de plusieurs facteurs : l’emplacement de la tumeur, le type de reconstruction envisagée, les antécédents médicaux du patient et, enfin et surtout, la préférence et la routine du chirurgien. Les anastomoses cervicales présentent beaucoup plus de sténoses anastomotiques (40-60%), qui doivent être bougées de manière récurrente en postopératoire, par rapport aux anastomoses intrathoraciques (2-10%). De même, les anastomoses cervicales sont associées à un taux de récurrence plus élevé (5-30%), ce qui ne se produit pratiquement pas avec une anastomose intrathoracique (<1%). Le taux d’insuffisance anastomotique est plus faible pour les sutures intrathoraciques (2-10 vs. 15-30%), mais il est très souvent associé à des conséquences potentiellement mortelles telles que la médiastinite et les réinterventions. Une insuffisance anastomotique cervicale se résout pratiquement toujours de manière conservatrice et ne met jamais la vie en danger. De nombreuses études rétrospectives ont comparé les différentes techniques chirurgicales – sans différence significative. Seuls Hulscher et al. [4] ont montré une meilleure survie à 5 ans (39 vs. 27%) pour l’approche transthoracique avec lymphadénectomie adéquate par rapport à la résection transhiatale. Ceci est probablement dû à une lymphnodectomie plus étendue le long du système trachéobronchique. Par voie transhiatale, la lymphadénectomie ne réussit en fait que jusqu’à la veine pulmonaire inférieure – l’ablation des ganglions lymphatiques le long de la trachée et de la bifurcation trachéale ainsi que le long des bronches principales est difficile. 23 ganglions lymphatiques doivent être retirés en même temps que l’œsophagectomie, comme l’a montré une étude internationale [2]. Cela peut être un gage de qualité d’une chirurgie appropriée. Le groupe d’experts allemands (German Advanced Surgical Treatment Study Group) recommande l’œsophagectomie radicale avec lymphadénectomie médiastinale et abdominale, au sens d’une lymphadénectomie “à deux champs” [5]. Une lymphadénectomie “à trois champs”, comme celle souvent pratiquée au Japon, est associée à une morbidité plus élevée (trachéotomie, lésions du nerf lanryngien) [5,6]. Elle tend à montrer un bénéfice en termes de survie à long terme, tant pour les cancers proximaux que pour les cancers de l’œsophage du tiers moyen [7], et a fait son entrée dans les guidelines japonaises. En Europe et en Amérique, la lymphadénectomie “à trois champs” n’est toutefois pratiquée que dans des centres sélectionnés et dans des cas isolés.
Reconstruction
Au niveau international, le premier choix de remplacement de l’œsophage est la sonde gastrique. Il est également possible de choisir une interposition colique ou iléo-caecale, qui sera anastomosée par voie rétrosternale à l’œsophage cervical. Une coloscopie doit être effectuée avant l’interposition du côlon. Une interposition colique peut donner au patient une mauvaise haleine fétide et donc réduire considérablement sa qualité de vie.
Suite à la résection vagale et à la formation d’un tube gastrique, 20% de tous les patients souffrent de pylorospasme et donc d’un retard de la vidange gastrique. Sur le plan chirurgical, plusieurs études ne montrent aucun avantage à pratiquer une pyloroplastie de routine. Ce problème doit être traité de manière conservatrice avec des prokinétiques, une adaptation de l’alimentation et éventuellement une dilatation du pylore, car l’expérience montre qu’il est limité à deux ou trois mois. Dans cette situation, une infiltration de Botox dans le pylore peut être envisagée.
Œsophagectomie mini-invasive
Au Royaume-Uni, sur 7502 œsophagectomies, 1155 (24,7%) sont déjà réalisées par une procédure peu invasive (2009-2010) [6]. De nombreuses séries provenant de centres individuels, des analyses rétrospectives, des méta-analyses et des revues systémiques montrent que la technique mini-invasive est une alternative à la technique ouverte. Il est possible d’obtenir des résultats oncologiques tout aussi bons et certaines méta-analyses montrent une tendance à une morbidité légèrement meilleure en termes d’insuffisance anastomotique et de complications pulmonaires dans le groupe mini-invasif [6]. Les premières données d’une étude multicentrique randomisée menée en Hollande montrent un net avantage en termes de complications pulmonaires postopératoires précoces en faveur de la technique mini-invasive [8]. La procédure Ivor Lewis avec une anastomose réalisée par thoracoscopie est techniquement exigeante et nécessite une expertise avec un nombre de cas correspondant, comme le montre le groupe de Luketich [9].
Œsophagectomie de sauvetage
En cas de récidive locorégionale ou d’échec du traitement après une CRT définitive, la chirurgie peut être envisagée comme option thérapeutique, en particulier si une résection R0 peut être obtenue. Ceci est confirmé par les données de 65 patients opérés en moyenne 216 jours après une CRT définitive pour un adénocarcinome distal. La morbidité, la mortalité et la survie à long terme postopératoires sont équivalentes à celles du groupe ayant bénéficié d’une CRT néoadjuvante planifiée et d’une chirurgie [9]. De même, un suivi étroit après une CRT définitive est indiqué afin de pouvoir offrir aux patients présentant une récidive locorégionale solitaire une nouvelle possibilité de traitement curatif.
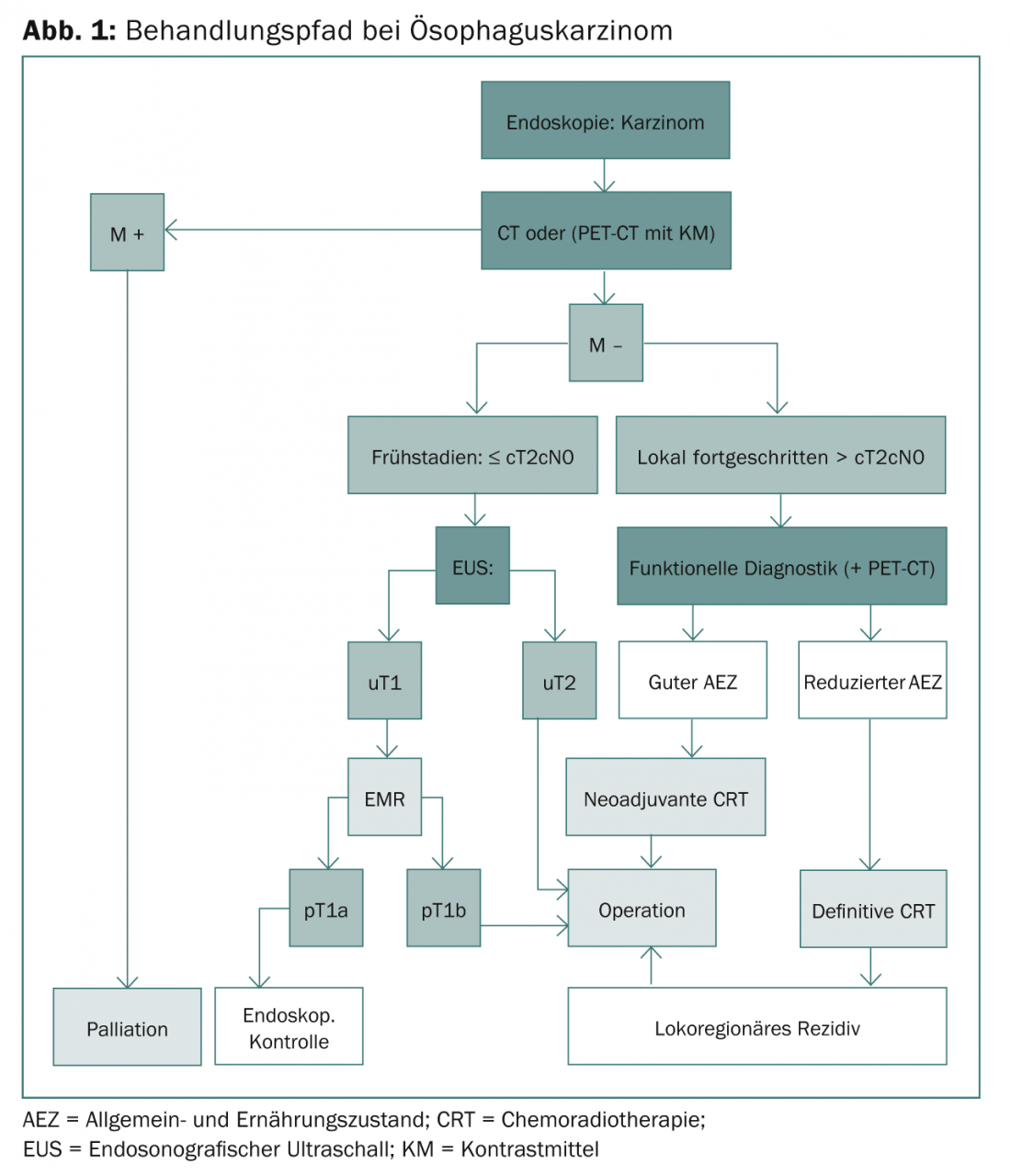
La figure 1 illustre le parcours de soins complet pour les cancers de l’œsophage.
Evolution postopératoire, mesures à long terme, qualité de vie
Les patients souffrant d’hypertension gastrique doivent changer leur régime alimentaire et leur mode de vie. Ils ne peuvent donc manger que de petites portions, ce qui implique des collations et des repas riches en calories pour couvrir leurs besoins caloriques. Cela peut s’améliorer après des années, mais certains patients luttent toute leur vie pour consommer suffisamment de calories. De nombreux patients souffrent de reflux gastro-œsophagien, de sorte que la prise d’un bloqueur de protons est nécessaire à vie à haute dose. Nous recommandons à tous les patients de relever leur tête de lit et de ne pas s’allonger après un repas. Néanmoins, de nombreux patients se plaignent de toux nocturnes, ce qui correspond à de petites aspirations.
Il est fréquent, surtout chez les patients traités par tri-modalité, qu’une malabsorption se développe après un an ou plus, avec des selles grasses, des ballonnements et une nouvelle perte de poids. Il s’agit le plus souvent d’une insuffisance pancréatique exocrine d’origine actinique, qui répond très bien à la substitution enzymatique. Au cours de l’évolution postopératoire, la vidange de la poche gastrique peut être plus rapide, ce qui peut entraîner des hypoglycémies gênantes dans le sens d’un dumping. Si le médecin traitant et le patient sont sensibilisés, ces symptômes peuvent très bien être évités par la diététique. Il faut généralement entre six et douze mois pour que le patient se remette d’une résection de l’œsophage, et rares sont les patients qui reprennent ensuite leur activité professionnelle à 100%.
Dr. med. Annelies Schnider
Littérature :
- Hölscher AH, et al : Impact pronostique de l’infiltration de la troisième muqueuse supérieure, moyenne et inférieure ou sous-muqueuse dans le cancer précoce de l’œsophage. Ann Surg 2011 ; 254(5) : 802-807.
- Lorenz D, et al : Facteurs de risque pronostiques des adénocarcinomes précoces de l’œsophage. Ann Surg 2014 ; 259 : 469-476.
- Dikken JL, et al : Différences dans les résultats de la chirurgie du cancer de l’œsophage et de l’estomac à travers l’Europe. BJS 2012 ; 100 : 83-94.
- Hulscher JB, et al : Extended transthoracic resection compared with limited transhiatal resection for adenocarcinomas of the esophagus. N Engl J Med 2002 ; 347 : 1662-1669.
- Palmes D, et al : Évaluation diagnostique, techniques chirurgicales et gestion périopératoire après une ésophagectomie : consensus du groupe allemand de traitement chirurgical avancé. Langenbecks Arch Surg 2011 ; 396 : 857-866.
- Kim T, et al : Review of Minimally Invasive Esophagectomy and Current Controversies. Gastroenterology Research and Practice 2012.
- Udagawa H, et al. : L’importance du regroupement des sites de ganglions lymphatiques et la rationalité de la lymphnodectomie à trois champs pour le cancer de l’œsophage thoracique. J Surg Onc 2012 ; 106 : 742-747.
- Nagpal K, et al : Is minimally invasive surgery beneficial in the management of esophageal cancer ? Une méta-analyse. Surg Endoscop 2010 ; 24 : 1621-1629.
- Luketich JD, et al : Résultats après une esophagectomie mini-invasive. AnnSurg 2012 ; 256(1) : 95-103.
Littérature complémentaire :
- Hüttl TP, et al : Techniques et résultats de la chirurgie du cancer de l’œsophage en Allemagne. Langenbecks Arch Surg 2002 ; 387 : 125-129.
- Pennathur A, et al : Résections pour cancer de l’œsophage : stratégies pour une gestion optimale. Ann Thorac Surg 2008 ; 85 : 751-756.
- Briere SS, et al. : Ésophagectomie mini-invasive versus ouverte pour les patients atteints de cancer de l’œsophage : un essai contrôlé randomisé, multicentrique et en ouvert. Lancet 2012 ; 379 : 1887-1892.
- Marks JL, et al : Ésophagectomie de sauvetage après échec d’une chimioradiation définitive pour adénocarcinome de l’œsophage. Ann Thorac Surg 2012 ; 94 : 1126-1132.
- Ruhstaller T, et al. : Trends in survival from oesophageal cancer in Switzerland. Bulletin suisse du cancer 2014 ; 3.
- Hagen P, et al : Chimioradiothérapie préopératoire pour le cancer de l’œsophage ou de la jonction. N Engl J Med 2012 ; 366 : 2074-2084.
- Peyre CG, et al : Le nombre de ganglions lymphatiques supprimés prédit la survie dans le cancer de l’œsophage : une étude internationale sur l’impact de l’étendue des résections chirurgicales. Ann Surg 2008 ; 248 : 549-556.
InFo ONKOLOGIE & HÄMATOLOGIE 2014 ; 2(10) : 18-21