L’atezolizumab permet à certains patients atteints d’un cancer du poumon prétraité de survivre à long terme. L’alectinib aide également les patients à mieux supporter la vie quotidienne en atténuant les symptômes de la maladie à plus long terme. Tels sont les résultats de deux études ELCC.
L’étude de phase II appelée POPLAR a randomisé 287 patients provenant de 13 pays au total. Ils souffraient tous d’une forme avancée de cancer du poumon non à petites cellules (NSCLC) et avaient déjà reçu des traitements pour cette maladie. Une partie a subi une immunothérapie avec l’anticorps anti-PD-L1 atezolizumab, l’autre une chimiothérapie avec le docetaxel.
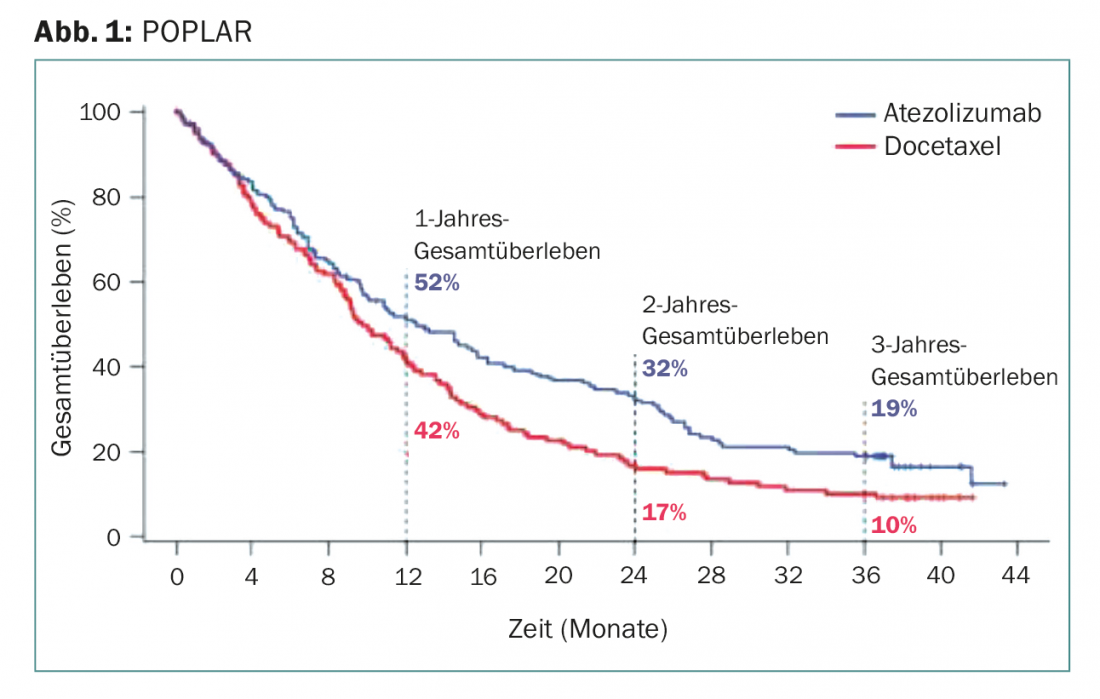
Après deux et trois ans – le plus long suivi d’une immunothérapie PD-L1 dans ce cadre à ce jour – l’atezolizumab était significativement supérieur au docétaxel (figure 1) :
- Environ un tiers du premier groupe était encore en vie après deux ans. Dans le groupe docetaxel, le taux de survie était inférieur de plus de moitié (16,6%).
- Même à trois ans, l’immunothérapie a doublé la survie, passant de 10% sous docétaxel à 18,7% sous atezolizumab.
- Le bénéfice a été démontré indépendamment de l’expression de PD-L1 évaluée de manière prospective et de l’histologie (carcinome épidermoïde ou non). Même les patients dont l’expression de PD-L1 était inférieure à 1% des cellules tumorales et immunitaires en bénéficiaient encore.
A cela s’ajoute une durée de réponse trois fois plus longue (avec un taux de réponse global identique de 15%) et moins d’événements indésirables sous immunothérapie. La substance testée a été bien (suffisamment) tolérée pour pouvoir être administrée pendant plusieurs années. Grâce à l’immunothérapie, certains patients sont donc désormais considérés comme des “survivants à long terme du cancer du poumon”, ils travaillent à nouveau et ont une qualité de vie plus ou moins bonne.
Les données d’efficacité de POPLAR ont été confirmées dans l’étude de phase III appelée OAK [1].
Quelles conclusions peut-on tirer de POPLAR ?
Bien que l’atezolizumab semble être une option pour tous les patients atteints de NSCLC avancé sur la base des analyses de sous-groupes de POPLAR, il n’est pas possible d’évaluer l’efficacité de l’atezolizumab chez tous les patients. Il est donc difficile de prédire quels patients bénéficieront de la molécule à long terme. On ne sait pas exactement qui est ce cinquième de patients encore en vie après trois ans, ni comment il se caractérise. La définition de biomarqueurs prédictifs reste donc un défi.
En même temps, le nombre d’environ un cinquième de survivants à 3 ans représente un très bon résultat dans ce collectif. L’atezolizumab se hisse ainsi au rang des molécules présentant les taux de survie les plus élevés jamais enregistrés chez des patients atteints de cancer du poumon précédemment traités. Avant l’immunothérapie, il n’y avait pratiquement pas de survivants à long terme atteints de NSCLC. Aujourd’hui, à la lumière de nouvelles données d’études, cela devient possible pour la première fois. Les résultats de POPLAR sont accompagnés et soutenus par des taux de survie à 3 et 5 ans comparables issus d’études menées avec les anticorps anti-PD1 pembrolizumab et nivolumab [2]. Dans le cadre de ce dernier, environ 15% des patients étaient encore en vie après cinq ans (phase I), ce qui est normalement déjà considéré comme “guéri” dans le cas du cancer. POPLAR est d’une importance capitale en tant que grande étude randomisée qui confirme désormais le bénéfice de survie à long terme pour l’approche PD-L1.
Si l’on considère l’ensemble des études, il existe aujourd’hui de nombreux arguments en faveur de l’immunothérapie pour tous les patients atteints de CBNPC à un stade avancé. Enfin, il semble que les chances de survie à 5 ans soient d’environ 1 sur 6. Malheureusement, comme c’est souvent le cas ces derniers temps, des questions financières restent en suspens. Comment notre système de santé pourrait-il supporter une prescription plus large de l’immunothérapie ? Probablement seulement si l’on pouvait identifier les patients qui ne bénéficieraient certainement pas d’une telle stratégie. Or, l’expression de PD-L1 dans POPLAR s’est à nouveau révélée être un biomarqueur inadéquat. Si les personnes ayant des niveaux d’expression extrêmement bas peuvent encore en bénéficier en termes de survie, il ne peut servir à lui seul à les exclure. Actuellement, la recherche sur les biomarqueurs bat son plein. A l’avenir, il est probable qu’un “faisceau” de biomarqueurs sera de plus en plus utilisé, y compris peut-être la charge mutationnelle de la tumeur. Cependant, en ce qui concerne la combinaison de biomarqueurs, il est nécessaire de mener des études dans des collectifs similaires à ceux des études mentionnées sur l’atezolizumab, le pembrolizumab et le nivolumab. Il faudrait donc commencer par définir précisément les survivants à long terme (démographiques, antécédents de tabagisme, charge mutationnelle de la tumeur, réponse immunitaire, niveau d’expression, etc.) et voir ensuite quels biomarqueurs (ensemble) sont les plus prédictifs.
L’atezolizumab (Tecentriq®) est actuellement autorisé en Suisse pour le traitement des patients atteints de NSCLC localement avancé ou métastasé, après une chimiothérapie préalable. Le traitement nécessite une garantie de prise en charge par l’assureur-maladie après consultation préalable du médecin-conseil.
Du nouveau sur ALEX
L’étude ALEX [3], publiée en août dernier, a évalué en phase III l’alectinib, un inhibiteur sélectif des kinases ALK et RET. Celui-ci est considéré comme un inhibiteur de tyrosine kinase de “nouvelle génération”. Dans un échantillon de 303 patients atteints de cancer du poumon non à petites cellules (NSCLC), présentant une maladie avancée non traitée auparavant et une mutation du driver oncogène (ALK), l’agent expérimental a montré une efficacité et une sécurité/tolérance supérieures à celles du crizotinib, l’inhibiteur de tyrosine kinase standard utilisé jusqu’à présent. Au total, environ 4% de tous les patients atteints de NSCLC sont ALK-positifs et sont donc plus susceptibles de développer des métastases du SNC. Entre autres, le risque de progression ou de décès a été significativement réduit de plus de 50% dans l’étude tête-bêche, et les progressions du SNC ont été nettement moins fréquentes (12% vs 45%, HR 0,16, p<0,001).
L’ELCC de Genève s’est concentré sur les résultats d’ALEX qui pouvaient être évalués par les patients eux-mêmes, c’est-à-dire la charge de morbidité, la tolérance des symptômes et la qualité de vie liée à la santé. Pour ce faire, ils ont utilisé le questionnaire validé QLQ-C30 de l’EORTC avec l’annexe modulaire QLQ-LC13, qui a été élaborée spécifiquement pour les patients atteints de cancer du poumon. Les symptômes de la maladie peuvent être évalués à l’aide d’une série de 13 questions. Les caractéristiques de base des patients évaluables (environ deux tiers de chacun des groupes alectinib et crizotinib) étaient comparables. Les patients ont rempli les questionnaires au début, puis tous les mois, ainsi que dans le mois suivant leur sortie de l’étude (les traitements étant rarement interrompus en raison d’une aggravation des symptômes) et après la progression de la maladie.
Ces deux substances ont entraîné une nette amélioration des symptômes de la maladie. Si l’on considère l’ensemble des symptômes comprenant la toux, la dyspnée et les douleurs thoraciques (qui représentent généralement une lourde charge pour les patients atteints de cancer du poumon à un stade avancé), le temps médian nécessaire à l’aggravation des symptômes était à peu près le même pour les deux molécules. Cependant, en moyenne, les patients ont estimé que leurs symptômes de base s’étaient améliorés pendant une période plus longue lorsqu’ils avaient reçu l’alectinib plutôt que le crizotinib (ce qui est cohérent avec les données de SSP favorables sous alectinib). Par exemple, la toux s’est améliorée de manière cliniquement significative pendant 96 semaines en moyenne (contre 84 semaines dans le groupe témoin), les douleurs thoraciques pendant 96 semaines contre 80 semaines, les douleurs localisées ou la fatigue pendant 96 semaines contre 68 semaines dans les deux cas.
La qualité de vie a été cliniquement améliorée de manière significative dans les deux groupes, mais sur une période plus longue sous alectinib, à savoir 88 semaines contre 68 semaines. Une aggravation significative des symptômes associés au traitement tels que nausées, vomissements, diarrhée, perte d’appétit, dysphagie, neuropathie périphérique, etc. est survenue chez moins de patients sous alectinib que sous crizotinib. Dans l’ensemble, les données documentées par les patients eux-mêmes étaient cohérentes avec les données de sécurité publiées précédemment et confirment la meilleure tolérance à l’alectinib. Ils sont également bien compatibles avec les données d’efficacité : des taux de réponse comparables avaient été observés dans les deux bras, avec toutefois une durée de réponse plus longue sous alectinib. De la même manière, la qualité de vie et les symptômes du cancer du poumon ont été améliorés dans les deux bras, mais les améliorations ont duré plus longtemps sous alectinib.
Les patients atteints de CBNPC ALK-positif ont, comme nous l’avons vu, un risque particulièrement élevé de développer de multiples métastases cérébrales. Les possibilités d’irradiation sont limitées pour cette symptomatologie éprouvante, qui peut en outre affecter les fonctions cognitives. L’alectinib est associé à une protection élevée contre les métastases cérébrales, il réduit la probabilité qu’une métastase cérébrale existante progresse. Les mécanismes sous-jacents font actuellement l’objet de recherches [4]. Si l’on considère uniquement les patients présentant des métastases du SNC au début de l’étude dans la sous-analyse des données des patients présentée à l’ELCC, l’alectinib s’est également avéré supérieur : Les avantages en termes de progression et d’amélioration de la qualité de vie ont été plus importants. la forte activité du SNC avec la substance active se sont par conséquent reflétées dans la vie quotidienne des patients. D’une part, la qualité de vie a diminué moins souvent et, d’autre part, environ deux fois moins de personnes ont signalé une détérioration cognitive (17,9% contre 34,6% à la semaine 32).
Il y a donc de nombreux arguments en faveur d’un nouveau standard de soins en première ligne pour les patients atteints de NSCLC ALK-positif à un stade avancé. Pour ce dernier groupe, Alecensa® est actuellement autorisé en Suisse, mais seulement après progression sous crizotinib ou en cas d’intolérance au crizotinib, et après accord de prise en charge par l’assureur-maladie après consultation préalable du médecin-conseil.
Le fait que les données des patients soient systématiquement collectées et analysées dans le cadre d’une grande étude de phase III est d’une importance capitale. La qualité de vie et le fardeau de la maladie sont peut-être même plus importants que la survie prolongée en soi (et “à tout prix”), en particulier dans les situations palliatives. Les substances actives qui ne se contentent pas de prolonger la durée de vie restante, mais la rendent plus agréable, sont donc les bienvenues.
Source : ELCC 2018 (European Lung Cancer Congress), 11-14 avril 2018, Genève
Littérature :
- Rittmeyer A, et al : Atezolizumab versus docetaxel chez les patients atteints de cancer du poumon non à petites cellules (CPNC) précédemment traités : un essai contrôlé randomisé multicentrique de phase 3, en ouvert. Lancet 2017 Jan 21 ; 389(10066) : 255-265.
- Vokes EE, et al : Nivolumab versus docetaxel dans le cancer du poumon non à petites cellules avancé précédemment traité (CheckMate 017 et CheckMate 057) : mise à jour à 3 ans et résultats chez les patients présentant des métastases hépatiques. Ann Oncol 2018 Feb 2. DOI : 10.1093/annonc/mdy041 [Epub ahead of print].
- Peters S, et al : Alectinib versus crizotinib in Untreated ALK-Positive Non-Small-Cell Lung Cancer. N Engl J Med 2017 Aug 31 ; 377(9) : 829-838.
- Kodama T, et al : Activité antitumorale de l’alectinib, inhibiteur sélectif de l’ALK, dans des modèles de métastases intracrâniennes. Cancer Chemother Pharmacol 2014 Nov ; 74(5) : 1023-1028.
InFo ONKOLOGIE & HÄMATOLOGIE 2018 ; 6(3) – publié le 8.6.18 (ahead of print)











