La dépression est fréquente dans diverses maladies cérébrales et constitue un défi diagnostique. Une prévalence accrue, des mécanismes étiopathogéniques parfois spécifiques et des réponses différentes aux traitements antidépresseurs sont caractéristiques de l’accident vasculaire cérébral (AVC), de la maladie de Parkinson, de la sclérose en plaques, de l’épilepsie et de la maladie d’Alzheimer.
L’article suivant traite des différentes maladies cérébrales dans lesquelles la dépression est fréquente.
Accident vasculaire cérébral
Environ un tiers des patients développent ce que l’on appelle une dépression post-AVC (PSD) après un AVC [1, 2]. L’aphasie, l’anosognosie, l’alexithymie et les troubles cognitifs peuvent rendre difficile l’exploration clinique et l’utilisation d’échelles d’auto-évaluation standardisées. Les comportements observables tels que les expressions faciales, la tendance à pleurer, les pensées catastrophistes, etc. sont utiles pour le diagnostic [1]. Le tableau 1 donne un aperçu des facteurs de risque de DSP, tels que le degré de déficience physique, la gravité de l’AVC et la déficience cognitive [1, 3].

Le stress psychosocial lié à la rupture avec la vie antérieure et au handicap qui en résulte constitue une cause importante de la PSD. Les études visant à déterminer si des localisations spécifiques de l’infarctus entraînent un risque accru de DSP sont contradictoires [1, 3]. Des effets spécifiques à l’ischémie sont également discutés, mais les mécanismes sous-jacents ne sont pas encore élucidés. Une diminution des monoamines sérotonine, noradrénaline et dopamine due à l’ischémie est discutée [4]. Comme la présence d’une dépression multiplie également par environ 1,5 le risque de subir ultérieurement un AVC, il existe probablement une relation bidirectionnelle entre les deux maladies [3].
Le PSD répond bien aux antidépresseurs, même si les preuves actuelles sont encore assez faibles. Un traitement antidépresseur peut même avoir une influence favorable sur la neuroréhabilitation [4]. Les ISRS sont privilégiés en raison de leur profil d’effets secondaires plus favorable. Les données les plus solides concernent la fluoxétine et le citalopram [3]. Les études actuelles vont plutôt à l’encontre d’un traitement antidépresseur préventif souvent discuté après un AVC [3, 5]. Jusqu’à présent, aucune preuve de l’efficacité des psychothérapies n’a été trouvée.
Maladie de Parkinson
Environ 35 à 40% des patients atteints de la maladie de Parkinson développent des symptômes dépressifs au cours de la maladie. Ceux-ci peuvent précéder le développement de symptômes moteurs. Les troubles anxieux sont également plus fréquents. En raison du chevauchement de symptômes tels que l’hypomimie, le ralentissement moteur, la fatigue, les troubles du sommeil et la perte de poids, le diagnostic est difficile et l’utilisation d’échelles de symptômes cliniques telles que l’inventaire de dépression de Beck (BDI) et l’échelle de dépression d’Hamilton (HAMD) est recommandée [6, 7].
Des projections noradrénergiques et sérotoninergiques réduites à partir du locus coeruleus et du noyau raphé pourraient jouer un rôle dans la pathogenèse [8].
Il existe peu d’études de qualité sur l’efficacité des antidépresseurs. L’efficacité des tricycliques (TZA) est mieux établie que celle des ISRS [6]. Cependant, en raison du risque accru de chute dû à la sédation et aux effets anticholinergiques, et donc du risque d’aggravation des symptômes cognitifs au cours de l’évolution, les ISRS doivent être préférés et l’utilisation des TZA doit être bien pesée [3, 7]. Une nouvelle étude en double aveugle contrôlée par placebo a montré une bonne efficacité et une bonne tolérance de la paroxétine et de la venlafaxine [9]. Bien que les symptômes non moteurs répondent généralement assez mal aux agonistes dopaminergiques [8], le pramipexole a montré de bons effets sur la dépression légère à modérée [10]. Les données sur l’efficacité d’une psychothérapie sont insuffisantes, mais il existe des preuves d’un effet antidépresseur de la thérapie cognitivo-comportementale (TCC) [3].
Sclérose en plaques (SEP)
On estime que la prévalence des troubles dépressifs au cours de la vie peut atteindre 50% chez les patients atteints de SEP. Jusqu’à un quart des patients atteints de SEP développent des pensées suicidaires, la dépression étant un facteur prédictif important. Dans le cas de la SEP, le diagnostic de dépression est également difficile en raison de symptômes qui se chevauchent, tels que la fatigue, les troubles du sommeil, de l’appétit et de la mémoire et de la concentration, et peut être amélioré par des échelles d’auto-évaluation comme le BDI [3, 11].
Le stress lié à la maladie invalidante est un facteur psychosocial, mais aucune association n’a été trouvée avec le degré d’invalidité et la durée de la maladie. Ce sont plutôt les stratégies de coping qui jouent un rôle, avec un risque accru de coping centré sur l’émotion par rapport à celui centré sur l’action [11]. On estime que les lésions cérébrales globales de la maladie entraînent une vulnérabilité généralement accrue des systèmes émotionnels. Il existe également des preuves d’une mauvaise régulation de l’axe du stress entre l’hypothalamus, l’hypophyse et le cortex surrénalien (axe HPA). Les études sur la dépendance des symptômes dépressifs à la distribution des lésions n’ont pas permis de trouver des modèles cohérents. En revanche, des associations ont été trouvées entre la dépression et un volume lésionnel plus important au niveau frontal gauche, ainsi qu’une atrophie cérébrale régionale au niveau temporal gauche [3, 11].
La dépression peut être un effet secondaire du traitement médicamenteux à l’interféron bêta. Le principal facteur de risque est l’existence d’épisodes dépressifs avant le traitement. Les symptômes dépressifs répondent bien au traitement antidépresseur, il n’est donc généralement pas nécessaire d’interrompre le traitement [12].
En ce qui concerne le traitement pharmacologique, il existe encore peu de données probantes [13], mais l’utilisation d’antidépresseurs – plutôt des ISRS en raison de leur profil d’effets secondaires plus favorable – est fortement recommandée [14]. Les TCC centrées sur les stratégies d’adaptation et la réduction du stress par la pleine conscience se sont révélées efficaces [11, 14].
Épilepsie
Le risque de dépression est environ 1,4 fois plus élevé dans l’épilepsie, ce qui signifie que le taux de prévalence est plus élevé dans l’AVC, la maladie de Parkinson et la SEP. Le risque de suicide est cependant jusqu’à 10 fois plus élevé dans l’épilepsie, selon les études, ce qui confère à la détection et au traitement de la dépression une importance majeure dans la prévention du suicide [15, 16]. Avant ou après une crise, une détérioration aiguë de l’humeur peut survenir pendant des heures ou des jours, ce qui doit être distingué d’une dépression clinique [15].
L’étiopathogénie repose sur un modèle multifactoriel de diathèse-stress, l’épilepsie créant un état de stress chronique. L’impuissance apprise et l’imprévisibilité des crises sont des facteurs psychologiques qui jouent un rôle [3, 15]. Des études sur l’axe HPA ont montré que, comme dans la dépression, il est dérégulé dans l’épilepsie – en particulier l’épilepsie du lobe temporal [3, 17]. En outre, la privation précoce dans le modèle animal entraîne à la fois une prévalence accrue de comportements dépressifs et une épileptogenèse accrue. Des changements similaires dans le métabolisme du glutamate et du GABA peuvent également être trouvés dans les modèles animaux des deux maladies [17].
Les ISRS sont efficaces, bien que, là encore, les bonnes études contrôlées par placebo soient encore trop peu nombreuses. Cependant, en raison du risque accru de suicide dans l’épilepsie avec dépression comorbide, l’utilisation des ISRS est fortement recommandée [15]. Les programmes de TCC spécifiques à l’épilepsie et la thérapie d’acceptation et d’engagement (ACT) se sont également révélés efficaces, une réduction de la fréquence des crises ayant même été démontrée [3, 15].
Les antiépileptiques peuvent avoir un effet sur les symptômes psychiatriques, en particulier sur l’humeur (tableau 2). Le topiramate, le vigabatrin, le lévétiracétam, la tiagabine et le zonisamide sont plutôt associés à des effets négatifs, tandis que la gabapentine, la prégabaline, le lacosanide, le valproate, la carbamazépine et la lamotrigine sont associés à des effets positifs [18]. En cas de dépression comorbide, il est recommandé, si possible, de passer à un anticonvulsivant stabilisant l’humeur et ayant un effet positif [19].

Une mise en garde antérieure de l’Agence américaine des produits alimentaires et médicamenteux (FDA) concernant une possible augmentation du risque de suicide lié au traitement antiépileptique a depuis été relativisée en raison de données non convaincantes [20].
Démence, en particulier la maladie d’Alzheimer
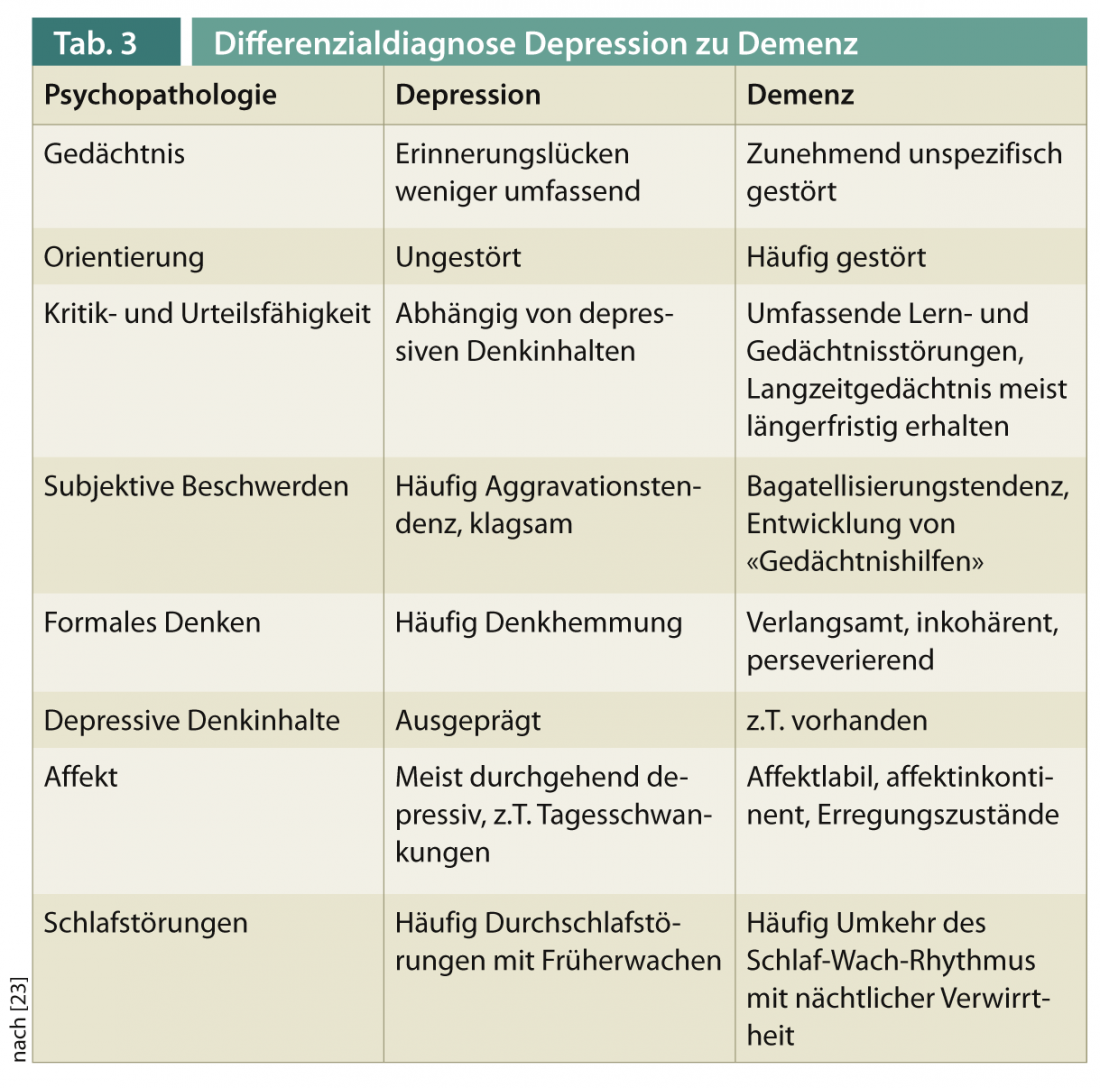
Le diagnostic différentiel entre la démence avec symptômes dépressifs secondaires et la dépression avec troubles cognitifs secondaires est un défi clinique chez les patients âgés. Le tableau 3 donne un aperçu des caractéristiques psychopathologiques permettant de les distinguer.
Dans la maladie d’Alzheimer, les troubles neuropsychiatriques (TNP) sont souvent présents, les plus fréquents étant l’apathie et les symptômes dépressifs. Les NPS jouent également un rôle prodromique : par exemple, les patients présentant une déficience cognitive légère et des NPS ont un risque beaucoup plus élevé de développer ultérieurement une maladie d’Alzheimer que ceux qui ne présentent pas de NPS [21]. Les NPS chez les personnes âgées sont souvent les premiers signes de l’évolution de la démence, le plus prononcé étant la démence fronto-temporale [22].
D’autre part, la dépression est un facteur de risque pour les maladies démentielles ; le nombre d’épisodes dépressifs est par exemple en corrélation avec l’apparition ultérieure d’une maladie d’Alzheimer [23].
On espère qu’à l’avenir, de meilleurs concepts fondés sur la physiopathologie permettront de les différencier. Par exemple, dans la démence d’Alzheimer (comme dans la maladie de Parkinson), on observe une réduction des neurones noradrénergiques dans le locus coeruleus, ce qui pourrait jouer un rôle dans le développement de symptômes affectifs [23, 24].
La distinction entre la dépression à un âge avancé et les symptômes dépressifs en tant que NPS de la maladie d’Alzheimer est d’autant plus importante qu’il n’existe que peu de preuves de l’efficacité des médicaments antidépresseurs dans la maladie d’Alzheimer [21, 25], alors que l’efficacité des antidépresseurs et du traitement psychothérapeutique de la dépression à un âge avancé est bien établie. [23]. En raison de leur meilleure tolérance, les ISRS sont préférables en cas de symptômes dépressifs de la maladie d’Alzheimer. Les NPS dans la maladie d’Alzheimer répondent modérément aux antipsychotiques. Leur utilisation doit cependant être soigneusement évaluée en raison des effets secondaires potentiellement graves [21].
Dr. med. Christian Imboden
Littérature :
- Carota A, Bogousslavsky J : Troubles de l’humeur après un accident vasculaire cérébral. Front Neurol Neurosci 2012 ; 30 : 70-74.
- Kouwenhoven SE, Kirkevold M, Engedal K, Kim HS : Depression in acute stroke : prevalence, dominant symptoms and associated factors. Une revue systématique de la littérature. Disabil Rehabil 2011 ; 33(7) : 539-556.
- Piber D, Hinkelmann K, Gold SM, Heesen C, Spitzer C, Endres M, et al : Dépression et maladies neurologiques. Nervenarzt 2012 ; 83(11) : 1423-1433.
- Loubinoux I, Kronenberg G, Endres M, Schumann-Bard P, Freret T, Filipkowski RK, et al. : Post-stroke depression : mechanisms, translation and therapy. J Cell Mol Med 2012 ; 16(9) : 1961-1969.
- Hackett ML, Anderson CS, House AO, Xia J : Interventions for Treating Depression After Stroke. Accident vasculaire cérébral 2009 May 14.
- 6. Tan LC : Mood disorders in Parkinson’s disease. Parkinsonism Relat Disord 2012 ; 18 Suppl 1 : S74-S76.
- Schwarz J, Odin P, Buhmann C, Csoti I, Jost W, Wullner U, et al : Depression in Parkinson’s disease. J Neurol 2011 ; 258 (Suppl 2) : S336-S338.
- Prediger RD, Matheus FC, Schwarzbold ML, Lima MM, Vital MA : Anxiety in Parkinson’s disease : a critical review of experimental and clinical studies. Neuropharmacologie 2012 ; 62(1) : 115-124.
- Richard IH, McDermott MP, Kurlan R, Lyness JM, Como PG, Pearson N, et al : A randomized, double-blind, placebo-controlled trial of antidepressants in Parkinson disease. Neurology 2012 ; 78(16) : 1229-1236.
- Barone P, Poewe W, Albrecht S, Debieuvre C, Massey D, Rascol O, et al : Pramipexole for the treatment of depressive symptoms in patients with Parkinson’s disease : a randomised, double-blind, placebo-controlled trial. Lancet Neurol 2010 ; 9(6) : 573-580.
- Feinstein A : Sclérose en plaques et dépression. Mult Scler 2011 ; 17(11) : 1276-1281.
- Feinstein A, O’Connor P, Feinstein K : Multiple sclerosis, interferon beta-1b and depression A prospective investigation. J Neurol 2002 ; 249(7) : 815-820.
- Koch MW, Glazenborg A, Uyttenboogaart M, Mostert J, De Keyser J : Pharmacologic treatment of depression in multiple sclerosis. Cochrane Database Syst Rev 2011 Feb 16 ;(2)(2):CD007295.
- Skokou M, Soubasi E, Gourzis P : Depression in multiple sclerosis : a review of assessment and treatment approaches in adult and pediatric populations. ISRN Neurol 2012 ; 2012 : 427102.
- Hoppe C, Elger CE : Depression in epilepsy : a critical review from a clinical perspective. Nat Rev Neurol 2011 ; 7(8) : 462-472.
- Bagary M : Epilepsie, médicaments antiépileptiques et suicidalité. Curr Opin Neurol 2011 ; 24(2) : 177-182.
- Kanner AM : Dépression et épilepsie : une relation bidirectionnelle ? Epilepsia 2011 ; 52 Suppl 1 : 21-27.
- Piedad J, Rickards H, Besag FM, Cavanna AE : Effets psychotropes bénéfiques et néfastes des médicaments antiépileptiques chez les patients atteints d’épilepsie : un résumé de la prévalence, des mécanismes sous-jacents et des limites des données. CNS Drugs 2012 ; 26(4) : 319-335.
- Pauli E, Stefan H : Troubles émotionnels et affectifs dans l’épilepsie. Neurologue 2009 ; 80(6) : 729-744.
- Fountoulakis KN, Gonda X, Samara M, Siapera M, Karavelas V, Ristic DI, et al. : Médicaments antiépileptiques et suicidalité. J Psychopharmacol 2012 ; 26(11) : 1401-1407.
- Lyketsos CG, Carrillo MC, Ryan JM, Khachaturian AS, Trzepacz P, Amatniek J, et al : Neuropsychiatric symptoms in Alzheimer’s disease. Alzheimers Dement 2011 ; 7(5) : 532-539.
- Taragano FE, Allegri RF, Krupitzki H, Sarasola DR, Serrano CM, Lon L, et al : Mild behavioral impairment and risk of dementia : a prospective cohort study of 358 patients. J Clin Psychiatry 2009 ; 70(4) : 584-592.
- Hatzinger M : Troubles affectifs chez les personnes âgées. Archives suisses de neurologie et de psychiatrie 2011 ; 162(5) : 179-189.
- Szot P : Facteurs communs à la maladie d’Alzheimer, à la maladie de Parkinson et à l’épilepsie : rôle possible du système nerveux noradrénergique. Epilepsia 2012 ; 53 Suppl 1 : 61-66.
- Even C, Weintraub D : Case for and against specificity of depression in Alzheimer’s disease. Psychiatrie Clin Neurosci 2010 ; 64(4) : 358-366.
InFo NEUROLOGIE & PSYCHIATRIE 2013 ; 11(1) : 9-12