I nuovi anticoagulanti orali (NOAK) sono entrati da tempo nella pratica clinica quotidiana della profilassi dell’ictus per la fibrillazione atriale. Grazie al loro uso più semplice, sicuro ed efficace, si prevede che sostituiranno la terapia con antagonisti della vitamina K (VKA) nella maggior parte dei pazienti. Tuttavia, come per qualsiasi terapia, ci sono alcuni importanti aspetti pratici che devono essere considerati per un uso corretto e sicuro. L’uso non selettivo delle sostanze deve essere evitato in ogni caso.
Gli ampi studi di registrazione dei nuovi anticoagulanti orali (NOAK) per la profilassi della tromboembolia nella fibrillazione atriale – RE-LY (dabigatran) [1], ROCKET-AF (rivaroxaban) [2], ARISTOTLE (apixaban) [3] e ENGAGE-TIMI 48 (edoxaban) [4] – hanno dimostrato, che queste sostanze non solo sono almeno equivalenti, se non superiori, agli antagonisti della vitamina K (VKA) in termini di prevenzione dell’ictus, ma riducono anche in modo significativo il rischio di emorragie gravi e/o intracraniche. [5–7]. Uno degli errori più gravi, tuttavia, è quello di considerare queste sostanze in modo indiscriminato, come farmaci “unici” e di utilizzarle in modo acritico e non selettivo. Questo articolo riassume dieci aspetti importanti nell’applicazione quotidiana (basandosi e integrando il lavoro precedente [5–9]).
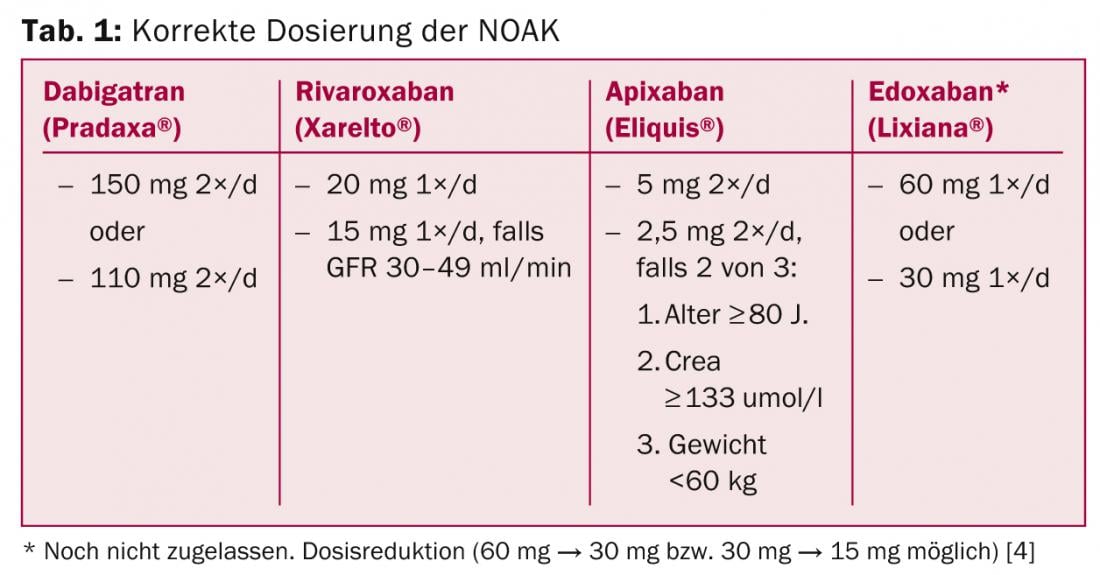
Domanda 1: Qual è il dosaggio corretto?
La Tabella 1 riassume il dosaggio corretto dei NOAK. Le deviazioni da questo sono usi “off label” e devono essere evitate, poiché non sono disponibili dati al riguardo (ad esempio, prescrivere 10 mg di rivaroxaban in pazienti con VCF e “alto rischio di sanguinamento”). La terapia iniziale è molto più semplice rispetto a quella con VKA, in quanto l’effetto completo si verifica dopo due o tre ore – senza la necessità di un ponte con eparina o NMH.
Domanda 2: Cosa devo fare se dimentico una dose?
La compliance/aderenza ai farmaci è fondamentale con le NOAK e non bisogna perdere l’occasione di ricordarlo al paziente. Tuttavia, gli errori di dosaggio si verificano naturalmente nella pratica clinica quotidiana. Sulla base di estrapolazioni farmacocinetiche, si raccomanda di assumere una dose mancata fino a sei ore (per il dosaggio 2×/d, cioè apixaban/dabigatran) o fino a dodici ore (per il dosaggio 1×/d, cioè rivaroxaban) dopo la dose prevista [10]. Se l’errore viene notato solo dopo questa finestra temporale, la dose deve essere saltata e continuare con la dose successiva programmata.
Domanda 3: Cosa fare in caso di doppia assunzione accidentale?
Per i NOAK assunti 2×/d, in caso di doppia somministrazione accidentale, la dose successiva prevista deve essere saltata e il ciclo regolare deve essere ripreso con la dose successiva a [10]. Con il dosaggio 1×/d, si deve continuare il ciclo normale, poiché dopo 24 ore, anche con un doppio dosaggio accidentale, gran parte della sostanza viene già eliminata di nuovo.
Domanda 4: Cosa succede se il paziente non è sicuro dell’assunzione?
Non è raro che nella vita di tutti i giorni si verifichino situazioni in cui il paziente non è sicuro di aver già assunto i farmaci o meno. Per i NOAK assunti 2 volte al giorno, si raccomanda di non assumere un’altra dose (per evitare un sovradosaggio, dato che la dose successiva viene comunque assunta entro 12 ore). Con l’assunzione 1×/d, invece, si raccomanda di assumere la dose potenzialmente dimenticata più tardi, poiché l’assunzione successiva non avverrà prima di 24 ore, il che altrimenti comporterebbe un periodo più lungo senza una protezione rilevante [10].
Domanda 5: Come vengono utilizzati i NOAK nell’insufficienza renale?
I pazienti con insufficienza renale rappresentano una popolazione difficile, in quanto le complicanze tromboemboliche ed emorragiche sono più frequenti [11, 12]. Nell’insufficienza renale grave e nella fibrillazione atriale, i NOAK non sono stati praticamente studiati e di conseguenza non dovrebbero essere utilizzati (anche se sono parzialmente approvati anche in questo caso) [13]. Il problema è trovare una buona alternativa – perché i VKA sono formalmente controindicati anche in caso di grave compromissione della funzionalità renale. Infatti, è stato dimostrato che il beneficio della VKA diminuisce con una funzione renale sempre più compromessa [14]. Tuttavia, i VKA sembrano attualmente l’opzione migliore per i pazienti con fibrillazione atriale e insufficienza renale grave – tenendo conto dei rischi sopra menzionati. In questo caso, un’impostazione ottimale dell’INR è più che mai cruciale.
Il dosaggio di apixaban (50% di clearance renale della sostanza assorbita) e rivaroxaban (37% di clearance renale) è ridotto in caso di funzione renale moderatamente compromessa (GFR 50 – 30 ml/min). (Tab. 1). Entrambi gli agenti hanno dimostrato di essere efficaci e sicuri in questo gruppo di pazienti (rispetto alla VKA), con apixaban in particolare che ha dimostrato un ottimo profilo di sicurezza rispetto alla VKA [11, 15]. Soprattutto in presenza di altri fattori di rischio per il sanguinamento (come età ≥ 80 anni, punteggio HAS-BLED ≥ 3), si raccomanda di ridurre la dose di dabigatran (80% di clearance renale) a 2 × 110 mg/d da un GFR <50 ml/min [13]. In linea di principio, l’uso di dabigatran nei pazienti con un GFR <40 ml/min deve essere ben considerato, in quanto l’esperienza ha dimostrato che in questi pazienti può verificarsi rapidamente un ulteriore deterioramento della funzione renale con relativo accumulo della sostanza, ad esempio nel contesto di malattie intercorrenti, co-medicazione (FANS!) o disidratazione.
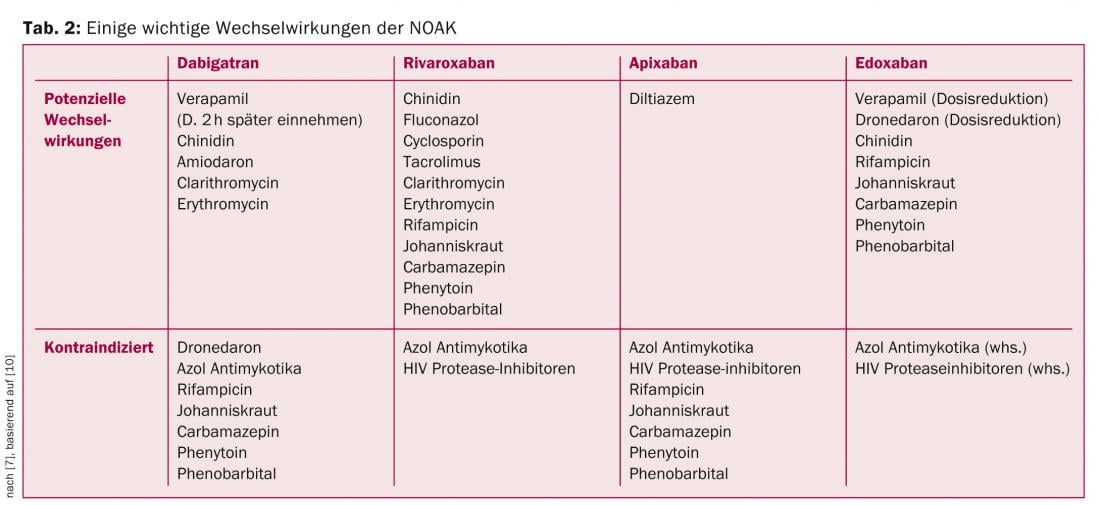
Domanda 6: Ci sono interazioni con altri farmaci?
Sebbene i NOAK abbiano un potenziale di interazioni farmaco-farmaco molto più basso rispetto ai VKA, ci sono alcune interazioni importanti di cui essere consapevoli. Alcune delle interazioni più importanti sono riassunte nella Tabella 2, basata sulle raccomandazioni dell’EHRA [10].
Domanda 7: Qual è la procedura per il sanguinamento sotto le NOAK?
Le complicazioni emorragiche, in particolare l’emorragia intracranica e quella pericolosa per la vita, si verificano molto meno frequentemente con i NOAK rispetto ai VKA.
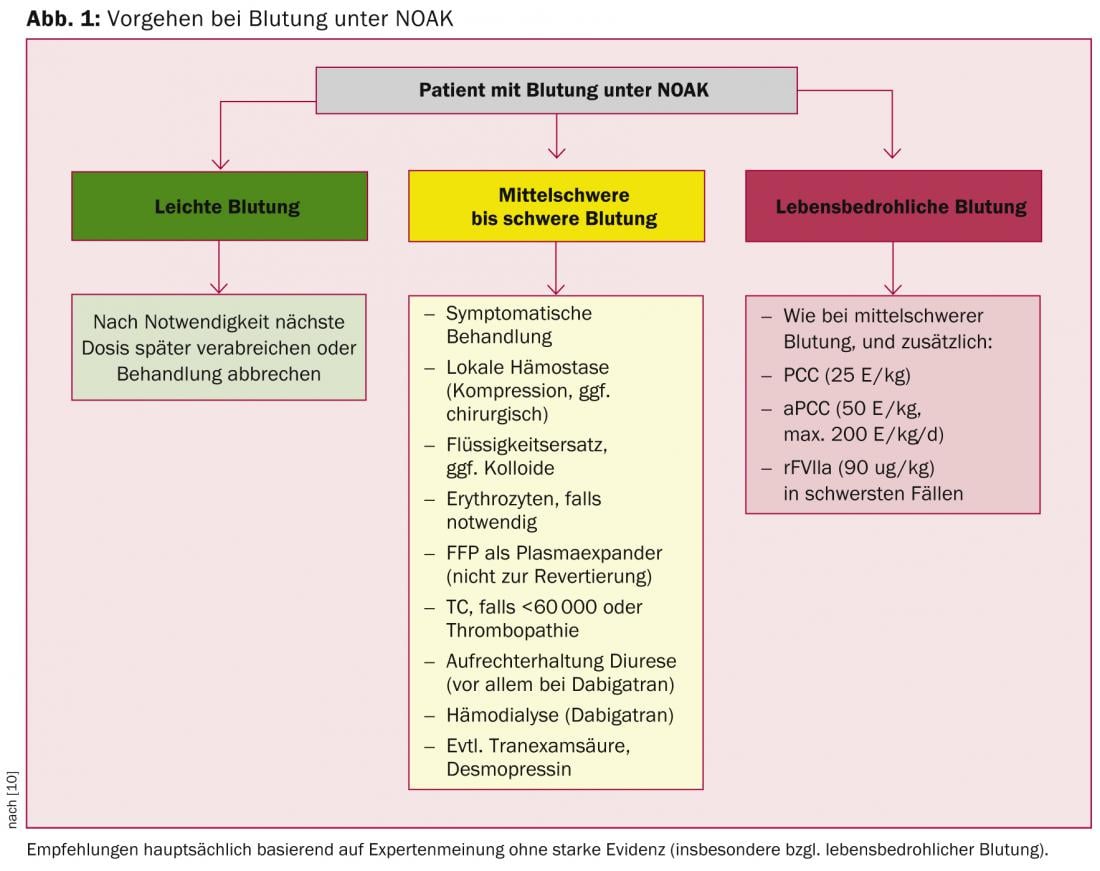
Sono in fase di sviluppo antidoti specifici ad azione rapida per le NOAK; tuttavia, molto probabilmente ci vorranno diversi anni prima che vengano introdotti nella pratica clinica. Di conseguenza, per un’antagonizzazione rapida si devono utilizzare procoagulanti non specifici come PCC, aPCC o FVIIa ricombinante. Questa situazione non è del tutto dissimile da quella con la VKA, poiché anche in questo caso l’antagonizzazione “specifica” mediante la vitamina K è tutt’altro che rapidamente efficace nella situazione di emergenza. In linea di principio, l’antagonismo dell’anticoagulazione – sia con VKA che con NOAK – non è privo di rischi, in quanto induce uno stato procoagulante. Pertanto, la normalizzazione dei parametri di coagulazione non è necessariamente correlata a un miglioramento dell’esito clinico, soprattutto dopo un’emorragia intracranica [16–18]. Le raccomandazioni dell’EHRA, che si basano principalmente su dati preclinici ed estrapolazioni farmacocinetiche, tengono conto di questo fatto (Fig. 1) [10]. Di conseguenza, l’uso di procoagulanti è consigliato solo nei casi di emorragia grave e pericolosa per la vita, mentre le misure generali sono utilizzate principalmente nei casi di emorragia lieve e moderata.
Domanda 8: Qual è la procedura migliore per la “tripla anticoagulazione”?
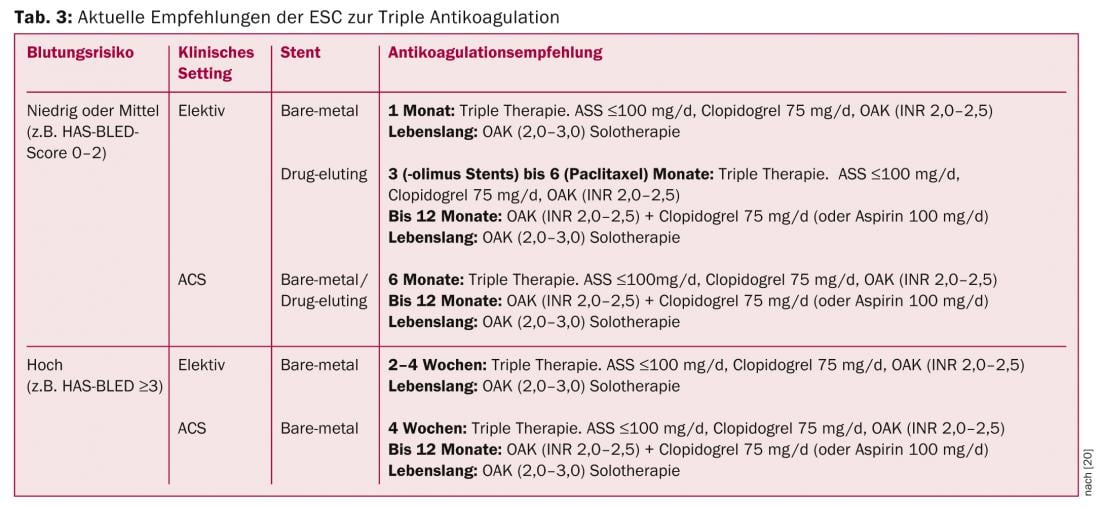
I pazienti con fibrillazione atriale che richiedono formalmente una doppia terapia antiaggregante (la cosiddetta “tripla anticoagulazione”) oltre all’anticoagulazione plasmatica (NOAK/VKA) a causa di un’ACS e/o dell’impianto di uno stent, hanno un rischio notevolmente aumentato di gravi emorragie [19]. Attualmente, a parte alcuni pazienti dello studio RE-LY, non ci sono dati sull’uso dei NOAK in combinazione con aspirina e clopidogrel. Allo stesso modo, non sono disponibili dati sulla combinazione dei NOAK con gli antagonisti del recettore ADP di nuova generazione, prasugrel e ticagrelor. Pertanto, la combinazione di queste sostanze deve essere attualmente sconsigliata. Si prevede che le raccomandazioni saranno ulteriormente modificate in base all’emergere di nuovi dati, sia sugli stent di ultima generazione che sulla combinazione di NOAK e dei nuovi farmaci antipiastrinici. Attualmente, tuttavia, l’approccio proposto nelle linee guida ESC che prevede l’uso di ASA, clopidogrel e VKA sembra essere l’alternativa migliore (Tabella 3) [20]. Nello studio WOEST, pubblicato di recente, la combinazione di clopidogrel e VKA si è dimostrata superiore alla classica “tripla anticoagulazione” – sia in termini di eventi di sanguinamento che di endpoint ischemici [21]. Nella vita quotidiana, la durata della “tripla anticoagulazione” originariamente raccomandata nelle linee guida ESC è quindi già significativamente ridotta, a seconda del contesto clinico.
Domanda 9: I NOAK possono essere utilizzati nella cardioversione?
I dati migliori sulla cardioversione con NOAK sono disponibili per dabigatran (dallo studio RE-LY): Quest’ultimo è stato altrettanto efficace della VKA in termini di ictus ed emorragie [22]. Per rivaroxaban e apixaban, i numeri di pazienti pubblicati finora sono più piccoli, ma puntano nella stessa direzione. Il fattore decisivo nella vita quotidiana è la conformità! Se ci si può assicurare che il paziente abbia assunto regolarmente il NOAK nelle tre (preferibilmente quattro o cinque) settimane precedenti, la cardioversione con NOAK sembra essere fattibile in modo sicuro [10]. Altrimenti, si deve escludere un trombo con la TEE. Gli studi e i registri in corso forniranno ulteriori dati sulla procedura ottimale.
Domanda 10: Come funziona la gestione perioperatoria?
Grazie alla farmacocinetica dei NOAK, non è necessario un ponte perioperatorio (cosa che viene praticata sempre più raramente anche per i VKA). La raccomandazione di interrompere il NOAK si basa sul rischio di sanguinamento della procedura e sulla funzione renale (maggiore influenza con dabigatran); Scheda. 4).
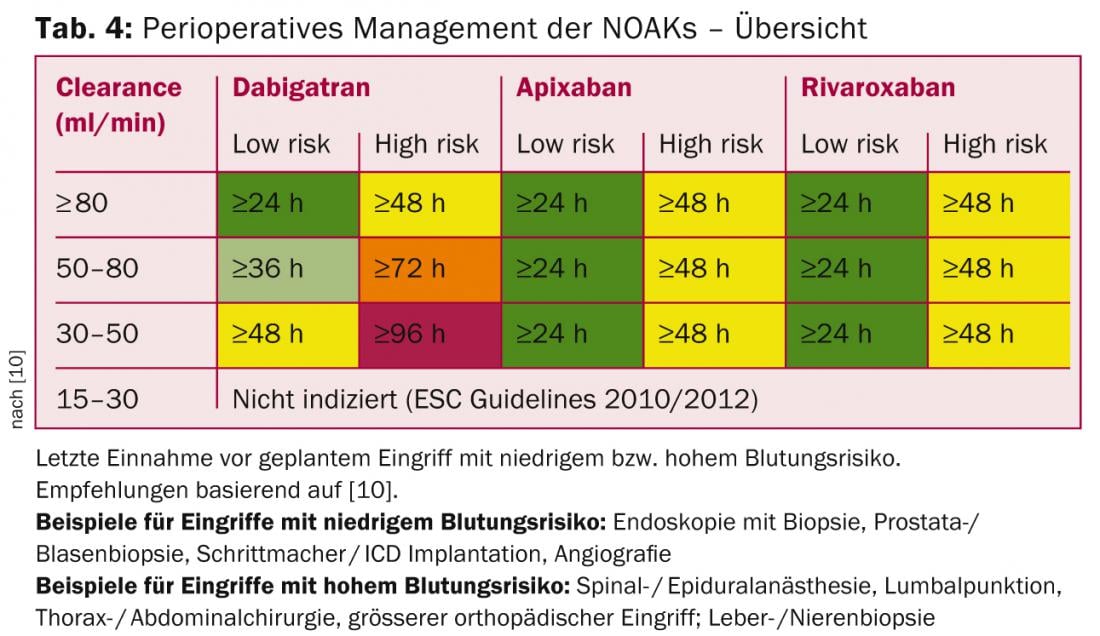
Per le procedure con un rischio di sanguinamento molto basso (interventi odontoiatrici, cataratta, glaucoma, endoscopia senza intervento), la procedura può di solito essere eseguita al livello minimo del NOAK (cioè prima della dose successiva prevista), con la dose successiva presa sei ore dopo (se l’emostasi è buona) [10].
Dopo la procedura, il NOAK può essere riavviato dopo sei-otto ore in caso di emostasi diretta o completa. Per le procedure più importanti, dove esiste ancora un rischio di sanguinamento, può essere necessario attendere due o tre giorni prima di ricominciare. In queste situazioni, l’eparina non frazionata o a basso peso molecolare deve essere iniziata con una dose profilattica da sei a otto ore dopo l’intervento. Dopo un’emostasi sicura, il passaggio al NOAK avviene a dosaggio pieno.
Sommario
Grazie ai risultati convincenti degli studi e alla facilità d’uso, i NOAK sono entrati da tempo nella pratica clinica quotidiana della profilassi dell’ictus nella fibrillazione atriale. Per molte delle raccomandazioni pratiche citate non sono disponibili dati provenienti da studi randomizzati. Tuttavia, si verificano nella vita di tutti i giorni, per cui sono necessarie raccomandazioni su come affrontare al meglio queste situazioni, basate sul parere di esperti come la dettagliata Guida pratica dell’EHRA [10]. Per uno studio più dettagliato, si rimanda a questa e ad altre ulteriori pubblicazioni [6, 7, 10].
PD Jan Steffel, MD
Dichiarazioni sul conflitto di interessi: il PD Dr med Jan Steffel ha ricevuto consulenze e/o onorari per conferenze da AstraZeneca, Bayer HealthCare, Boehringer Ingelheim, Bristol-Myers Squibb, Daiichi Sankyo, Pfizer e Roche.
Letteratura:
- Connolly SJ, et al: Dabigatran rispetto a warfarin nei pazienti con fibrillazione atriale. N Engl J Med 2009; 361: 1139-1151.
- Patel MR, et al: Rivaroxaban rispetto a warfarin nella fibrillazione atriale non valvolare. N Engl J Med 2011; 365: 883-891.
- Granger CB, et al: Apixaban rispetto a warfarin nei pazienti con fibrillazione atriale. N Engl J Med 2011; 365: 981-992.
- Giugliano RP, et al: Edoxaban rispetto a warfarin nei pazienti con fibrillazione atriale. N Engl J Med 2013.
- Steffel J, Braunwald E: Nuovi anticoagulanti orali: focus sulla prevenzione dell’ictus e sul trattamento del trombo-embolismo venoso. Eur Heart J 2011; 32: 1968-1976.
- Steffel J, Brunckhorst C: Profilassi dell’ictus nella fibrillazione atriale. Brema: UniMed; 2012.
- Steffel J, et al: Prevenzione dell’ictus nella fibrillazione atriale. Brema: UniMed; 2014 (in stampa).
- Steffel J: Nuovi anticoagulanti: prevenzione e trattamento degli eventi tromboembolici. Leading Opinions Cardiology + Vascular Medicine 2011; 2: 14-19.
- Steffel J: I nuovi anticoagulanti – aspetti pratici nell’applicazione. Leading Opinions Cardiology + Vascular Medicine 2012; 2: 10-14.
- Heidbuchel H, et al: Guida pratica dell’Associazione europea per il ritmo cardiaco sull’uso dei nuovi anticoagulanti orali nei pazienti con fibrillazione atriale non valvolare. Europace 2013; 15: 625-651.
- Steffel J, Hindricks G: Apixaban nell’insufficienza renale: una navigazione di successo tra scilla e cariddi. Eur Heart J 2012; 33: 2766-2768.
- Steffel J: Nuovi anticoagulanti orali nella funzione renale compromessa e nella dialisi. Leading Opinions Nephrology 2013; 2: 73-75.
- Camm AJ, et al: Aggiornamento mirato del 2012 delle linee guida esc per la gestione della fibrillazione atriale: un aggiornamento delle linee guida esc del 2010 per la gestione della fibrillazione atriale. Sviluppato con il contributo speciale dell’Associazione Europea del Ritmo Cardiaco. Europace 2012.
- Marinigh R, Lane DA, Lip GY: Grave insufficienza renale e prevenzione dell’ictus nella fibrillazione atriale: implicazioni per la tromboprofilassi e il rischio di sanguinamento. J Am Coll Cardiol 2011; 57: 1339-1348.
- Hohnloser SH, et al.: Efficacia di apixaban rispetto a warfarin in relazione alla funzione renale nei pazienti con fibrillazione atriale: Insights from the aristotle trial. Eur Heart J 2012.
- Dowlatshahi D, et al: prognosi sfavorevole nell’emorragia intracranica associata a warfarin, nonostante l’inversione dell’anticoagulazione. Stroke 2012; 43: 1812-1817.
- Lee SB, et al: Progressione dell’emorragia intracerebrale associata a warfarin dopo la normalizzazione dell’inr con ffp. Neurologia 2006; 67: 1272-1274.
- Kuwashiro T, et al: Effetto del concentrato di complesso protrombinico sull’ingrandimento dell’ematoma e sull’esito clinico nei pazienti con emorragia intracerebrale associata ad anticoagulanti. Cerebrovasc Dis 2011; 31: 170-176.
- Sourgounis A, et al: Stent coronarici e anticoagulazione cronica. Circolazione 2009; 119: 1682-1688.
- Camm AJ, et al: Linee guida per la gestione della fibrillazione atriale: la task force per la gestione della fibrillazione atriale della Società Europea di Cardiologia (esc). Europace 2010; 12: 1360-1420.
- Dewilde WJ, et al: Uso di clopidogrel con o senza aspirina nei pazienti che assumono una terapia anticoagulante orale e si sottopongono a un intervento coronarico percutaneo: uno studio controllato, randomizzato e in aperto. Lancet 2013; 381: 1107-1115.
- Nagarakanti R, et al: Dabigatran rispetto a warfarin nei pazienti con fibrillazione atriale: un’analisi dei pazienti sottoposti a cardioversione. Circolazione 2011; 123: 131-136.
CARDIOVASC 2014; 13(2): 12-16
PRATICA GP 2014; 9(6): 32-37