Un primo e finora unico coniugato anticorpo-farmaco mirato al BCMA è stato approvato in Svizzera dal giugno 2022 per il trattamento del mieloma multiplo in pazienti adulti pesantemente pretrattati che hanno avuto una progressione della malattia durante l’ultima terapia (1). Il trattamento ambulatoriale con monoterapia ha mostrato una risposta profonda e duratura e un profilo di sicurezza gestibile nello studio pivotal (2, 3).
Il mieloma multiplo (MM), che appartiene ai linfomi a cellule B, rappresenta circa il 10 % di tutti i tumori maligni ematologici (4). Le opzioni terapeutiche esistenti hanno permesso un aumento della sopravvivenza globale (OS) dei pazienti con MM negli ultimi anni, ma l’emergere di cloni resistenti porta ancora spesso al fallimento del trattamento. Con ogni trattamento successivo, la profondità e la durata della risposta si riducono; una parte dei pazienti diventa refrattaria agli inibitori del proteasoma (PI), agli immunomodulatori (IMID) e agli anticorpi monoclonali. Questi pazienti hanno opzioni terapeutiche limitate e, con una OS mediana di 5,6 mesi, una prognosi infausta (5). Ciò riflette l’urgente necessità di nuove opzioni terapeutiche con meccanismi d’azione innovativi (5). Negli studi pivotal DREAMM, il coniugato anticorpo-farmaco mirato al BCMA, belantamab mafodotin (BLENREP), ha mostrato una risposta buona e duratura nei pazienti refrattari multipli pesantemente pretrattati, soprattutto se misurata in base all’estensione del pretrattamento (2, 3, 6).
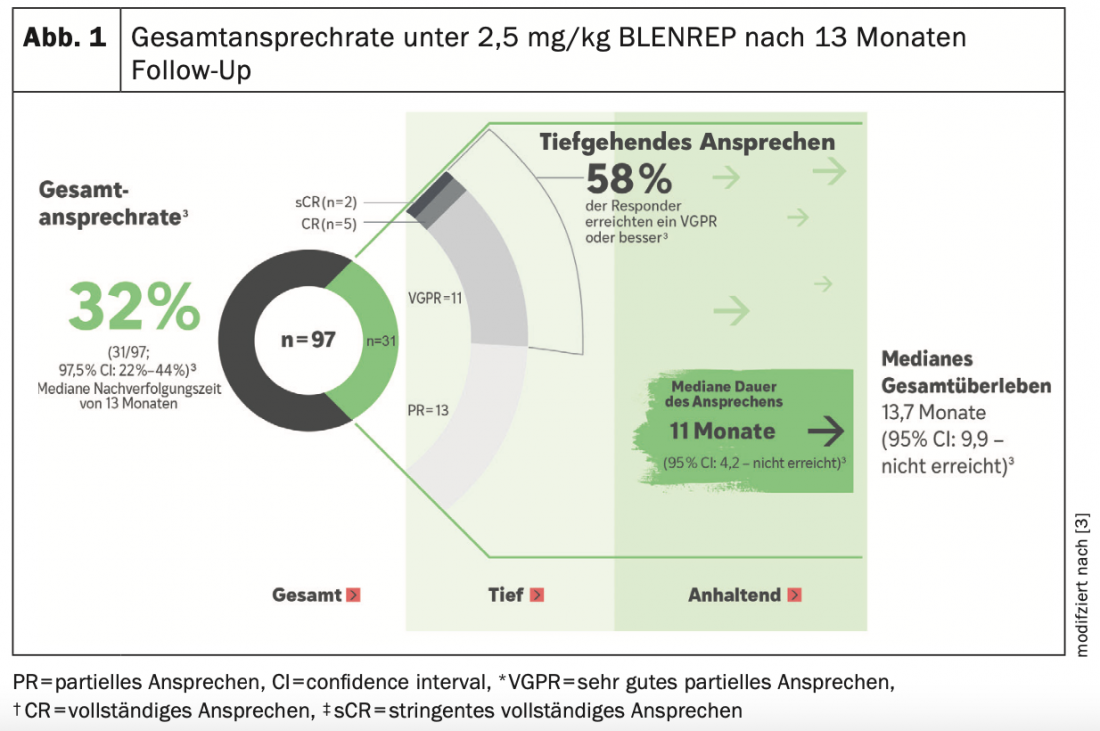
Risposta profonda e sostenuta con BLENREP nello studio DREAMM-2
Nello studio multicentrico, in aperto, a due bracci DREAMM-2, 97 pazienti la cui malattia era progressiva dopo ≥3 linee di terapia hanno ricevuto 2,5 mg/kg di BLENREP ogni 3 settimane come monoterapia fino alla progressione della malattia o a una tossicità inaccettabile (2, 3). Il tasso di risposta globale (ORR), valutato da un comitato indipendente, era l’endpoint primario ed era del 32 % (31/97; 97,5 % CI: 21,7 %-43,6 %) dopo un follow-up mediano di 13 mesi(Fig. 1) (3). La maggior parte (18/31; 58%) di questi responder ha beneficiato di una remissione parziale molto buona (VGPR*: n=11) o di una risposta ancora più profonda (CR*, sCR*; n=7). Gli endpoint secondari includevano la durata mediana della risposta (mDOR; 11 mesi [95 % CI: 4,2-NE]) e la OS mediana prevista (13,7 mesi [95 % CI, 9,9 mesi-non raggiunto]) nella popolazione complessiva. La risposta e la sopravvivenza dei pazienti con citogenetica associata al rischio o insufficienza renale è stata paragonabile ai risultati della popolazione complessiva (3).
Monitoraggio delle alterazioni corneali
Le reazioni avverse più comuni con BLENREP 2,5 mg/kg sono state la cheratopatia (72%, gravità ≥3 in 46 %) e la trombocitopenia (38 %, gravità ≥3 in 22 %). Gli effetti collaterali corneali hanno portato a un ritardo del trattamento nel 47 % dei pazienti, ma all’interruzione permanente del trattamento solo nel 3 %. Dopo 13 mesi, le alterazioni dell’acuità visiva si sono risolte nell’82 % dei pazienti; non è stata osservata alcuna perdita visiva permanente (3). Per monitorare gli effetti collaterali, viene eseguito un esame oftalmologico prima di iniziare il trattamento con BLENREP e prima dei primi tre cicli successivi. I pazienti devono anche evitare le lenti a contatto e utilizzare regolarmente sostituti lacrimali senza conservanti. Non appena si manifestano effetti collaterali a livello corneale, aggiusti il dosaggio di BLENREP o ritardi il trattamento (1). Sebbene le modifiche della dose (ritardi o riduzioni) siano state utilizzate frequentemente per la gestione degli effetti collaterali in questo studio, esse hanno avuto un impatto minimo sulla risposta secondo BLENREP (3).
Conclusione
BLENREP è stato approvato in Svizzera dal giugno 2022 come monoterapia per il trattamento del MM in pazienti adulti fortemente pretrattati con almeno quattro terapie precedenti, che hanno mostrato una progressione della malattia durante l’ultima terapia e la cui malattia è refrattaria ad almeno un inibitore del proteasoma, un immunomodulatore e un anticorpo monoclonale anti-CD38 (1). In particolare, i pazienti con un alto grado di pretrattamento possono quindi ora beneficiare della nuova opzione di trattamento, efficace e tollerabile.
Ulteriori informazioni
Responsabile del contenuto e finanziato da GlaxoSmithKline AG, Talstr. 3 – 5, CH-3053 Münchenbuchsee. Contatto: +41 31 862 21 11
I marchi sono di proprietà dei rispettivi titolari. ©2022 GSK group of companies o il suo licenziatario.
Brevi informazioni tecniche BLENREP®
PM-CH-BLM-ADVR-220012-10/2022
Letteratura
Contributo online dal 02.11.2022