Il trattamento dell’artrite reumatoide (RA) ha fatto grandi progressi negli ultimi 20 anni. Questo si riferisce sia alla gamma di farmaci disponibili che agli sviluppi in termini di rapidità d’azione e tassi di risposta. Gli inibitori della JAK hanno dimostrato di essere un’alternativa ai biologici, con alcuni vantaggi.
Il trattamento dell’artrite reumatoide (RA) ha fatto grandi progressi negli ultimi 20 anni. Questo si riferisce sia alla gamma di farmaci disponibili che agli sviluppi in termini di rapidità d’azione e tassi di risposta. Gli inibitori della JAK hanno dimostrato di essere un’alternativa ai biologici, con alcuni vantaggi.
Considerando la non facile gestione (necessità di raffreddamento, somministrazione parenterale), i biologici non sono la forma ottimale di terapia per tutti i pazienti, soprattutto perché solo una minoranza raggiunge una remissione clinica continua con essi. Il dolore, le limitazioni funzionali, la stanchezza e la depressione, invece, comportano un elevato carico di malattia per le persone colpite. Gli inibitori della JAK sono posizionati nel trattamento dell’artrite reumatoide dopo il fallimento del trattamento con csDMARDs o biologici.
La Lega Europea contro il Reumatismo (EULAR) ha raccomandato che i pazienti con una scarsa risposta ai csDMARDs (ad esempio, metotrexato, MTX) e una prognosi sfavorevole siano trattati con bDMARDs o con un inibitore JAK [1]. Se questo non porta a una risposta terapeutica, si deve provare a cambiare sostanza o classe (da bDMARD a JAKi o viceversa). Sia per i DMARD biologici che per quelli sintetici mirati (b/tsDMARD), si raccomanda la terapia di combinazione con un csDMARD. Se questo è escluso (ad esempio a causa di controindicazioni), l’EULAR consiglia di preferire gli inibitori di IL-6 e JAK ad altri bDMARD.
In Svizzera sono attualmente disponibili tre inibitori della JAK per il trattamento dell’AR: Tofacitinib, baricitinib e upadacitinib. Inoltre, il filgotinib è approvato in Germania dal 2020 e il peficitinib è disponibile sul mercato giapponese dal 2019, ma non può ancora essere utilizzato negli Stati Uniti o in Europa. Quando si sceglie l’inibitore JAK appropriato, la questione delle differenze specifiche del composto nell’efficacia e nel profilo di sicurezza è spesso di grande interesse per i fornitori di trattamenti.
Tofacitinib
La selettività degli inibitori JAK, cioè l’inibizione di singole isoforme ad una certa concentrazione intracellulare, è il fulcro degli studi. Si cerca quindi il rapporto ottimale tra efficacia ed effetti collaterali, come nel caso dell’anemia, ad esempio. Per tofacitinib, approvato in Svizzera dal 2013, un’analisi post-hoc dei pazienti sieropositivi e sieronegativi ha mostrato una risposta comparabile in entrambi i gruppi [2]. I tassi di remissione DAS28 erano leggermente inferiori rispetto ai pazienti con CCP. Nell’analisi, sono stati riuniti i dati di cinque studi di fase III e sono stati definiti dei sottogruppi in base alla sierologia: RF+CCP+, RF+CCP-, RF-CCP+ e RF-CCP-. Di conseguenza, i pazienti con RF+CCP+ avevano una maggiore probabilità di ottenere una risposta ACR-20, -50 o -70 rispetto ai pazienti RF-CCP. Questo risultato è stato dimostrato per la risposta ACR-20 e -50 sia per tofacitinib 5 mg due volte al giorno che per tofacitinib 10 mg due volte al giorno. Al contrario, la risposta ACR-70 era migliore solo con la dose più alta.
Un altro studio ha esaminato il rischio di eventi cardiovascolari con tofacitinib. La valutazione di uno studio di fase IV che ha confrontato tofacitinib con i bloccanti del TNF (adalimumab, etanercept) in pazienti di età superiore ai 50 anni e con almeno un fattore di rischio aggiuntivo per gli eventi cardiovascolari, ha dimostrato che il rischio di eventi tromboembolici associato a tofacitinib deve essere considerato aumentato.
Il rischio di embolia polmonare è aumentato in modo significativo con tofacitinib alla dose di 10 mg ed è stato anche più elevato con 5 mg due volte al giorno rispetto agli studi precedenti. Inoltre, la mortalità per tutte le cause era più alta con 10 mg due volte al giorno rispetto a 5 mg due volte al giorno. L’EMA ha quindi emesso una raccomandazione nel 2019, secondo la quale tofacitinib non dovrebbe essere utilizzato nei pazienti ad aumentato rischio di tromboembolismo. I pazienti con RA di età superiore ai 65 anni devono essere trattati con tofacitinib solo se non esiste un’alternativa terapeutica.
Upadacitinib
È stato effettuato un confronto tra upadacitinib e adalimumab e placebo nei pazienti MTX-IR con RA attiva nello studio SELECT-COMPARE [3]. In questo studio, c’era l’opzione di passare da upadacitinib ad adalimumab alla settimana 12 e viceversa (alle settimane 14, 18, 22 e 26) se il miglioramento delle articolazioni dolorose e gonfie era inferiore al 20% (endpoint co-primari ACR20 e DAS28-CRP <2,6).
Lo studio su 1629 pazienti con RA attiva nonostante MTX ha dimostrato che upadacitinib (approvato in Svizzera dalla primavera del 2020) era statisticamente più efficace di adalimumab: il 71% dei pazienti ha ottenuto una risposta ACR20 con upadacitinib, solo il 63% con adalimumab e il 36% con placebo. Il 29% dei pazienti ha raggiunto la remissione secondo il DAS28-CRP, rispetto a solo il 18% con adalimumab e il 6% con placebo. In termini di effetti collaterali, l’herper zoster e l’aumento della CK sono stati più frequenti con upadacitinib, mentre la tromboembolia venosa (VTE) si è verificata in 3 pazienti con adalimumab rispetto a 2 pazienti con upadacitinib. Osservando i non-responder, si è visto che il passaggio da upadacitinib ad adalimumab ha portato il 13% a raggiungere la remissione, mentre al contrario il passaggio da adalimumab a upadacitinib ha portato il 26% a raggiungere il risultato desiderato.
Nello studio SELECT-MONOTHERAPY, 648 pazienti con RA attiva nonostante l’MTX sono stati randomizzati alla continuazione della terapia con MTX o a upadacitinib 15 mg o 30 mg come monoterapia [4]. Anche in questo caso, è stata osservata una risposta significativamente migliore con upadacitinib: dopo 14 settimane, il 68% dei pazienti in terapia con upadacitinib 15 mg e il 71% in terapia con upadacitinib 30 mg ha ottenuto una risposta ACR20, rispetto a solo il 41% dei pazienti che hanno continuato la terapia con MTX.
Baricitinib
Baricitinib è stato approvato in Svizzera dal 2017 in una dose di 4 mg (2 mg nei pazienti anziani o nell’insufficienza renale). Negli studi clinici, il principio attivo una volta al giorno in dosi di 2 mg e 4 mg ha già dimostrato un’efficacia clinica significativa con una sicurezza accettabile negli ultimi anni [5,6]. Gli eventi avversi gravi (SUE) più frequentemente riportati durante il periodo controllato con placebo sono stati le infezioni.
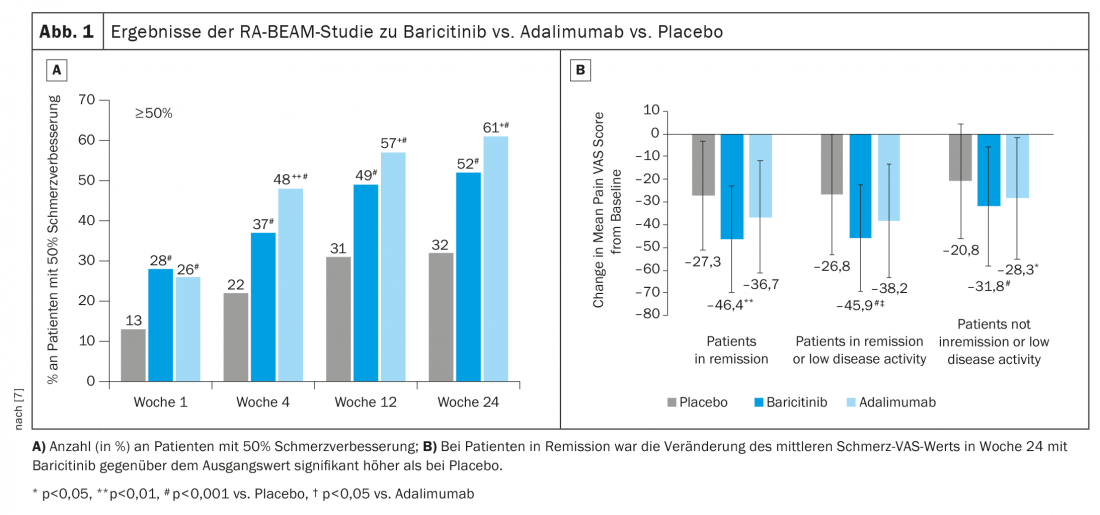
Nello studio RA-BEAM, baricitinib 4 mg + MTX è stato confrontato con adalimumab + MTX e placebo + MTX [7]. In questo caso, è stato dimostrato che il miglioramento del 50% del dolore è migliore con baricitinib. (Fig. 1A). Se esaminiamo più da vicino solo i pazienti in remissione o con una bassa attività di malattia, vediamo ancora un effetto significativo sul dolore con baricitinib. (Fig. 1B). L’effetto positivo poteva ancora essere osservato dopo il passaggio da adalimumab a baricitinib dopo la 16a settimana.
Per quanto riguarda la risposta vaccinale con baricitinib, sono stati testati il PCV13 e il tossoide tetanico (TT). 106 pazienti dello studio RA-BEYOND con 2 mg o 4 mg di baricitinib (con e senza MTX) sono stati vaccinati con PCV13 e contro il tetano. Complessivamente, il 68% dei pazienti ha mostrato una risposta vaccinale sufficiente contro lo pneumococco, il 43% ha ottenuto un aumento dei titoli vaccinali di oltre 4 volte per il tetano. Un aumento di oltre 2 volte dopo il PCV13 è stato raggiunto dal 74% dei pazienti [8].
Nuovo studio sull’effetto a lungo termine
La sicurezza a lungo termine di baricitinib in 3770 pazienti (10 127 anni-paziente di esposizione, PYE) durante il programma di sviluppo clinico è stata riportata in precedenza [9]. Poiché il baricitinib, come altri farmaci antireumatici modificanti la malattia (DMARD), viene utilizzato cronicamente nei pazienti con RA, è importante monitorare e valutare continuamente l’evoluzione del profilo di sicurezza a lungo termine. Questi dati a lungo termine sono molto importanti per valutare l’incidenza e il rischio di eventi avversi insoliti di particolare interesse (AESI), compresi i tumori maligni e gli eventi cardiovascolari avversi gravi (MACE). Dopo l’analisi precedente, lo studio di estensione a lungo termine (LTE) è stato completato e il Prof. Peter C. Taylor, Dipartimento di Ortopedia, Reumatologia e Scienze Muscoloscheletriche, Università di Oxford, e colleghi hanno presentato i risultati in un aggiornamento dei dati fino a 9,3 anni di trattamento [10].
La loro revisione ha analizzato i dati raggruppati di pazienti di età ≥18anni con RA attiva da moderata a grave, provenienti da nove studi clinici randomizzati (cinque di fase III, tre di fase II, uno di fase Ib) e un LTE completato. I criteri di esclusione includevano infezioni attuali o recenti (<30 giorni prima dell’ingresso nello studio), clinicamente gravi che richiedevano un trattamento antimicrobico, e anomalie di laboratorio selezionate (ad esempio, test di funzionalità epatica/renale, marcatori ematologici e di infezione selezionati). Le dosi di baricitinib variavano da 1 mg a 15 mg al giorno, con dosi giornaliere di 2 mg e 4 mg utilizzate negli studi di fase III e LTE.
I pazienti che hanno completato gli studi di fase III e di fase II erano eleggibili per l’LTE. I pazienti randomizzati a baricitinib 2 mg nello studio originale che non sono stati salvati hanno continuato la terapia alla stessa dose nell’LTE; tutti gli altri pazienti hanno ricevuto baricitinib 4 mg all’ingresso nell’LTE. I pazienti che hanno ricevuto 4 mg per almeno 15 mesi senza soccorso e hanno raggiunto una bassa attività di malattia sostenuta (punteggio CDAI (Clinical Disease Activity Index) ≤10) o una remissione (punteggio CDAI ≤2,8) sono stati randomizzati in cieco a 4 mg o ridotti a 2 mg.
Pazienti con RA a maggior rischio di infezione
L’incidenza di morte, eventi avversi gravi (comprese le infezioni), MACE e malignità per baricitinib è simile a quella osservata in altri studi terapeutici con inibitori JAK e DMARD biologici, hanno detto gli autori. Pochi pazienti (tasso di incidenza corretto per l’esposizione, EAIR, 4,7) hanno interrotto la terapia a causa di eventi avversi. Nei sottogruppi di baricitinib 2 mg e 4 mg, l’incidenza di AESI era simile tra i due gruppi di dosaggio.
Il rischio di mortalità nei pazienti trattati con baricitinib non è aumentato rispetto alla popolazione generale, dopo aver controllato l’età e il sesso, con un rapporto standardizzato di mortalità (SMR) per baricitinib di <1. Le cause di morte dei pazienti trattati con baricitinib sono coerenti con le percentuali di decessi complessivi nella popolazione generale degli Stati Uniti e con quelle riportate negli studi clinici di altre terapie per l’AR.
A causa delle malattie e degli interventi terapeutici, i pazienti con RA hanno un rischio maggiore di infezioni. L’incidenza complessiva delle infezioni gravi è rimasta stabile nel tempo. L’EAIR di infezioni gravi nel gruppo baricitinib 2 mg potrebbe essere numericamente più basso rispetto al gruppo 4 mg, il che è correlato a una minore attività della malattia e a un minore uso di corticosteroidi e MTX al basale. Le infezioni che hanno portato alla morte sono state rare in questa popolazione di pazienti. L’incidenza dell’herpes zoster è rimasta stabile e simile a quella di altri inibitori di JAK, tra cui tofacitinib [11] e upadacitinib [12].
Dalla loro precedente valutazione, ci sono stati altri 54 casi di malignità (esclusa la NMSC) con un IR simile (0,9 nell’analisi attuale contro 0,8), scrivono Taylor et al. [10]. I pazienti con RA sono predisposti ad un aumento del rischio di malignità, in particolare linfoma, tumore al polmone e NMSC (tumore della pelle non melanocitico). L’incidenza del linfoma è rimasta invariata a 0,06 rispetto alle precedenti segnalazioni di baricitinib e simile a quella di altre terapie RA, compreso un IR di 0,1 per adalimumab e 0,096 per i pazienti che utilizzano inibitori del TNF.
I rischi per i tumori maligni rimangono poco chiari
Gli effetti degli inibitori della JAK sul rischio di malignità rimangono poco chiari e richiedono ulteriori ricerche. I dati di una recente revisione sistematica e meta-analisi hanno concluso che non c’è stato un aumento del rischio di malignità nei pazienti che hanno combinato un inibitore della JAK con la MTX rispetto ai pazienti trattati con la sola MTX [13]. Il Prof. Taylor e colleghi sottolineano che il 79% dei pazienti inclusi nella loro analisi ha usato MTX allo stesso tempo. Inoltre, non è stato segnalato alcun aumento del rischio di malignità tra altri inibitori della JAK (tofacitinib) rispetto ai DMARD sintetici convenzionali o ai DMARD biologici come il TNFi, da studi osservazionali [14].
L’IR per le neoplasie (esclusa la NMSC) durante le prime 48 settimane della sua valutazione è stato di 0,6 (95% CI 0,34-0,91) ed è rimasto stabile in seguito a circa 1,0 (IR complessivo 0,9, 95% CI 0,77-1,09). (Fig. 2A). I tipi di malignità più comunemente riportati sono stati quelli respiratori e mediastinici (n=26, EAIR=0,17), mammari (n=23, EAIR=0,15) e gastrointestinali (n=19, EAIR=0,13). L’IR per l’NMSC è stato di 0,3 (95% CI 0,25-0,44) e non è aumentato nel tempo (Fig. 2B) . L’IR per il linfoma era di 0,06 (95% CI 0,03-0,11), con il linfoma diffuso a grandi cellule B che rimaneva il sottotipo più comune.
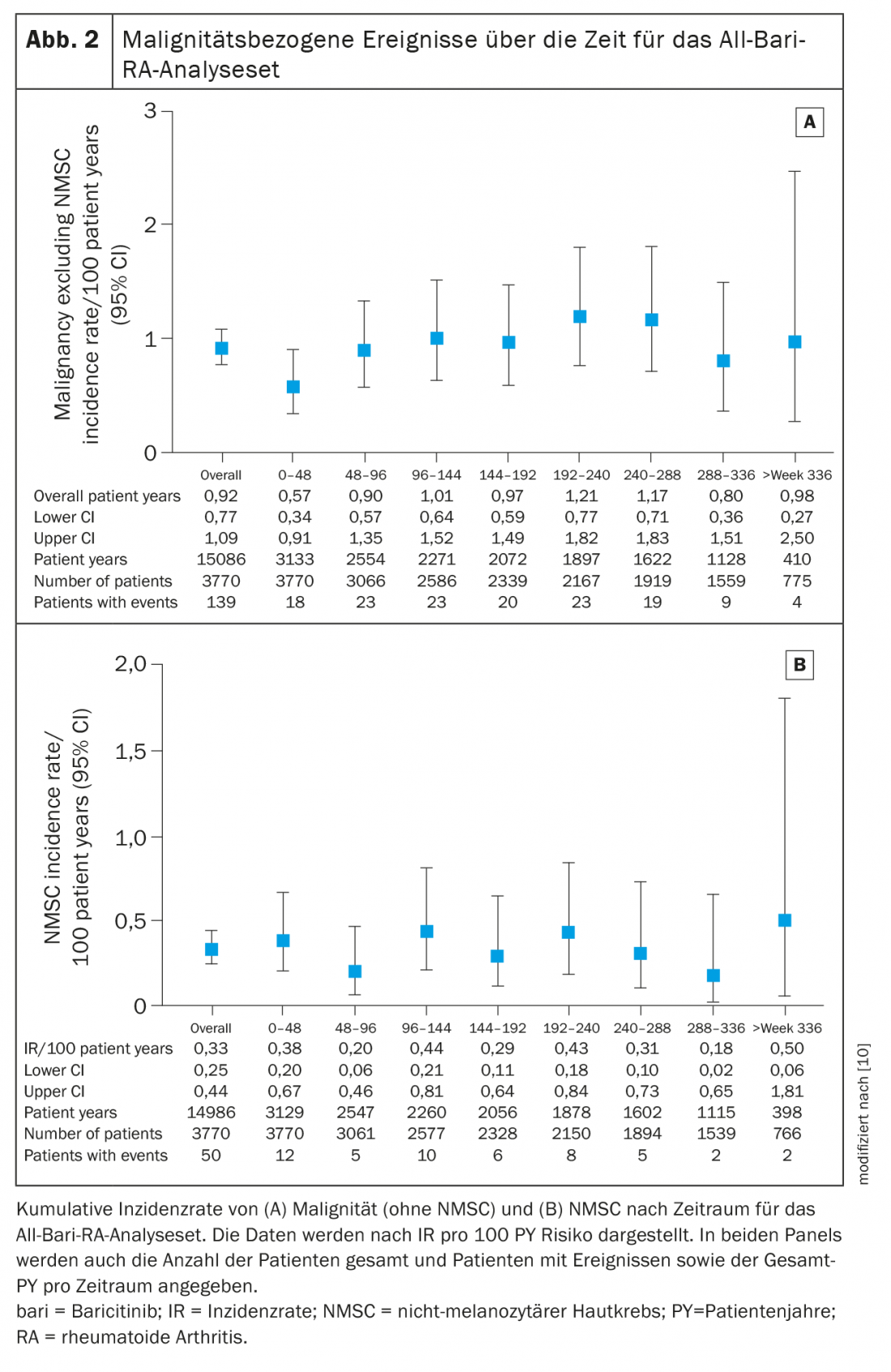
I pazienti con RA hanno un rischio maggiore di trombosi venosa profonda (TVP) e di embolia polmonare (PE) (IR 0,3-0,8/100 anni-paziente) rispetto alla popolazione generale [15,16]. In questa analisi, l’IR di TVP/PE nei pazienti trattati con baricitinib era coerente con i dati riportati in precedenza e paragonabile ad altri inibitori di JAK [9]. Nel sottogruppo di pazienti che hanno ricevuto baricitinib 2 mg o 4 mg, gli EAIR erano simili tra i gruppi di dosi e paragonabili a quelli precedentemente riportati. Mentre le recenti meta-analisi degli studi randomizzati e controllati sugli inibitori della JAK (tra cui tofacitinib, baricitinib e upadacitinib) nei pazienti con RA non hanno mostrato un aumento del rischio di eventi tromboembolici venosi durante i periodi controllati con placebo, sono necessari dati a più lungo termine per caratterizzare pienamente il rischio di questi eventi, secondo gli autori. Anche l’incidenza di MACE nell’attuale studio (0,5) è rimasta bassa e stabile rispetto ai rapporti precedenti. L’EAIR di MACE era simile tra baricitinib 2 mg (0,42) e 4 mg (0,54). Dei pazienti, il 55% presentava almeno uno dei cinque fattori di rischio cardiovascolare al basale utilizzati nell’analisi (fumatore corrente, ipertensione, diabete, storia di disturbo aterosclerotico o colesterolo HDL <40 mg/dl); come previsto, l’IR per MACE era più alto in questa sottopopolazione a rischio (0,70).
L’EAIR per la diverticolite nell’attuale studio (0,15) è coerente con i dati pubblicati nei pazienti con RA [17]. Importanti fattori di rischio per la diverticolite nella popolazione generale sono l’età, l’obesità, la dieta, il fumo e l’uso di farmaci, soprattutto oppioidi, corticosteroidi e FANS. La diverticolite nello studio a lungo termine si è verificata in pazienti con fattori di rischio. L’IR per le perforazioni gastrointestinali (0,06) rimane basso nel contesto delle segnalazioni di tofacitinib, tocilizumab e altri DMARD biologici nei dati del mondo reale e in relazione a upadacitinib (0,08/100 anni-paziente) [18].
Messaggi da portare a casa
- Come farmaci antireumatici modificanti la malattia, gli inibitori della JAK sono utilizzati cronicamente nei pazienti con RA. È importante monitorare e valutare continuamente l’evoluzione del profilo di sicurezza a lungo termine.
- Il profilo di sicurezza degli inibitori di JAK negli studi clinici comprende un aumento del rischio di herpes zoster e associazioni con un aumento di eventi cardiovascolari, eventi tromboembolici venosi (VTE) e tumori maligni.
- In un recente studio a lungo termine su baricitinib, il farmaco è rimasto stabile in termini di eventi correlati alla sicurezza, tra cui decessi, neoplasie, MACE e DVT/PE, per un periodo fino a 9,3 anni, ed è stato generalmente simile tra i gruppi da 2 mg e 4 mg.
- I risultati suggeriscono che il baricitinib ha un profilo di sicurezza coerente e in linea con altri inibitori JAK e farmaci biologici antireumatici modificanti la malattia.
- Sono necessari un follow-up continuo e ulteriori ricerche, compresi studi a lungo termine basati sulla popolazione, per comprendere appieno il rischio di endpoint, compresi tumori maligni, MACE e TEV, e il rischio comparativo nel mondo reale di baricitinib e delle terapie nell’AR.
Letteratura:
- Smolen JS, et al: Raccomandazioni EULAR per la gestione dell’artrite reumatoide con farmaci antireumatici sintetici e biologici modificanti la malattia: aggiornamento 2019. Ann Rheum Dis 2020;79: 685-699; doi: 10.1136/annrheumdis-2019-216655.
- Bird P, Hall S, Nask P, et al: RMD open 2019; 5: e000742; doi: 10.1136/rmdopen-2018-000742.
- Fleischmann R, Pangan AL, Song ICH et al: Arthritis Rheumatol 2019; 71(11): 1788-1800.
- Smolen JS, Pangan AL, Emery P, et al: Lancet 2019; 393: 2303-2311.
- Taylor PC, Keystone EC, van der Heijde D, et al: Baricitinib rispetto a placebo o adalimumab nell’artrite reumatoide. N Engl J Med 2017; 376: 652-662; doi: 10.1056/NEJMoa1608345
- Genovese MC, Kremer J, Zamani O, et al: Baricitinib nei pazienti con artrite reumatoide refrattaria. N Engl J Med 2016; 374: 1243-1252; doi: 10.1056/NEJMoa1507247
- Fautrel B, Kirkham B, Pope JE, et al: J Clin Med 2019; 8: 1394-1408.
- Winthrop K, Bingham CO, Komocsar WJ, et al: Arthritis Res Ther 2019; 21: 102-112.
- Genovese MC, Smolen JS, Takeuchi T, et al: Profilo di sicurezza di baricitinib per il trattamento dell’artrite reumatoide su una media di 3 anni di trattamento: un’analisi di sicurezza integrata aggiornata. Lancet Rheumatol 2020; 2: e347-e357; doi: 10.1016/S2665-9913(20)30032-1.
- Taylor PC, Takeuchi T, Burmester GR, et al: Sicurezza di baricitinib per il trattamento dell’artrite reumatoide per una mediana di 4,6 e fino a 9,3 anni di trattamento: risultati finali dello studio di estensione a lungo termine e del database integrato. Annals of the Rheumatic Diseases 2021 (online first); doi: 10.1136/annrheumdis-2021-221276.
- Winthrop KL, Curtis JR, Lindsey S, et al: Herpes zoster e tofacitinib: esiti clinici e rischio della terapia concomitante. Arthritis Rheumatol 2017;69: 1960-1968; doi: 10.1002/art.40189.
- van Vollenhoven R, Takeuchi T, Pangan AL: Uno studio di fase 3, randomizzato e controllato, che confronta la monoterapia con upadacitinib con la monoterapia con MTX nei pazienti naïve al MTX con artrite reumatoide attiva [abstract]. Arthritis Rheumatol 2018; 70.
- Solipuram V, Mohan A, Patel R, et al: Effetto della combinazione di inibitori della Janus chinasi e metotrexato sulla malignità nei pazienti con artrite reumatoide: una revisione sistematica e una meta-analisi di studi controllati randomizzati. Auto Immune Highlights 2021; 12(8); doi: 10.1186/s13317-021-00153-5.
- Xie W, Yang X, Huang H, et al: Rischio di malignità con terapia biologica non-TNFi o tofacitinib nell’artrite reumatoide: una meta-analisi di studi osservazionali. Semin Arthritis Rheum 2020; 50: 930-937; doi: 10.1016/j.semarthrit.2020.08.007.
- Kim SC, Schneeweiss S, Liu J, et al: Rischio di tromboembolismo venoso nei pazienti con artrite reumatoide. Arthritis Care Res 2013; 65: NA-7; doi: 10.1002/acr.22039.
- Ogdie A, Kay McGill N, Shin DB, et al: Rischio di tromboembolismo venoso nei pazienti con artrite psoriasica, psoriasi e artrite reumatoide: uno studio di coorte basato sulla popolazione generale. Eur Heart J 2018; 39: 3608-3614; doi: 10.1093/eurheartj/ehx145.
- Bharucha AE, Parthasarathy G, Ditah I, et al: Tendenze temporali nell’incidenza e nella storia naturale della diverticolite: uno studio basato sulla popolazione. Am J Gastroenterol 2015; 110: 1589-1596; doi: 10.1038/ajg.2015.302.
- Cohen SB, van Vollenhoven RF, Winthrop KL: Correzione: Profilo di sicurezza di upadacitinib nell’artrite reumatoide: analisi integrata del programma clinico di fase III SELECT. Ann Rheum Dis 2021; 80: 304-311; doi: 10.1136/annrheumdis-2020-218510.
InFo PAIN & GERIATURE 2021; 3(2): 6-9













