I linfomi sono responsabili del 3,8% di tutte le nuove diagnosi di cancro. Secondo l’attuale classificazione dell’OMS, esistono oltre 75 diverse linfomentosità, che vengono trattate in modo diverso. Nel trattamento del linfoma diffuso a grandi cellule B (DLBCL), del linfoma periferico a cellule T e del linfoma di Hodgkin classico, negli ultimi anni sono successe molte cose.
Secondo le classificazioni utilizzate in precedenza, i linfomi sono tradizionalmente suddivisi nei cosiddetti linfomi Hodgkin e non Hodgkin. Questa classificazione è ancora utilizzata nelle statistiche individuali e serve come base per la registrazione dell’incidenza nazionale (www.nkrs.ch/de/stat). Secondo questa raccolta dati, in Svizzera poco meno di 1600 pazienti all’anno sviluppano un linfoma non Hodgkin e circa 250 un linfoma Hodgkin. I linfomi sono responsabili del 3,8% di tutte le nuove diagnosi di cancro. Il tasso di mortalità annuale è di poco superiore ai 500 decessi. I linfomi rappresentano il 3,2% di tutti i decessi per cancro.
Attuale classificazione OMS e presentazione clinica
L’Organizzazione Mondiale della Sanità (OMS) ha già creato diverse classificazioni per i linfomi e ha sempre più sostituito il termine linfoma non-Hodgkin con una chiara denominazione e sottotipizzazione delle singole entità. La classificazione attualmente valida dal 2016 comprende oltre 75 linfomentalità [1]. Si basa sulla diversa morfologia, sulla presentazione clinica e sempre più spesso anche su aspetti molecolari o genetici.
A mio avviso, questa classificazione è molto importante, poiché la diagnosi, la prognosi e la terapia differiscono fondamentalmente in alcuni casi. I termini indolente e aggressivo dovrebbero oggi essere utilizzati principalmente in relazione al comportamento di crescita del rispettivo linfoma. Circa il 50% di tutti i linfomi appartiene ai linfomi a crescita lenta e sono quindi chiamati indolenti. Il restante 50% è costituito da linfomi a crescita rapida e quindi piuttosto aggressivi. In questa raccolta, vorrei discutere brevemente la terapia di alcuni linfomi aggressivi selezionati.
Terapia del linfoma diffuso a grandi cellule B (DLBCL)
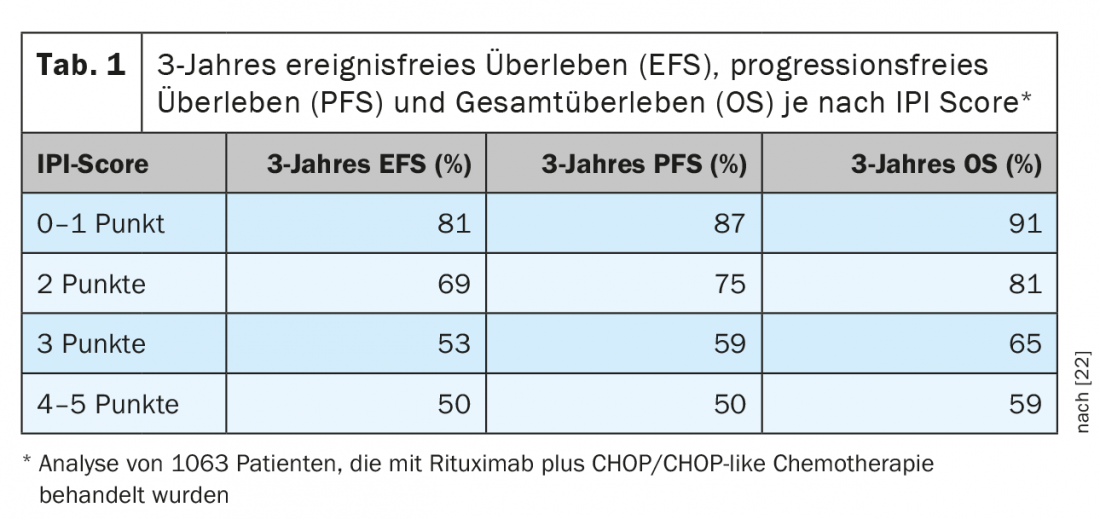
I DLBCL rappresentano il 25-30% di tutti i linfomi e sono quindi l’entità di linfoma più comune. Appartengono ai linfomi aggressivi a cellule B. Nella maggior parte dei casi, l’obiettivo del trattamento dovrebbe essere il controllo o la cura della malattia a lungo termine. In genere, questo risultato si ottiene solo con l’immunochemioterapia intensiva, che si basa sulla combinazione di un anticorpo specifico per il CD20 con la polichemioterapia. In genere, viene utilizzato un regime CHOP o simile a CHOP. Per quanto riguarda la prognosi, esistono diversi sistemi di valutazione. La stratificazione del rischio più a lungo utilizzata e in gran parte ancora valida si basa sul cosiddetto “Indice prognostico internazionale (IPI)” (Tab. 1) [2]. Per i pazienti di età inferiore ai 60 anni, viene spesso utilizzato il cosiddetto “Indice prognostico internazionale aggiustato per l’età” (aaIPI), adattato. In base a questa classificazione, i pazienti con DLBCL possono essere suddivisi in quattro gruppi. Mentre gli over 60 non sono ulteriormente sottotipizzati, ci sono tre gruppi nella fascia di età inferiore ai 60 anni: pazienti in fase precoce con prognosi favorevole (aaIPI 0), pazienti più giovani con prognosi sfavorevole (aaIPI 1 e/o massa) e come terzo gruppo i cosiddetti pazienti ad alto rischio (aaIPI ≥2).
Per il trattamento dei pazienti più anziani (>60 anni), vengono spesso utilizzati sei cicli di rituximab + CHOP, principalmente a intervalli di 21 giorni e raramente ogni 14 giorni. La superiorità di un regime di 14 giorni stabilita dal gruppo di studio tedesco DSHNL [3] non ha potuto essere confermata né dal gruppo di studio inglese [4], né da quello francese [5], per cui non è stata fornita una comparabilità diretta degli studi. Il beneficio di otto cicli di R-CHOP rispetto a sei cicli nel regime di 21 giorni non è stato randomizzato. Tuttavia, le analisi retrospettive dello studio randomizzato di fase III GOYA [6], in cui i centri potevano scegliere tra sei e otto cicli, non hanno mostrato alcuna differenza di efficacia. Pertanto, sei cicli di R-CHOP ogni 21 giorni sono spesso considerati standard. Anche la somministrazione aggiuntiva di immunoterapia due volte come settimo e ottavo ciclo di trattamento, sotto forma di due ulteriori dosi di rituximab nel cosiddetto “regime 6 + 2”, non si è dimostrata superiore nello studio PETAL [7].
Nei pazienti più giovani, di età inferiore ai 60 anni, con assenza di fattori di rischio e prognosi favorevole (aaIPI 0, nessuna massa), quattro cicli di R-CHOP-21 hanno dimostrato di fornire un’eccellente sopravvivenza libera da progressione (PFS) e sopravvivenza globale (OS) nello studio FLYER, pubblicato di recente [8]. Ciò consente una riduzione della dose e una riduzione significativa della morbilità correlata alla terapia, con alti tassi di guarigione (PFS a 3 anni 96% vs. 93%). Per il secondo gruppo di persone di età inferiore ai 60 anni con aaIPI 1 e/o massa, sei cicli di R-CHOP-21 con radioterapia di consolidamento della massa iniziale sono considerati standard. Nello studio MINT sul DSHNHL [9], la sopravvivenza libera da eventi (EFS) a 6 anni con questa terapia è stata del 71%. Il gruppo di studio francese GELA/LYSA ha dimostrato la superiorità del regime R-ACVBP [10] rispetto a R-CHOP-21 per questo collettivo. Tuttavia, questo risultato deve essere messo criticamente in discussione perché, a differenza dello studio DSHNHL, non è stata utilizzata la radioterapia.
I pazienti più giovani ad alto rischio (aaIPI ≥ 2) purtroppo continuano ad avere un rischio maggiore di recidiva e quindi minori possibilità di guarigione. La terapia ottimale per questa popolazione di pazienti non è definita in modo uniforme. Alcuni gruppi di studio utilizzano lo schema R-CHOP-21 citato in precedenza [4]. Altri centri di studio, come singoli centri americani ed europei, eseguono a priori il consolidamento della terapia ad alte dosi con il trapianto di cellule staminali autologhe nella prima linea di terapia. La DSHNHL ha testato otto cicli di R-CHOEP-14 contro un approccio a triplo trapianto nello studio MEGA-CHOEP [11]. È stata dimostrata la superiorità (EFS a 3 anni 69,5% vs 61,4%) del braccio 8 x R-CHOEP-14. Nell’ambito americano, il regime R-DA-EPOCH è spesso utilizzato al posto del regime R-CHOEP. In generale, la maggior parte dei centri privilegia un regime di trattamento più intensivo rispetto al regime R-CHOP standard.
In particolare, la terapia dei pazienti più giovani ad alto rischio dimostra che la terapia di prima linea del DLBCL è decisiva per la prognosi. Se la malattia ha una ricaduta entro 12-18 mesi, la prognosi è spesso infausta e solo pochi pazienti possono ottenere una remissione a lungo termine. Tuttavia, se i pazienti non hanno avuto una ricaduta nei primi 18-24 mesi dopo la fine della terapia, il controllo della malattia a lungo termine con alti tassi di guarigione è molto più comune. Questo dimostra che un concetto curativo dovrebbe essere scelto il più possibile nel contesto della terapia di prima linea. Negli ultimi anni, la biologia molecolare ci ha permesso di conoscere più a fondo i pato-meccanismi alla base della malattia e diversi studi, basati sul già citato e consolidato regime R-CHOP, hanno studiato il valore terapeutico di diversi inibitori della segnalazione. Ad esempio, l’inibitore del proteasoma bortezomib è stato testato anche in Svizzera [12]. Purtroppo, non c’è stato alcun beneficio del trattamento nella popolazione complessiva. Anche l’aggiunta dell’immunomodulatore lenalidomide a R-CHOP non ha mostrato alcun beneficio significativo nello studio prospettico randomizzato ROBUST [13]. Attualmente sono in corso studi sull’uso degli inibitori di BTK (ad esempio, ibrutinib) [14], nonché degli inibitori di BCL2 (venetoclax) [15]. Gli studi iniziali di fase II e le analisi di sottogruppo hanno suggerito alcuni vantaggi per queste due ultime sostanze. Tuttavia, non è ancora stato dimostrato che questi agenti mostrino una superiorità significativa rispetto allo standard attuale e quindi né gli inibitori di BTK né di BCL2 sono attualmente oggetto della nostra routine quotidiana. Come nuovo concetto di terapia, in caso di ricaduta, cioè nei pazienti più anziani dopo due terapie precedenti e nei pazienti più giovani di norma dopo due terapie precedenti, incluso il trattamento con una singola terapia, è stato possibile dimostrare l’efficacia della terapia. Terapia ad alto dosaggio con sostituzione di cellule staminali autologhe, con l’introduzione della tecnologia delle cellule CAR T [16]. Questo è disponibile presso i centri specializzati in Svizzera.
Terapia dei linfomi a cellule T periferiche aggressivi (PTCL)
I linfomi a cellule T rappresentano circa il 10% di tutti i nuovi casi di linfoma nel mondo occidentale. La classificazione istopatologica e molecolare delle singole entità di linfoma a cellule T è complessa e, purtroppo, a causa della rarità della malattia, sono spesso disponibili solo dati molto limitati provenienti da studi randomizzati più ampi. La prognosi dei linfomi aggressivi a cellule T è solitamente meno favorevole rispetto a quella dei linfomi aggressivi a cellule B. Solo il cosiddetto “linfoma a cellule T periferiche ALK+ (PTCL)” è spesso classificato come avente una prognosi migliore. Gli altri sottotipi di PTCL mostrano per lo più un decorso rapido della malattia, con una risposta spesso di breve durata alla terapia. Il rilevamento dell’antigene CD30 sulle cellule del linfoma è importante per il trattamento della PTCL. Secondo lo studio ECHELON-2, se questo viene espresso, si può ottenere un miglioramento significativo della PFS a 3 anni (57% contro 44%) e della OS con la combinazione di brentuximab vedotin come immunoconiugato più chemioterapia CHP [17]. Lo studio ha confrontato questo trattamento con l’attuale regime standard CHOP. I centri di studio erano liberi di applicare la terapia per sei o otto cicli alla volta. Il brentuximab vedotin, come l’alcaloide vinca vincristina, ha un’elevata neurotossicità, per cui nel braccio sperimentale è stato necessario interrompere la vincristina quando è stato aggiunto il brentuximab vedotin. Quindi, la chemioterapia è stata ridotta da CHOP a CHP. Come già detto, oltre al beneficio in termini di PFS, è stato osservato anche un beneficio in termini di OS. Di conseguenza, questa terapia è attualmente considerata il gold standard per il PTCL CD30-positivo in prima linea. Purtroppo, altre sostanze terapeutiche come gli inibitori HDAC, gli immunoconiugati, gli antimetaboliti e gli agenti chemioterapici classici hanno una durata d’azione molto limitata nella PTCL. Pertanto, dopo il fallimento dei trattamenti ad alta intensità terapeutica, spesso sono disponibili solo opzioni palliative di breve efficacia.
Terapia del linfoma di Hodgkin classico (cHL)
Nel trattamento del linfoma di Hodgkin classico, molti colleghi seguono le linee guida del Gruppo tedesco di studio sul linfoma di Hodgkin (GHSG). Secondo la stratificazione GHSG, i pazienti con cHL sono suddivisi in tre gruppi di rischio. L’ultima generazione di studi completata e pubblicata comprende gli studi HD16-HD18 per il trattamento di pazienti con stadi precoci (HD16), intermedi (HD17) e avanzati (HD18). Lo studio HD16 ha verificato se la radioterapia consolidativa potesse essere omessa in caso di negatività della PET dopo due cicli di ABVD (la cosiddetta “negatività PET2”). Secondo i risultati dello studio, la radioterapia non dovrebbe essere omessa, poiché la PFS a 5 anni scende dal 93,4% con la radioterapia all’86% senza radioterapia, e quindi si può prevedere un risultato terapeutico significativamente peggiore se la radioterapia viene omessa [18].
Nella fase intermedia, una domanda simile è stata affrontata nello studio HD17 [19]. Per i pazienti corrispondenti, la chemioterapia comprende due cicli di BEACOPPPescalated (BEACOPPesc) come standard, seguiti da due cicli di ABVD. Dopo questi quattro cicli di terapia, viene classicamente eseguita una PET-CT (la cosiddetta “PET4”). Nello studio HD17, la radioterapia solitamente somministrata è stata omessa per la negatività della PET4. Utilizzando questo regime terapeutico, è stata dimostrata una PFS a 5 anni del 97% nel braccio standard (con radioterapia) e del 95,1% nel braccio sperimentale, cioè con l’omissione della radioterapia in caso di negatività della PET4. Quindi, il trattamento con l’omissione della radioterapia non era inferiore alla terapia standard con i risultati PET corrispondenti. Secondo questo studio, è quindi possibile rinunciare alla radioterapia di consolidamento in caso di negatività della PET4 dopo quattro cicli di chemioterapia.
I dati dello studio HD18 sul trattamento degli stadi avanzati del cHL sono già stati presentati in diversi congressi [20]. Nell’ambito dello studio, sei cicli di BEACOPPesc sono stati definiti come lo standard terapeutico GHSG. Nel braccio sperimentale, la negatività del PET2 è stata testata per verificare se fossero sufficienti altri due cicli di BEACOPPesc, per un totale di quattro anziché sei. Lo studio ha mostrato una PFS a 5 anni del 91,2% nel braccio BEACOPPesc standard a sei cicli. Il braccio guidato dalla PET2 ha mostrato un risultato comparabile del 91,8%. Pertanto, in caso di negatività della PET2, si può procedere a una riduzione della dose a un totale di quattro cicli. Si tratta di un progresso significativo, soprattutto a causa dell’età spesso giovane dei pazienti con cHL. La riduzione della dose può contrastare la morbilità associata alla terapia e, in particolare, l’infertilità indotta dalla chemioterapia. Si spera che con il nuovo standard di cura, nel corso della vita si verifichino meno seconde neoplasie.
La CHL è una delle entità con i più alti tassi di risposta alla terapia con inibitori PD1. Nel caso della recidiva di cHL, ritengo che la pubblicazione dello studio KEYNOTE-204 sia significativa per la pratica clinica quotidiana [21]. In questo studio, l’uso dell’inibitore PD1 pembrolizumab rispetto a brentuximab vedotin è stato testato in pazienti con cHL recidivato in un confronto randomizzato. Nell’analisi presentata alla Riunione Annuale ASCO 2020, è stata riportata la superiorità del blocco di PD1 con un tasso di risposta più elevato (65% vs 54%) e una PFS mediana più lunga di 13,2 vs 8,3 mesi. Inoltre, il blocco di PD1 ha mostrato una tossicità significativamente inferiore, soprattutto la neurotossicità, per cui, oltre all’efficacia, anche la tollerabilità depone a favore dell’uso precoce dell’immunoterapia nel trattamento delle recidive di CCL.
Messaggi da portare a casa
- Nel trattamento dei linfomi aggressivi a cellule B, si possono ottenere alti tassi di guarigione attraverso l’uso dell’immuno-chemioterapia.
- La terapia dei linfomi aggressivi a cellule B è stratificata in base al rischio con 4-6(8) cicli di immuno-chemioterapia (R-CHOP o R-CHOP-like).
- I linfomi aggressivi a cellule T di solito hanno una prognosi significativamente peggiore rispetto ai linfomi aggressivi a cellule B.
- L’uso dell’immunotossina CD30 brentuximab vedotin in combinazione con la chemioterapia CHP nella PTCL CD30-positiva è considerato standard.
- La CHL viene trattata con la chemioterapia o la chemioterapia più la radioterapia in base allo stadio e al rischio e ha ottimi tassi di guarigione. L’obiettivo dei nuovi approcci terapeutici è spesso quello di ridurre la dose per evitare la morbilità legata alla terapia, pur mantenendo alti tassi di guarigione.
Letteratura:
- Swerdlow SH, et al: Classificazione OMS dei tumori del tessuto ematopoietico e linfoide. 4° ed. riveduta. Lione: IARC; 201.
- Il Progetto internazionale sui fattori prognostici del linfoma non Hodgkin. Un modello predittivo per il linfoma non-Hodgkin aggressivo. N Engl J Med 1993; 329: 987-994.
- Pfreundschuh M, et al: Sei contro otto cicli di CHOP-14 bisettimanale con o senza rituximab in pazienti anziani con linfomi aggressivi a cellule B CD20+: uno studio randomizzato controllato (RICOVER-60). Lancet Oncol 2008; 9: 105-116.
- Cunningham D, et al: Rituximab più ciclofosfamide, doxorubicina, vincristina e prednisolone in pazienti con linfoma non-Hodgkin diffuso a grandi cellule B di nuova diagnosi: confronto di fase 3 tra l’intensificazione della dose con cicli di 14 giorni e cicli di 21 giorni. Lancet 2013; 381: 1817-1826.
- Delarue R, et al: Rituximab-CHOP ad alta densità di dose rispetto a rituximab-CHOP standard nei pazienti anziani con linfoma diffuso a grandi cellule B (studio LNH03-6B): studio randomizzato di fase 3. Lancet Oncol 2013; 14: 525-533.
- Sehn LH, et al: Studio randomizzato, in aperto, di fase III di obinutuzumab o rituximab più CHOP nei pazienti con linfoma diffuso a grandi cellule B precedentemente non trattato: analisi finale di GOYA. J Hematol Oncol. 2020; 13(1): 71-79.
- Schmitz C, et al.: Impatto della resezione chirurgica completa sull’esito nel linfoma non-Hodgkin aggressivo trattato con immunochemioterapia. Cancer Med 2020; 9(22): 8386-8396.
- Poeschel V, et. al: Quattro contro sei cicli di chemioterapia CHOP in combinazione con sei applicazioni di rituximab in pazienti con linfoma aggressivo a cellule B con prognosi favorevole (FLYER): uno studio randomizzato, di fase 3, di non inferiorità. Lancet.2019; 394 (10216): 2271-2281.
- Pfreundschuh M, et al: Chemioterapia CHOP-like con o senza rituximab in pazienti giovani con linfoma diffuso a grandi cellule B a buona prognosi: risultati a 6 anni di uno studio randomizzato in aperto del Gruppo MabThera International Trial (MInT). Lancet Oncol 2011; 12: 1013-1022.
- Recher C et al: Chemioterapia intensificata con ACVBP più rituximab rispetto a CHOP standard più rituximab per il trattamento del linfoma diffuso a grandi cellule B (LNH03-2B): Uno studio randomizzato di fase 3 in aperto. Lancet 2011; 378: 1858-1867.
- Schmitz N, et al: Chemioterapia convenzionale (CHOEP-14) con rituximab o chemioterapia ad alte dosi (MegaCHOEP) con rituximab per i pazienti giovani ad alto rischio con linfoma aggressivo a cellule B: uno studio randomizzato di fase 3 in aperto (DSHNHL 2002-1). Lancet Oncol 2012; 13: 1250-1259.
- Davies A, et al: Profilazione di espressione genica del bortezomib aggiunto alla chemioimmunoterapia standard per il linfoma diffuso a grandi cellule B (REMoDL-B): uno studio di fase 3, randomizzato, in aperto. Lancet Oncol. 2019; 20(5): 649-662.
- Lue JK, O’Connor OA: Una prospettiva sul miglioramento del regime R-CHOP: da Mega-CHOP a ROBUST R-CHOP, il PHOENIX deve ancora sorgere. Lancet Haematol 2020; 7(11): e838-e850.
- Younes A, et al: Studio randomizzato di fase III di Ibrutinib e Rituximab più Ciclofosfamide, Doxorubicina, Vincristina e Prednisone nel linfoma diffuso a grandi cellule B senza centro germinale. J Clin Oncol 2019; 37(15): 1285-1295.
- Morschhauser F, et al: Uno studio di fase 2 di venetoclax più R-CHOP come trattamento di prima linea per i pazienti affetti da linfoma diffuso a grandi cellule B. Sangue 2021; 137(5): 600-609.
- Schuster SJ, et al: Cellule T con recettore dell’antigene chimerico nei linfomi a cellule B refrattari. N Engl J Med 2017; 377: 2545-2554.
- Horwitz S, et al: Gruppo di studio ECHELON-2. Brentuximab vedotin con chemioterapia per il linfoma a cellule T periferiche CD30-positivo (ECHELON-2): uno studio globale, in doppio cieco, randomizzato e di fase 3. Lancet 2019; 393(10168): 229-240.
- Fuchs M, et al: Trattamento guidato dalla tomografia ad emissione di positroni nel linfoma di Hodgkin in stadio precoce e favorevole: risultati finali dello studio internazionale, randomizzato di fase III HD16 del Gruppo tedesco di studio Hodgkin. J Clin Oncol 37 2019; 31: 2835-2845.
- Borchmann P, et al: Omissione della radioterapia guidata dalla PET nel linfoma di Hodgkin sfavorevole in stadio precoce (GHSG HD17): uno studio multicentrico, open-label, randomizzato, di fase 3. Lancet Oncol 2021; 22(2): 223-234.
- Borchmann P, et al: Trattamento guidato dalla PET nei pazienti con linfoma di Hodgkin in stadio avanzato (HD18): risultati finali di uno studio di fase 3 randomizzato, internazionale, in aperto, condotto dal Gruppo tedesco di studio Hodgkin. Lancet 2018; 390(10114): 2790-2802.
- Kuruvilla J, et al.: KEYNOTE-204: Studio randomizzato, in aperto, di fase III di pembrolizumab (pembro) rispetto a brentuximab vedotin (BV) nel linfoma Hodgkin classico recidivato o refrattario (R/R cHL). Presentato al Programma Scientifico Virtuale della Società Americana di Oncologia Clinica (ASCO) del 2020. 29-31 maggio 2020. Abstract 8005.
- Ziepert M, et al: L’indice prognostico internazionale standard rimane un valido predittore di esito per i pazienti con linfoma aggressivo a cellule B CD20+ nell’era del rituximab. J Clin Oncol. 2010; 28: 2373.
InFo ONCOLOGIA ED EMATOLOGIA 2021; 9(2): 10-13