L’attività fisica probabilmente riduce il rischio di sviluppare la malattia di Parkinson più avanti nella vita. Di conseguenza, la terapia non farmacologica per il Parkinson sta diventando sempre più importante. In sostanza, si tratta di neuromodulazione e neuroriabilitazione nei pazienti in fase avanzata.
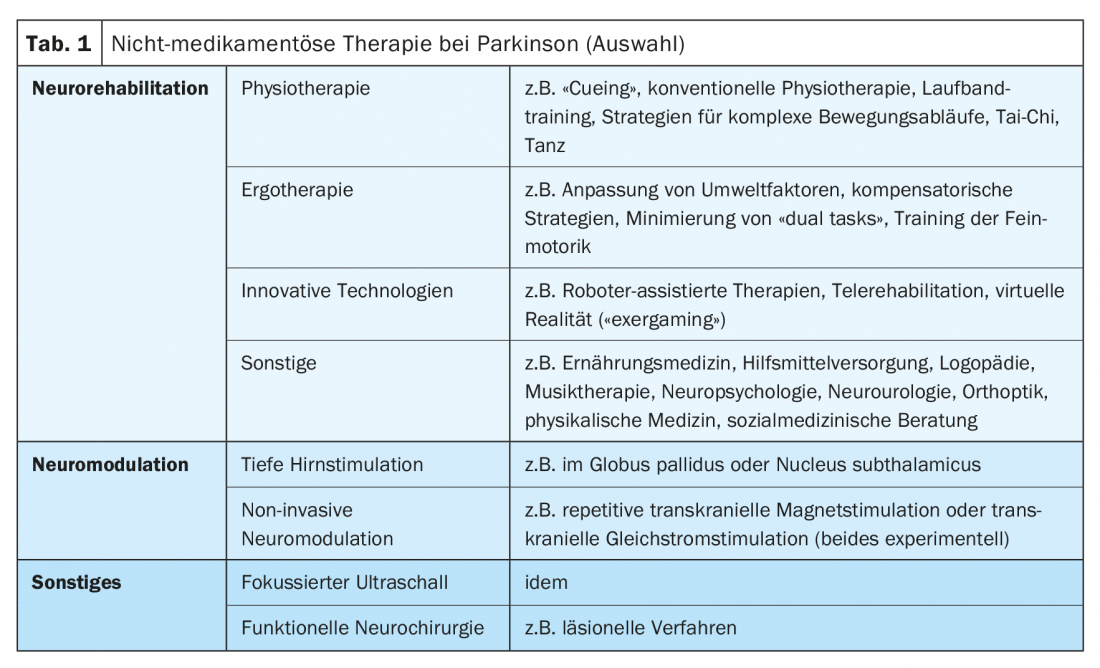
La terapia non farmacologica per la malattia di Parkinson prevede essenzialmente la neuromodulazione e la neuroriabilitazione nei pazienti in fase avanzata. L’articolo si concentra sul trattamento riabilitativo dei pazienti con malattia di Parkinson, con particolare attenzione ai problemi di trattamento speciali e agli approcci terapeutici innovativi. Le procedure come la stimolazione cerebrale profonda o la neuromodulazione non invasiva non sono discusse in dettaglio, né gli ultrasuoni focalizzati come alternativa terapeutica sperimentale alla stimolazione cerebrale profonda. Anche alcune aree della neuroriabilitazione, come la logopedia, la neuropsicologia e la riabilitazione visiva, non vengono trattate (Tab. 1).
Riabilitazione somatica per la malattia di Parkinson
L’attività fisica probabilmente riduce il rischio di sviluppare la malattia di Parkinson più avanti nella vita. Secondo una meta-analisi svedese dei sei studi disponibili al momento, le persone fisicamente attive hanno un rischio minore (“hazard ratio”: 0,66) di sviluppare il morbo di Parkinson più avanti nella vita, rispetto alle persone fisicamente inattive [1].
In fisioterapia o terapia occupazionale, l’esercizio descrive un’attività fisica pianificata, strutturata e ripetuta per (ri)imparare o mantenere una funzione di movimento. Il feedback può aiutare i pazienti ad andare oltre le loro capacità percepite o a diventare più consapevoli di movimenti che prima erano automatici o inconsci. Sono disponibili numerosi studi sull’efficacia della fisioterapia in tutte le sue varianti per la malattia di Parkinson, alcuni dei quali sono presentati brevemente di seguito. Negli anni ’90, è stato pubblicato uno dei primi studi controllati in cui la mobilità dei pazienti con Parkinson migliorava grazie alla partecipazione a un programma di riabilitazione di 4 settimane [2]. Tuttavia, questo miglioramento non è persistito quando si è tornati all’attività fisica abituale. La LSVT®BIGè probabilmente una delle procedure più utilizzate nel trattamento terapeutico dei pazienti con Parkinson ed è stata introdotta da Farley e Koshland [3]. In questo trattamento intensivo, i pazienti si allenano con movimenti di grande ampiezza 4 volte alla settimana per 1 ora al giorno per 4 settimane. L’LSVT®BIGè stato più efficace della “camminata nordica” o dell’autoterapia in ambiente domestico in uno studio controllato [4]. Lo studio PRET-PD ha rilevato che un allenamento di forza progressivo 2×settimana per 24 mesi ha portato a una riduzione dei sintomi motori misurati dall’UPDRS-III. L’allenamento su tapis roulant 3×settimana ad alta intensità (80% della riserva di frequenza cardiaca) o a bassa intensità (40% della riserva di frequenza cardiaca) è stato confrontato con l’allenamento di forza non aerobico [5]. Tutti e tre i gruppi hanno mostrato un miglioramento della velocità di camminata, mentre l’allenamento della forza ha migliorato anche la forza muscolare. Pertanto, è stata proposta una combinazione di elementi di allenamento aerobico e non aerobico. L’addestramento dei passi compensatori può essere utilizzato per trattare l’instabilità posturale nella malattia di Parkinson. Il Tai-chi probabilmente porta a un miglioramento dei disturbi dell’equilibrio e a una riduzione della frequenza delle cadute nella malattia di Parkinson [6]. Inoltre, il programma HiBalance è stato sviluppato come metodo per trattare i disturbi dell’equilibrio nella malattia di Parkinson. Per quanto riguarda la terapia occupazionale, il trattamento domiciliare individuale ha portato a un miglioramento soggettivo nelle attività della vita quotidiana [7]. Inoltre, un programma domiciliare di terapia occupazionale mirato (HOMEDEXT) probabilmente migliorerà le capacità motorie fini nei pazienti con Parkinson.
Anche se molti studi hanno un numero di casi relativamente piccolo, è altamente probabile che la neuroriabilitazione sia efficace nel trattamento dei pazienti con PD. Tuttavia, non è chiaro su quali meccanismi si basi l’effetto sintomatico e se l’attività fisica influenzi positivamente il decorso della malattia. Lo studio SPARX nei pazienti con PD de novo ha concluso che l’esercizio sul tapis roulant ad alta intensità dovrebbe essere ulteriormente studiato per un effetto modificante la malattia [8]. Un’ulteriore prova di un possibile effetto modificante la malattia dell’esercizio aerobico è arrivata dallo studio Park-in-Shape [9].
Disturbi posturali: Kamptokormie
La postura chinata è una delle caratteristiche tipiche della malattia di Parkinson. Le forme pronunciate si chiamano camptocorms. Altri disturbi posturali nella malattia di Parkinson sono l’antecollis e la sindrome di Pisa. La prevalenza di questi disturbi posturali è dell’11,2% per la camptocoria, dell’8,5% per la sindrome di Pisa e del 6,5% per l’antecollis, con forme miste che si verificano [10].
La camptocoria nella malattia di Parkinson è stata descritta per la prima volta nel 1999 in otto pazienti in cui la L-dopa non ha provocato alcun cambiamento o peggioramento della malposizione. La camptocormia superiore più comune (≥45°) ha il punto di flessione tra la parte inferiore della colonna vertebrale toracica e la parte superiore della colonna vertebrale lombare, mentre nella camptocormia inferiore meno comune (≥30°) questo si trova a livello dell’articolazione dell’anca. Il criterio principale per distinguere tra camptocormia e cifoscoliosi è la capacità di correggere la cattiva postura attraverso varie manovre, ad esempio sdraiandosi o appoggiandosi a una parete. L’angolo delle linee tra il malleolo laterale e il processo spinoso L5 e tra i processi spinosi L5 e C7 viene utilizzato per determinare la camptocoria totale [11]. La camptocoria superiore è misurata dalle linee di collegamento dal fulcro vertebrale ai processi spinosi L5 e C7. Queste misurazioni possono essere effettuate con l’aiuto della NeuroPostureApp©. I possibili fattori eziologici includono il rigore muscolare, la distonia assiale, la debolezza dovuta alla miopatia, i disturbi dello schema corporeo con compromissione dell’autoconsapevolezza e i cambiamenti strutturali della colonna vertebrale, anche se la fisiopatologia della camptocoria nella malattia di Parkinson non è ancora stata compresa in modo definitivo.
La risposta ai farmaci dopaminergici o alla stimolazione cerebrale profonda dipende da vari fattori, come la durata della camptocormia, ma è spesso insoddisfacente. Le iniezioni intramuscolari con tossina botulinica o lidocaina possono aiutare, ma i dati sono insufficienti e spesso incoerenti. Pertanto, la riabilitazione posturale svolge un ruolo importante nel trattamento della camptocormia. Questo include l’allenamento passivo e attivo della postura, il controllo visivo e propriocettivo della postura e gli esercizi funzionali [11]. In un caso, la camptocormia è scomparsa completamente quando si è utilizzato uno zaino basso da 6 kg ed è ricomparsa dopo che lo zaino è stato scartato. Anche l’uso di un rollator alto può essere utile. Inoltre, si può prendere in considerazione l’applicazione di un’ortesi. In singoli casi, la malposizione può essere corretta chirurgicamente, ma le complicazioni e le revisioni chirurgiche sono frequenti.
“Congelamento dell’andatura (FOG)”.
Il FOG è stato definito come un’incapacità episodica di generare passi efficaci che dura per secondi, in assenza di una causa nota diversa dalla sindrome di Parkinson o da un altro disturbo complesso dell’andatura. In alternativa, il FOG è stato anche definito come una breve assenza episodica o una marcata riduzione del movimento in avanti dei piedi, nonostante l’intenzione di camminare. Quando un paziente avanza, si verifica la seguente sequenza di eventi quando si verifica il FOG: a) una diminuzione chiara e crescente della lunghezza del passo; b) una gamma di movimenti significativamente ridotta nelle articolazioni dell’anca, del ginocchio e della caviglia; (c) coordinamento disturbato del ciclo del passo, che è difficile da distinguere dalla festinazione; e d) movimenti alternati ad alta frequenza simili a tremori [12].
Clinicamente, si possono distinguere tre diverse forme di FOG: a) passi molto piccoli; b) Movimenti simili a tremori nello stesso punto; c) Acinesia. Il FOG si verifica più spesso durante il decollo, la virata, in spazi ristretti, sotto stress o distrazione. Un’alterata coordinazione bilaterale della deambulazione predispone al verificarsi di FOG, soprattutto nelle attività che richiedono un alto grado di coordinazione sinistra-destra. La rotazione a 360° in combinazione con un “doppio compito” è stata descritta come l’innesco più importante del FOG. Durante l’inversione, i “non congelatori” e i soggetti di controllo hanno ridotto la loro cadenza, mentre i “congelatori” hanno aumentato la loro cadenza. L’eziologia della FOG non è ancora stata chiarita in modo definitivo. Durante un episodio di FOG, l’attività del nucleo subtalamico e della regione locomotoria mesencefalica è ridotta. L’aumento della connettività delle regioni sottocorticali e corticali coinvolte nell’elaborazione dei segnali sensoriali e spaziali-visivi supporta l’ipotesi di un sovraccarico nel circuito dei gangli basali che alla fine porta al verificarsi del FOG [13].
Nel trattamento, occorre distinguere tra la FOG che si verifica durante lo stato di assunzione o di sospensione dei farmaci nei pazienti con PD. La FOG durante lo stato di riposo può essere migliorata ottimizzando la terapia farmacologica. L’attenzione focalizzata e gli stimoli esterni (“spunti”) possono aiutare a superare il FOG. L’addestramento tramite cueing a casa ha avuto effetti positivi sul FOG, sull’andatura e sull’equilibrio [14]. La diminuzione dell’efficacia dopo la fine di questo intervento dimostra la necessità di dispositivi di “cueing” applicabili in modo permanente. I dispositivi “open-loop”, che offrono stimoli visivi o uditivi con un ritmo prestabilito, possono migliorare l’andatura, ma sono spesso inaffidabili o possono peggiorare la FOG in alcuni pazienti. Nel 2010 è stato già sviluppato un dispositivo portatile per il rilevamento in tempo reale del FOG, che fornisce automaticamente uno stimolo acustico quando viene rilevato il FOG, che dura fino a quando la persona riprende a camminare. Questo dispositivo ha rilevato il FOG online con una sensibilità del 73,1% e una specificità dell’81,6%. L’efficacia di un altro dispositivo indossabile “a circuito chiuso” con stimoli visivi-acustici è stata studiata in tredici pazienti affetti da malattia di Parkinson con FOG nello stato non medicalizzato [15]. Dopo una sessione di allenamento e la rimozione del dispositivo, la velocità di camminata e la lunghezza del passo sono migliorate. Da allora, il numero di dispositivi che si occupano della previsione o del rilevamento del FOG è aumentato in modo significativo. Secondo una recente revisione, finora sono stati descritti 68 dispositivi di questo tipo [16]. Finché i dispositivi “a circuito chiuso” non saranno utilizzati nella pratica clinica quotidiana, le tecniche convenzionali di “cueing” continueranno a svolgere il ruolo più importante nel trattamento fisioterapico e nella fornitura di aiuti.
Terapie assistite da robot
Nel caso delle terapie assistite da robot, è stato studiato in particolare l’addestramento alla deambulazione per i pazienti con Parkinson. L’addestramento alla deambulazione assistito da robot si distingue tra tecnologia basata sull’esoscheletro e tecnologia basata sull’end-effector (Fig. 1) . Il primo utilizza un esoscheletro adattato al corpo e muove direttamente le estremità. Al contrario, i robot basati sugli end effector muovono le estremità inferiori tramite le piastre plantari. Finora sono stati esaminati dispositivi di entrambi i gruppi, come il Lokomat®, il “Gait Trainer” e il robot G-EO. Nella maggior parte degli studi, l’allenamento al passo assistito da robot è stato confrontato con l’allenamento su tapis roulant. Sebbene in alcuni studi l’addestramento alla deambulazione assistito da robot abbia ottenuto risultati migliori rispetto all’addestramento su tapis roulant in alcuni aspetti, la situazione dei dati è ancora insufficiente e in parte incoerente. Tuttavia, diversi studi indicano che l’addestramento alla deambulazione assistito da robot è superiore all’addestramento con tapis roulant nel trattamento della FOG [17].
Realtà virtuale
La realtà virtuale è sempre più utilizzata nella neuroriabilitazione, soprattutto per i disturbi dell’andatura e dell’equilibrio nei pazienti con Parkinson. La WiiTM con “balance board” di Nintendo e la Xbox Kinect™ di Microsoft sono state spesso esaminate. Entrambi i sistemi sembrano essere adatti alla neuroriabilitazione dei pazienti con Parkinson [18]. Anche le aziende di tecnologia medica nel campo della neuroriabilitazione si stanno rivolgendo sempre più all’integrazione della realtà virtuale o aumentata nei loro prodotti. Nonostante l’evidenza che la realtà virtuale porti a una riabilitazione più efficace e meno lunga rispetto alle terapie convenzionali, attualmente esistono pochi dati a sostegno di questa affermazione [19]. Tuttavia, si può presumere che l'”exergaming” continuerà ad essere accettato nella neuroriabilitazione, con la speranza che si possano ottenere allo stesso tempo effetti positivi sulla cognizione.
Messaggi da portare a casa
- Soprattutto nella malattia di Parkinson avanzata, le terapie non farmacologiche stanno acquisendo importanza.
- C’è la speranza che l’attività fisica abbia un’influenza positiva sul decorso della malattia nella malattia di Parkinson.
- I sintomi assiali, come la camptocoria o la FOG, rappresentano un problema terapeutico particolare nella malattia di Parkinson.
- Si prevede che le tecnologie innovative e l’uso della realtà virtuale saranno sempre più utilizzate nella neuroriabilitazione per la malattia di Parkinson.
Letteratura:
- Yang F, et al: Attività fisica e rischio di malattia di Parkinson nella coorte nazionale svedese di marzo. Brain 2015; 138(2): 269-275.
- Comella CL, et al: Terapia fisica e malattia di Parkinson: uno studio clinico controllato. Neurologia 1994; 44 (3): 376-378.
- Farley BG, Koshland GF: Allenare i grandi a muoversi più velocemente: l’applicazione della relazione velocità-ampiezza come strategia di riabilitazione per le persone con la malattia di Parkinson. Exp Brain Res 2005; 167(3): 462-467.
- Li F, et al. Tai chi e stabilità posturale nei pazienti con malattia di Parkinson. N Engl J Med 2012; 366(6): 511-519.
- Ebersbach G, et al.: Confronto dell’esercizio fisico nella malattia di Parkinson – lo studio Berlin LSVT®BIG. Mov Disord 2010; 25(12): 1902-1908.
- Shulman LM, et al: Studio clinico randomizzato di 3 tipi di esercizio fisico per i pazienti con malattia di Parkinson. JAMA Neurol 2013; 70(2): 183-190.
- Sturkenboom IH, et al: Efficacia della terapia occupazionale per i pazienti con la malattia di Parkinson: uno studio controllato randomizzato. Lancet Neurol 2014; 13: 557-566.
- Schenkman M, et al: Effetto dell’esercizio sul tapis roulant ad alta intensità sui sintomi motori nei pazienti con malattia di Parkinson de novo: una triade clinica randomizzata di fase. JAMA Neurol 2018; 75(2): 219-226.
- van der Kolk NM, et al: Efficacia dell’esercizio aerobico a domicilio e supervisionato a distanza nella malattia di Parkinson: esercizio aerobico randomizzato in doppio cieco nella malattia di Parkinson. Lancet Neurol 2019; 18(11): 998-1008.
- Tinazzi M, et al: Anomalie posturali nella malattia di Parkinson: uno studio multicentrico epidemiologico e clinico. Mov Disord Clin Pract 2019; 6(7): 576-585.
- Margraf NG, et al: Consenso per la misurazione dell’angolo di camptocormia nel paziente in piedi. Parkinsonism Relat Disord 2018; 52: 1-5.
- Gandolfi M, et al: Un programma di esercizi specifici per il tronco della durata di quattro settimane riduce la flessione in avanti del tronco nella malattia di Parkinson: uno studio controllato in singolo cieco e randomizzato. Parkinsonism Relat Disord 2019; 64:268-274.
- Nutt JG, et al: Il congelamento dell’andatura: un passo avanti su un fenomeno clinico misterioso. Lancet Neurol 2011; 10(8):734-744.
- Potvin-Desrochers A, et al: Cambiamenti nella connettività funzionale allo stato di riposo correlati al congelamento dell’andatura nella malattia di Parkinson. Neuroscienze 2019; 418: 311-317.
- Nieuwboer A, et al.: L’addestramento al cueing in casa migliora la mobilità legata al cammino nella malattia di Parkinson: lo studio RESCUE. J Neurol Neurosurg Psychiatry 2007; 78(2): 134-140.
- Espay AJ, et al. L’allenamento a casa con un dispositivo di cueing a circuito chiuso a realtà aumentata per migliorare l’andatura nei pazienti con malattia di Parkinson. J Rehabil Res Dev 2010; 47: 573-581.
- Pardoel S, et al: Rilevamento e previsione del congelamento dell’andatura nella malattia di Parkinson, basato su sensori indossabili: una revisione. Sensori 2019; 19(23): 5141.
- Cappeci M, et al.: Effetti clinici dell’addestramento al passo assistito da robot e dell’addestramento sul tapis roulant per la malattia di Parkinson. Uno studio controllato randomizzato. Ann Phys Rehabil Med 2019; 62(5): 303-312.
- Marotta N, et al: Nintendo WiiTM rispetto a Xbox KinectTM per la locomozione funzionale nelle persone con malattia di Parkinson: una revisione sistematica e una meta-analisi di rete. Disabil Rehabil 2020; doi:10.1080/09638288.1768301.
- Canning CG, et al: La realtà virtuale nella ricerca e nella riabilitazione dell’andatura e dell’equilibrio nella malattia di Parkinson. Nat Rev Neurol 2020; 16(8): 409-425.
InFo NEUROLOGIA & PSICHIATRIA 2020; 18(5): 6-9.