Il cancro ovarico è diventato una malattia cronica. Le sequenze terapeutiche con la chirurgia, le terapie sistemiche additive e palliative, oltre alle terapie di mantenimento in diverse linee sono complesse. La discussione dei dati attuali aiuta a implementarli nella pratica clinica.
Il tumore ovarico è diventato una malattia cronica, le sequenze terapeutiche con la chirurgia, le terapie sistemiche additive e palliative, oltre alle terapie di mantenimento in varie linee sono complesse. Come dobbiamo applicare i numerosi nuovi dati nella vita quotidiana? Le linee guida ESMO/ESGO pubblicate di recente [1] sono un utile orientamento. Questo articolo di revisione illustra le novità e le cose importanti del 2019.
Il tumore ovarico, di cui il 90% è di origine epiteliale, è il tumore ginecologico con la mortalità di gran lunga più elevata nei Paesi industrializzati. In Europa, circa 65.000 donne contraggono la malattia ogni anno e circa 42.000 ne muoiono. Purtroppo, in circa due terzi dei casi, la diagnosi viene fatta solo negli stadi avanzati (FIGO III, IV), quando la malattia è già riuscita a diffondersi al di fuori della pelvi. La sopravvivenza a 5 anni è solo del 20-30% circa [2]. Purtroppo, non disponiamo di esami di screening per la diagnosi precoce che migliorerebbero la prognosi (ad esempio, ecografia transvaginale, determinazione dei marcatori tumorali [CA-125]) [3]. Con approcci terapeutici ottimizzati, si stanno compiendo sforzi intensi per migliorare la prognosi delle donne affette da cancro ovarico. C’è ancora un grande bisogno di azione in questo campo.
Trattamento primario
Chirurgia o chemioterapia: cosa viene prima? La chirurgia citoriduttiva massima con l’obiettivo di liberare il tumore macroscopico al termine dell’intervento è fondamentale per la prognosi [4].
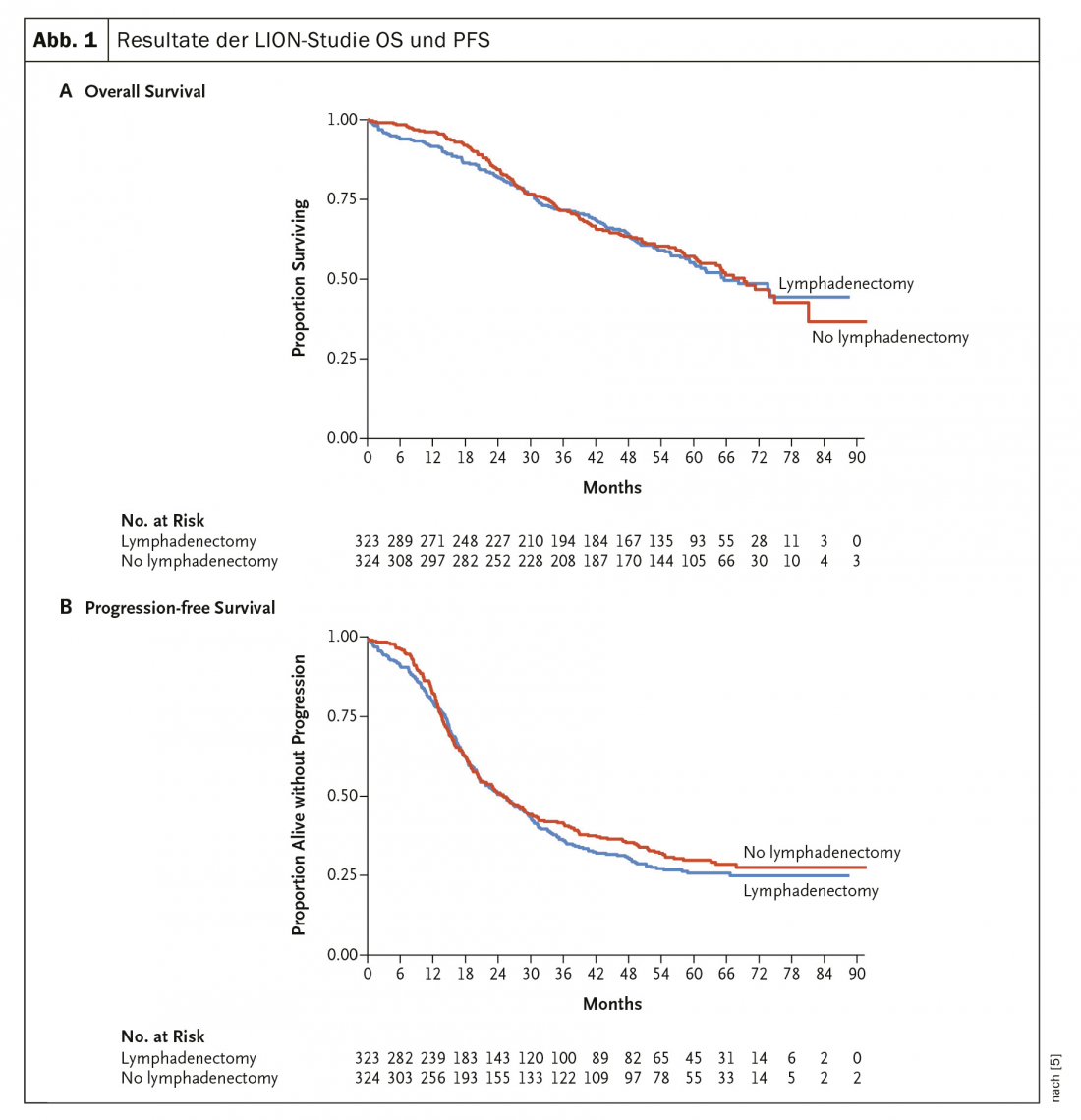
Nel 2019, sono stati pubblicati i risultati (tanto attesi) dello studio LION [5], che ha studiato il valore della linfoadenectomia di routine nel carcinoma ovarico avanzato (Fig. 1) . Né la PFS né la OS hanno mostrato alcuna differenza in questo studio randomizzato. La linfoadenectomia sistematica paraaortica e pelvica in caso di linfonodi preoperatori e intraoperatori poco evidenti in caso di resezione completa non è quindi più raccomandata. Negli stadi avanzati, la chemioterapia additiva con carboplatino e taxolo è standard.
La chirurgia dovrebbe essere eseguita per prima, seguita dalla chemioterapia, o ci sono prove che i pazienti traggono beneficio dalla terapia sistemica primaria seguita dalla chirurgia? Uno studio EORTC e lo studio CHORUS [6,7] hanno mostrato risultati comparabili per entrambe le opzioni in termini di PFS e OS nei pazienti con malattia in stadio IIIC o IV.
Di conseguenza, la raccomandazione dell’ESMO/ESGO è ora quella di scegliere un approccio chirurgico primario (UDS, upfront debulking surgery) se è possibile ottenere una clearance macroscopica del tumore (in base alla stadiazione preoperatoria) e se si presume una morbilità accettabile [1]. Se questo non è il caso, deve essere somministrata una terapia sistemica primaria.
Tuttavia, la mancanza di esperienza dei chirurghi in questi studi è spesso criticata, motivo per cui è in corso uno studio multicentrico internazionale (Trial on Radical Upfront Surgical Therapy TRUST) in cui i chirurghi partecipanti devono qualificarsi in base a criteri selezionati. I risultati sono attesi intorno al 2024.
Quali opzioni abbiamo per migliorare la prognosi con le terapie di sistema disponibili? Lo studio giapponese JGOG3016 ha dimostrato che un trattamento cosiddetto dose-denso con paclitaxel 80 mg/m2 settimanale in combinazione con carboplatino ha ottenuto un chiaro miglioramento della sopravvivenza mediana libera da progressione e della sopravvivenza globale rispetto al trattamento standard [8]. Tuttavia, questo regime terapeutico è difficilmente applicabile in Europa a causa della notevole tossicità, tanto che le nuove linee guida ESMO/ESGO non lo raccomandano per i pazienti dei Paesi occidentali [1].
Bevacizumab nel trattamento di prima linea
Bevacizumab, un anticorpo monoclonale anti-VEGF, è approvato in combinazione con la chemioterapia nella cosiddetta situazione ad alto rischio, nel tipo più comune di cancro ovarico, quello sieroso di alto grado (HGSC). Le formazioni tumorali residue post-operatorie ≥1 cm o lo stadio FIGO IV sono considerate ad alto rischio. Bevacizumab ha dimostrato di migliorare la PFS in diversi studi randomizzati. Un beneficio in termini di sopravvivenza è stato descritto solo nello studio ICON7 [9,10]. Non è noto un biomarcatore predittivo per la terapia con bevacizumab.
Terapia di mantenimento in prima linea
Bevacizumab viene utilizzato in situazioni ad alto rischio prima in combinazione con la chemioterapia additiva e poi come mantenimento alla dose di 15 mg/kg o 7,5 mg/kg ogni 3 settimane per un massimo. 15 mesi consigliato [1,9,10].
Inibitori della poli(ADP-ribosio) polimerasi (PARP): Circa il 50% dei carcinomi ovarici epiteliali (EOC) presenta meccanismi di riparazione del DNA carenti attraverso la ricombinazione omologa . Questa circostanza spiega anche la forte efficacia del consiglio di amministrazione dell’EOC. Gli inibitori della PARP portano alla cosiddetta letalità sintetica nelle cellule con deficit di HR. Tuttavia, mostrano anche un’efficacia nei pazienti senza difetti comprovati nei geni HR. Sono stati testati diversi inibitori di PARP (olaparib, niraparib, rucaparib e altri).
I risultati dello studio SOLO1, che ha mostrato un miglioramento del 70% della PFS rispetto al placebo nelle pazienti BRCA-mutate che ricevevano una terapia di mantenimento di prima linea con olaparib, hanno attirato una notevole attenzione [11,12]. La consulenza e i test genetici (tempestivi) per quanto riguarda il mantenimento di olaparib in questa situazione sono ora fortemente raccomandati [1].
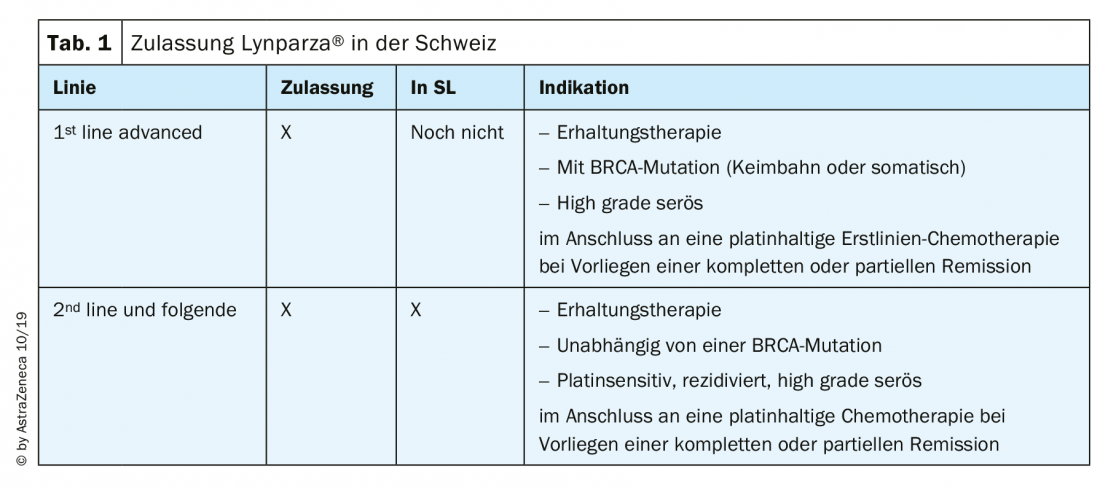
Le due sostanze più utilizzate in Svizzera, olaparib (Lynparza®) e niraparib (Zejula®), sono approvate e disponibili in Svizzera per il tumore ovarico come segue (Tab. 1): Il niraparib è stato approvato per la terapia di mantenimento nel carcinoma ovarico platino-sensibile recidivato dall’agosto 2019, indipendentemente dallo stato di mutazione BRCA [13]. All’ESMO 2019 sono stati presentati numerosi dati sugli inibitori PARP, che ora vengono discussi intensamente.
Procedura pratica per il trattamento di prima linea
Nella nostra clinica, offriamo a tutte le pazienti con carcinoma ovarico non mucinoso di ricevere una consulenza genetica e un test per le mutazioni BRCA1/2 (per lo più germinali, raramente somatiche). Questo avviene di solito durante la chemioterapia additiva. Nel caso di una mutazione BRCA1,2, olaparib viene utilizzato come mantenimento; nel caso di BRCA wild type, si utilizza la terapia di mantenimento con bevacizumab se bevacizumab era già stato utilizzato durante la chemioterapia.
In caso di recidiva sensibile al platino, si può aggiungere la terapia di mantenimento con niraparib, indipendentemente dallo stato di mutazione BRCA1,2. In un’eventuale ulteriore recidiva, si ricorre al bevacizumab, in combinazione con le platine se ancora sensibili.
Il test genetico è chiaramente raccomandato nelle linee guida ESMO/ESGO, da un lato perché è predittivo di una risposta, dall’altro perché consente ai membri sani della famiglia di essere consigliati e testati in una fase precoce [1].
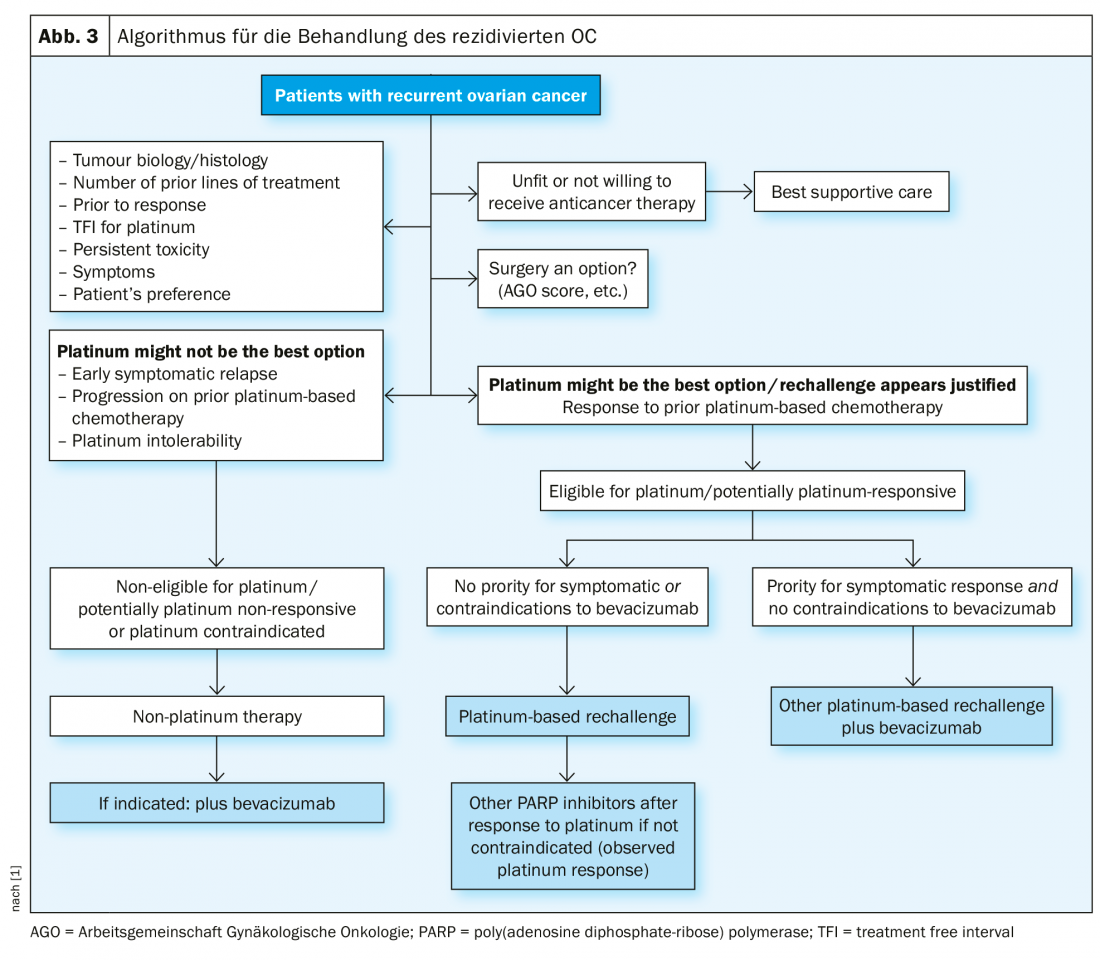
Trattamento ricorrente
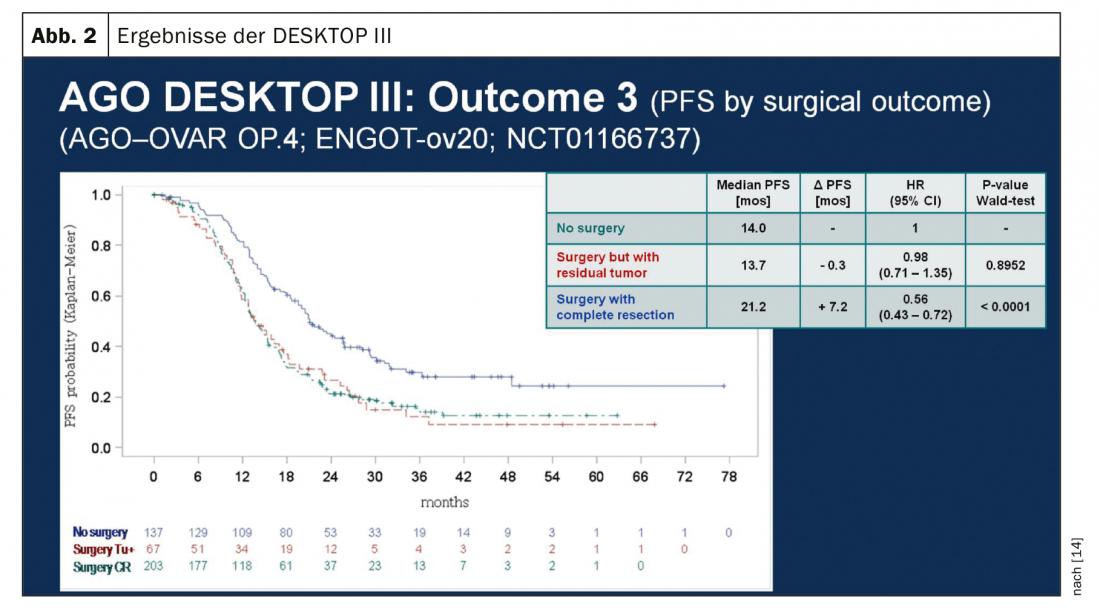
In caso di recidiva sensibile al platino, un’altra operazione citoriduttiva è un’opzione terapeutica, se in questo modo si può ottenere la liberazione macroscopica del tumore. I risultati dello studio DESKTOP III del Working Group on Gynaecological Oncology (AGO) hanno dimostrato un miglioramento della PFS con la chirurgia, esclusivamente quando è stato possibile ottenere la rimozione chirurgica completa [14]. I dati sulla OS non sono ancora stati pubblicati (Fig. 2). Nel caso di sensibilità al platino, sono state testate numerose terapie di combinazione (Tab. 2).
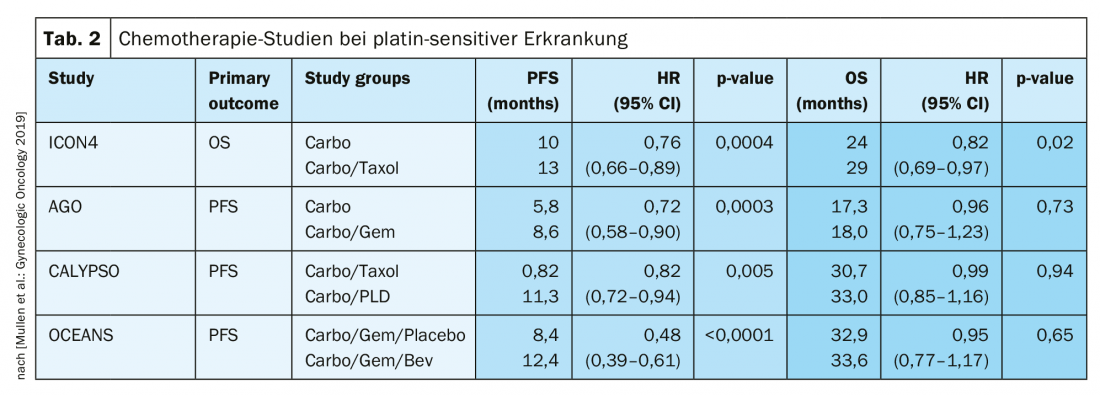
La sensibilità del platino viene ridefinita
In passato, un intervallo di 6 mesi dall’ultima terapia con platino era considerato una forte indicazione di una rinnovata sensibilità al platino. Tuttavia, ciò non riflette il fatto che questo periodo dovrebbe essere visto come un continuum. Per questo è stato scelto il termine “idoneità al platino”. La definizione di resistenza al platino è nuova:
-
Resistenza al platino confermata: progressione sotto chemioterapia contenente platino
- Sospetta resistenza al platino: Recidiva sintomatica precoce con bassa probabilità di ulteriore risposta al platino [1].
In questa situazione terapeuticamente difficile, sono adatti i regimi terapeutici senza platino, se necessario in combinazione con bevacizumab [15]. Tra l’altro, è stato presentato all’ASCO 2018 che la ri-somministrazione di bevacizumab migliora la PFS, anche se precedentemente utilizzata [16].
Inibitori PARP
Nel contesto della recidiva, la risposta al platino è il miglior marcatore predittivo dell’efficacia degli inibitori PARP come terapia di mantenimento. La terapia di mantenimento con olaparib dopo la chemioterapia contenente platino ha mostrato un miglioramento della PFS nelle pazienti con mutazioni BRCA1/2 nel cosiddetto Studio 19 [17] e nello studio SOLO2 [18]. Sono seguiti altri inibitori di PARP, ad esempio niraparib (studio NOVA [19], rucaparib (ARIEL3 [20]).
Lo studio NOVA ha dimostrato chiaramente che la PFS è migliorata con niraparib rispetto al placebo sia nelle pazienti con mutazioni BRCA che in quelle di tipo selvaggio, anche se il beneficio è stato maggiore nelle pazienti con mutazioni BRCA. Gli studi sulle terapie di mantenimento con olaparib e niraparib hanno anche dimostrato che il tempo fino alla successiva chemioterapia può essere significativamente prolungato. Si tratta di un endpoint clinicamente assolutamente significativo. La tollerabilità degli inibitori della PARP è solitamente buona; occasionalmente sono necessarie riduzioni della dose (Fig. 3).
Sommario
La terapia standard di prima linea per il tumore ovarico epiteliale (per lo più sieroso di alto grado) è la chirurgia e la chemioterapia a base di platino. Ai pazienti deve essere offerta una consulenza genetica precoce e un test (somatico o germinale), soprattutto perché la terapia di mantenimento con olaparib migliora significativamente la sopravvivenza libera da progressione nei pazienti BRCA1,2-mutati. Bevacizumab viene continuato come mantenimento se è già stato utilizzato in combinazione con la chemioterapia additiva.
Nella recidiva sensibile al platino (nuova definizione, cosiddetta platino-eleggibile), si può prendere in considerazione, in determinate condizioni, una nuova procedura chirurgica, seguita da una chemioterapia contenente platino, eventualmente in aggiunta a bevacizumab (che può poi essere continuato come mantenimento). Dopo la risposta al platino nella situazione di recidiva, l’inibitore PARP niraparib è approvato in Svizzera per le pazienti BRCA-mutate e wild-type. Quando il platino non è più indicato, sono disponibili anche regimi terapeutici senza platino. L’immunoterapia per il cancro ovarico è attualmente in fase di rapido sviluppo; nessuna sostanza è stata ancora approvata come terapia standard [21].
Messaggi da portare a casa
- Il cancro ovarico è il tumore ginecologico con la più alta mortalità nel mondo occidentale.
- Le sequenze complesse con chirurgia e terapie sistemiche migliorano la prognosi e la qualità di vita.
- Sono disponibili terapie di mantenimento con bevacizumab e inibitori PARP.
- Le linee guida ESMO/ESGO appena pubblicate forniscono informazioni sulle attuali raccomandazioni terapeutiche.
- In futuro sono previste ulteriori indicazioni per gli inibitori PARP(1a linea, BRCA non mutato).
- L’immunoterapia è oggetto di numerosi studi di fase III in tutto il mondo, ma non è ancora un trattamento standard per il cancro ovarico.
Letteratura:
- Raccomandazioni della conferenza di consenso ESMO-ESGO sul carcinoma ovarico: patologia e biologia molecolare, stadi precoci e avanzati, tumori borderline e malattia ricorrente. Colombo, C. Sessa, et al. Annali di Oncologia 30: 672-705, 2019.
- THE-WORLD-OVARIAN-CANCER-COALITION-ATLAS-2018.pdf, su www.worldovariancancercoalition.org
- Screening per il cancro ovarico, US Preventive Services Task Force JAMA. 2018
- du Bois A, et al: Ruolo dell’esito chirurgico come fattore prognostico nel cancro ovarico epiteliale avanzato Cancer 2009.
- Harter P, et al: Uno studio randomizzato sulla linfoadenectomia in pazienti con neoplasie ovariche avanzate LION NEJM 380; 9 28 febbraio 2019.
- Vergote I, Tropé CG, Amant F, et al: Chemioterapia neoadiuvante o chirurgia primaria nel carcinoma ovarico in stadio IIIC o IV. N Engl J Med 2010.
- Kehoe S, Hook J, Nankivell M, et al: Chemioterapia primaria rispetto alla chirurgia primaria per il carcinoma ovarico avanzato di nuova diagnosi (CHORUS): uno studio in aperto, randomizzato, controllato, di non inferiorità. Lancet 2015.
- Katsumata N, et al: Risultati a lungo termine di paclitaxel e carboplatino ad alta densità di dose rispetto a paclitaxel e carboplatino convenzionali per il trattamento del carcinoma epiteliale avanzato dell’ovaio, delle tube di Falloppio o del peritoneo primario (JGOG 3016): uno studio randomizzato, controllato, in aperto. Lancet Oncol 2013.
- Burger RA, et al: Incorporazione di bevacizumab nel trattamento primario del carcinoma ovarico. N Engl J Med 2011
- Perren TJ, et al: Uno studio di fase 3 sul bevacizumab nel carcinoma ovarico. N Engl J Med 2011.
- Murai SY, Huang B, Das A, et al: Intrappolamento di PARP1 e PARP2 da parte di inibitori clinici di PARP, Cancer Res 2012.
- Moore K, et al: Olaparib di mantenimento nelle pazienti con cancro ovarico avanzato di nuova diagnosi. NEJM ottobre 2018.
- www.spezialitaetenliste.ch
- Du Bois A, et al: Studio randomizzato controllato di fase III che valuta l’impatto della chirurgia citoriduttiva secondaria nel carcinoma ovarico ricorrente: AGO DESKTOP III/ENGOT ov20. J Clin Oncol 2017; 35(15_Suppl): 5501
- Pujade E, et al: Bevacizumab combinato con la chemioterapia per il cancro ovarico ricorrente resistente al platino: lo studio di fase III randomizzato in aperto AURELIA, JCO maggio 2014.
- Pignata S, et al: Chemioterapia più o meno bevacizumab per le pazienti con carcinoma ovarico sensibile al platino in recidiva dopo un trattamento di prima linea contenente bevacizumab: lo studio randomizzato di fase 3 MITO16B-MaNGO OV2B-ENGOT OV17. J Clin Oncol 2018;36(15_Suppl).
- Ledermann JA, et al: Terapia di mantenimento con Olaparib nelle pazienti con carcinoma ovarico sieroso recidivato sensibile al platino: un’analisi retrospettiva pre-pianificata dei risultati in base allo stato BRCA in uno studio di fase 2 randomizzato. Lancet Oncol 2014.
- Pujade-Lauraine E, et al: Olaparib in compresse come terapia di mantenimento nelle pazienti con carcinoma ovarico recidivato, sensibile al platino e con una mutazione BRCA1/2 (SOLO2/ENGOT-Ov21): uno studio di fase 3 in doppio cieco, randomizzato, controllato con placebo. Lancet Oncol 2017
- Mirza MR, et al: Terapia di mantenimento con niraparib nel carcinoma ovarico ricorrente sensibile al platino. N Engl J Med 2016.
- Coleman RL, et al: Trattamento di mantenimento con rucaparib per il carcinoma ovarico ricorrente dopo la risposta alla terapia con platino (ARIEL3): uno studio di fase 3 randomizzato, in doppio cieco, controllato con placebo, Lancet 2017.
- Marth C, et al: Immunoterapia nel cancro ovarico: fake news o vero affare? Int J Gynecol Cancer 2019.
InFo ONCOLOGIA & EMATOLOGIA 2019; 7(6): 6-10.