Un tempo azzardato, ora terapia standardizzata: il trapianto di fegato ortotopico dà a molti pazienti la speranza di una vita normale.
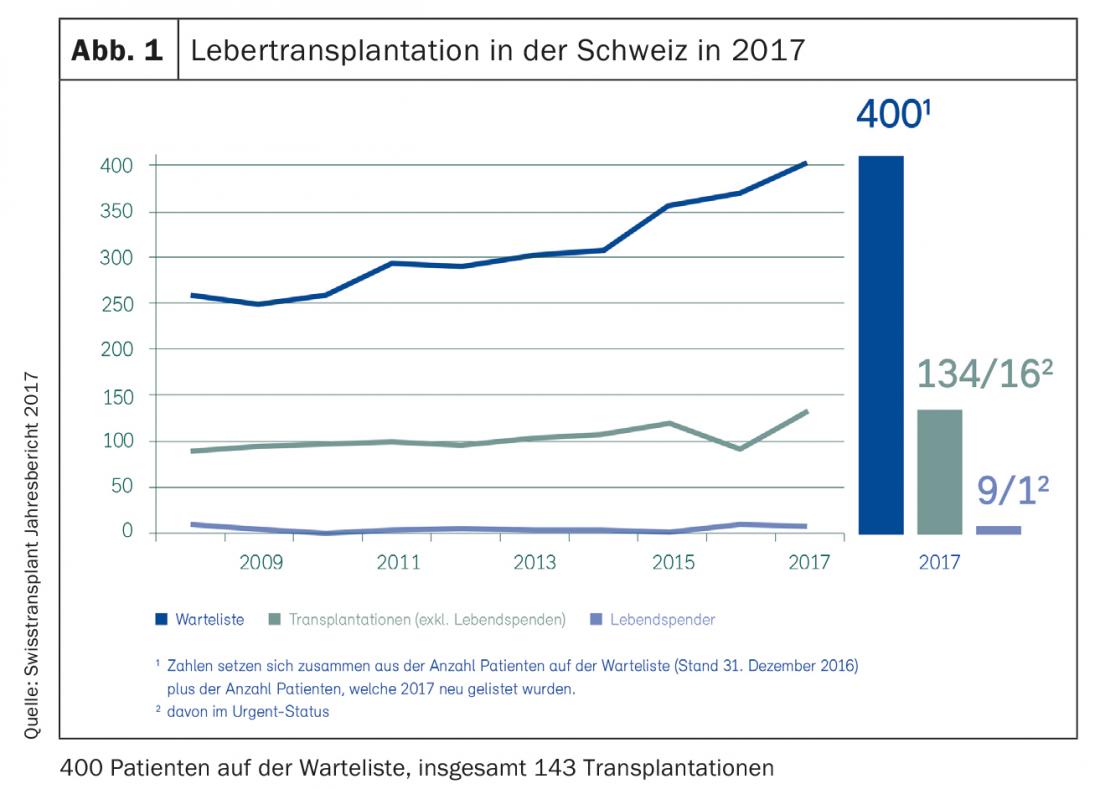
In Europa, ogni anno vengono eseguiti più di 10.000 trapianti di fegato; in Svizzera, sono circa 150 (Fig. 1) [1]. Il numero di pazienti in lista d’attesa è in costante aumento, così come il numero di coloro che muoiono in lista d’attesa perché non si è reso disponibile in tempo un organo da donatore adatto. Se 30 anni fa il trapianto ortotopico di fegato (OLT) richiedeva chirurghi temerari e pazienti coraggiosi, i progressi nella tecnica chirurgica, nella gestione perioperatoria e nella terapia immunosoppressiva hanno reso l’OLT una terapia sicura e altamente standardizzata. I riceventi e i donatori significativamente più anziani e multimorbidi hanno modellato e modificato il profilo di rischio negli ultimi anni. Tuttavia, la OLT rimane l’unica possibilità per molti pazienti di tornare a condurre una vita normale.
Indicazioni per il trapianto di fegato
Le indicazioni per l’OLT possono essere suddivise in insufficienza epatica acuta, complicazioni dell’epatopatia cronica in fase avanzata di cirrosi epatica e malattie metaboliche epatiche con manifestazione sistemica. (Tab. 1). La diagnosi di cirrosi non implica necessariamente la necessità di una OLT; piuttosto, l’indicazione deve essere fatta in base al decorso clinico, tenendo conto delle complicanze e della loro curabilità [2].

L’assegnazione degli organi dei donatori in Svizzera viene effettuata a livello centrale da Swisstransplant ed è regolata dalla legge. In Germania, Austria e Svizzera, il punteggio MELD, composto dal rapporto internazionale normalizzato (INR), dalla bilirubina e dalla creatinina, viene utilizzato per l’assegnazione del trapianto. Oltre a questi parametri, nella pratica clinica quotidiana esistono numerosi sintomi che comportano una notevole riduzione della qualità di vita (ad esempio, prurito, ascite refrattaria alla terapia) o sono associati a un aumento della mortalità in lista d’attesa (in particolare l’iponatriemia nei pazienti cirrotici). Dopo una valutazione individuale, questo può giustificare la richiesta di un regolamento speciale. Alcune indicazioni ricevono un punteggio elevato indipendentemente dal punteggio MELD calcolato, in particolare il carcinoma epatocellulare (HCC) e alcune complicanze sistemiche e malattie metaboliche (ad esempio, la sindrome epatopolmonare, la polineuropatia amiloide familiare).
In generale, i pazienti cirrotici dovrebbero essere indirizzati a un centro trapianti dopo che si è verificato il primo scompenso (ad esempio, emorragia da varici, ascite, encefalopatia epatica), in quanto la prognosi della malattia si deteriora notevolmente. Nel caso di un declino costante della funzione di sintesi epatica, la presentazione deve avvenire al più tardi quando si raggiunge un punteggio MELD di >10. A partire da un MELD di ≥15, i benefici di una OLT superano i rischi associati, per cui l’inserimento nella lista d’attesa può avere senso. Il tempo di attesa è molto variabile a seconda del corso clinico, ma in genere si può prevedere un periodo di poco inferiore a un anno. In caso di insufficienza epatica acuta con rapido deterioramento della funzione di sintesi epatica, si prende in considerazione anche una quotazione di massima urgenza. Se nel decorso clinico si sospetta un’insufficienza epatica acuta, è necessario mettersi in contatto con un centro trapianti il prima possibile. Questo va distinto dall’esacerbazione acuta di un’epatopatia cronica, dove non è possibile un’elencazione altamente urgente.
Nel caso di una quotazione regolare, i chiarimenti necessari in anticipo per la quotazione attiva sono organizzati e coordinati dal coordinamento dei trapianti. In ambito ambulatoriale, occorre prestare particolare attenzione alle raccomandazioni sulle malattie infettive relative alle vaccinazioni o alle terapie da effettuare prima di un eventuale trapianto.
Misure durante la fase di attesa
Quando ci si prende cura dei pazienti in lista OLT, bisogna fare attenzione a eseguire uno screening ecografico del carcinoma epatocellulare ogni sei mesi. Le terapie ponte, che prevengono la progressione nell’intervallo prima dell’OLT, devono essere obbligatoriamente prese in considerazione nel caso dell’HCC [3]. La malnutrizione e il metabolismo catabolico con perdita di tessuto muscolare, anche nei pazienti obesi (parola chiave “obesi sarcopenici”), devono essere esaminati come parte del follow-up clinico [4]. Un intervento precoce e aggressivo con l’ottimizzazione dello stato nutrizionale o il miglioramento della funzione muscolare può migliorare significativamente l’esito dopo la OLT (parola chiave “riabilitazione”). In questo caso è necessario un team ben coordinato di epatologi e chirurghi dei trapianti, anestesisti e medici di terapia intensiva, coordinatori dei trapianti, infermieri specializzati, consulenti nutrizionali e fisioterapisti, oltre al medico di famiglia, alla famiglia e, ultimo ma non meno importante, al paziente.
Qualsiasi scompenso o deterioramento delle condizioni generali deve suggerire un’infezione e deve essere chiarito a questo proposito. In caso di deterioramento della funzione di sintesi epatica e di scompenso, è indispensabile una segnalazione tempestiva al centro trapianti competente.
Questo è particolarmente importante perché un’infezione sistemica o una sepsi sono una controindicazione assoluta per la OLT, anche in considerazione della successiva immunosoppressione necessaria. Allo stesso modo, la OLT è controindicata in presenza di una neoplasia attiva extraepatica o localmente avanzata o diffusa intraepatica. Le comorbidità psichiatriche, compreso l’abuso di alcol, a condizione di almeno sei mesi di astinenza dall’alcol, invece, non rappresentano controindicazioni assolute e devono essere esaminate su base interdisciplinare nei singoli casi.
Aspetti chirurgici generali
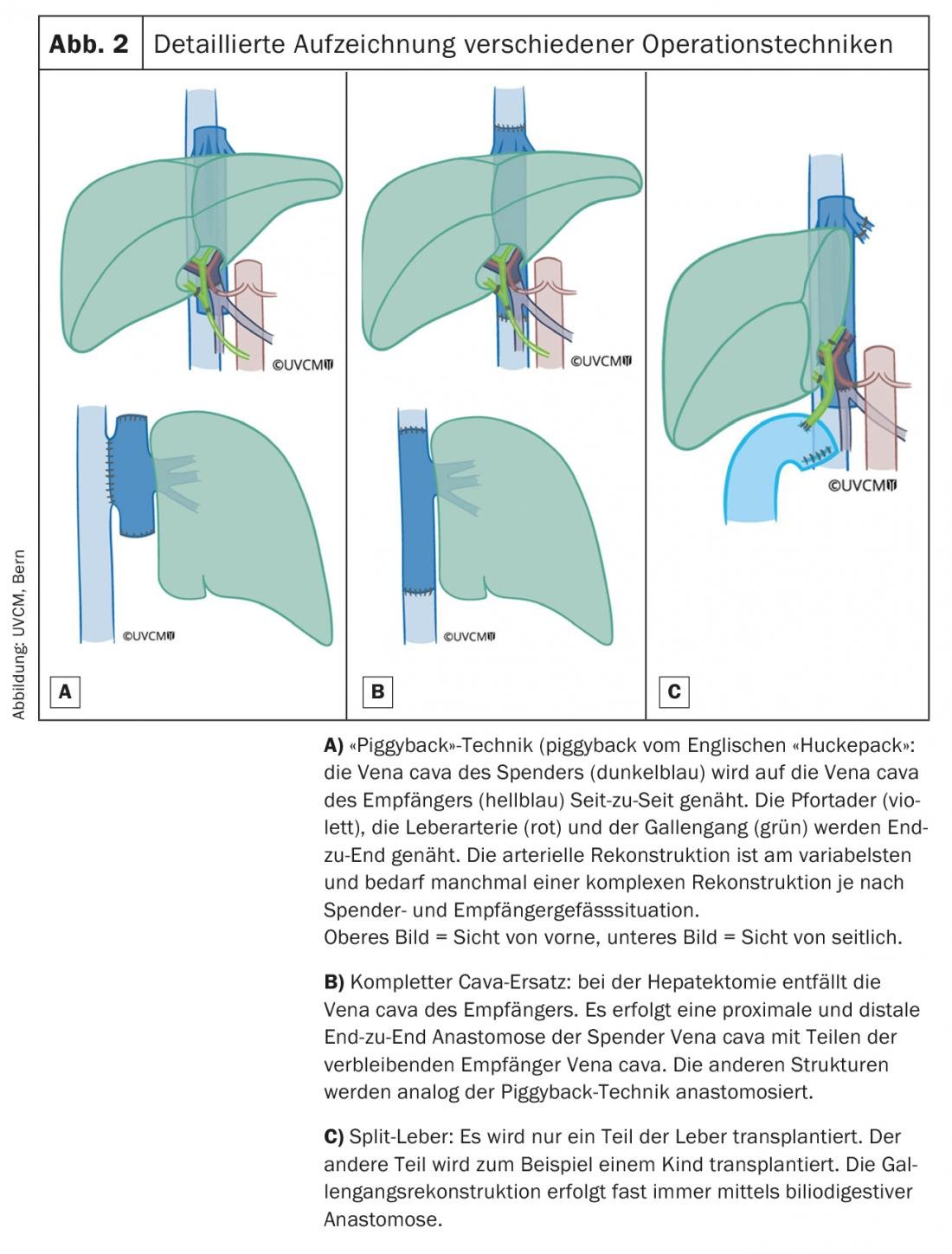
Negli ultimi anni, non solo la sopravvivenza dopo la OLT è migliorata in modo significativo (sopravvivenza a 1 anno all’83%, sopravvivenza a 5 anni al 71%), ma anche il tempo di recupero completo [5]. Tempi di intervento significativamente più brevi (4 ore rispetto alle precedenti >12 ore) e una migliore gestione perioperatoria significano che l’estubazione può spesso essere effettuata molto rapidamente con una corrispondente breve permanenza nell’unità di terapia intensiva. Nel 2018, la durata mediana della degenza post-operatoria nell’unità di terapia intensiva dell’Inselspital Bern <è stata di 24 ore e la durata mediana della degenza in ospedale è stata di 8 giorni. Con poche eccezioni, di solito i pazienti possono tornare direttamente al loro ambiente domestico. La Figura 2 offre una panoramica dettagliata delle tecniche chirurgiche utilizzate per l’impianto dell’organo del donatore.
Tipo di fegato del donatore
In Svizzera, la maggior parte dei pazienti riceve un fegato da un donatore deceduto. Di solito si tratta di un donatore con danno o malattia cerebrale primaria, con perdita irreversibile della funzione dell’intero cervello, compreso il tronco encefalico (la cosiddetta morte cerebrale; nota anche come “donazione dopo la morte cerebrale”, “DBD”). Un’altra possibilità è il prelievo di un fegato da un donatore con arresto circolatorio persistente, che porta secondariamente alla morte a causa della mancanza di perfusione del cervello e del tronco encefalico. Si tratta di un donatore cosiddetto “DCD”, “donazione dopo morte circolatoria”. Nella donazione di fegato da vivente, viene rimossa solo una parte del fegato. Questo avviene principalmente nei Paesi in cui, a causa di requisiti legali, religiosi e culturali, la donazione di cadavere viene rifiutata.
La donazione di fegato da vivente è anche molto adatta per i programmi di trapianto pediatrico, in quanto i bambini dovrebbero altrimenti aspettare molto a lungo per trovare un organo da donatore adatto. In tutta la Svizzera, la donazione di fegato da vivente viene effettuata raramente. Una possibilità per ampliare il pool di donatori è l’utilizzo di organi di donatori marginali (“donatore con criteri estesi”), cioè il trapianto di organi più anziani (>65-70 anni), organi con un grado di steatosi più elevato o donatori precedentemente positivi all’epatite C, ecc. Anche i fegati DCD rientrano in questa categoria. In tutto il mondo si stanno compiendo sforzi per ridurre il rischio in queste situazioni con l’uso di varie macchine di perfusione, per lo più ex situ. Esistono protocolli basati sull’ipotermia (+/- aggiunta di ossigeno), in base ai quali il fegato viene precondizionato per prevenire le complicanze post-operatorie come la colangiopatia ischemica. Altri gruppi utilizzano la perfusione meccanica normotermica per valutare meglio la funzione degli organi prima dell’impianto. I rapporti iniziali sono promettenti, ma resta da vedere quali protocolli prevarranno alla fine e se entrambe le procedure (in tutte le loro varianti) sono equivalenti [6].
Complicazioni postoperatorie precoci
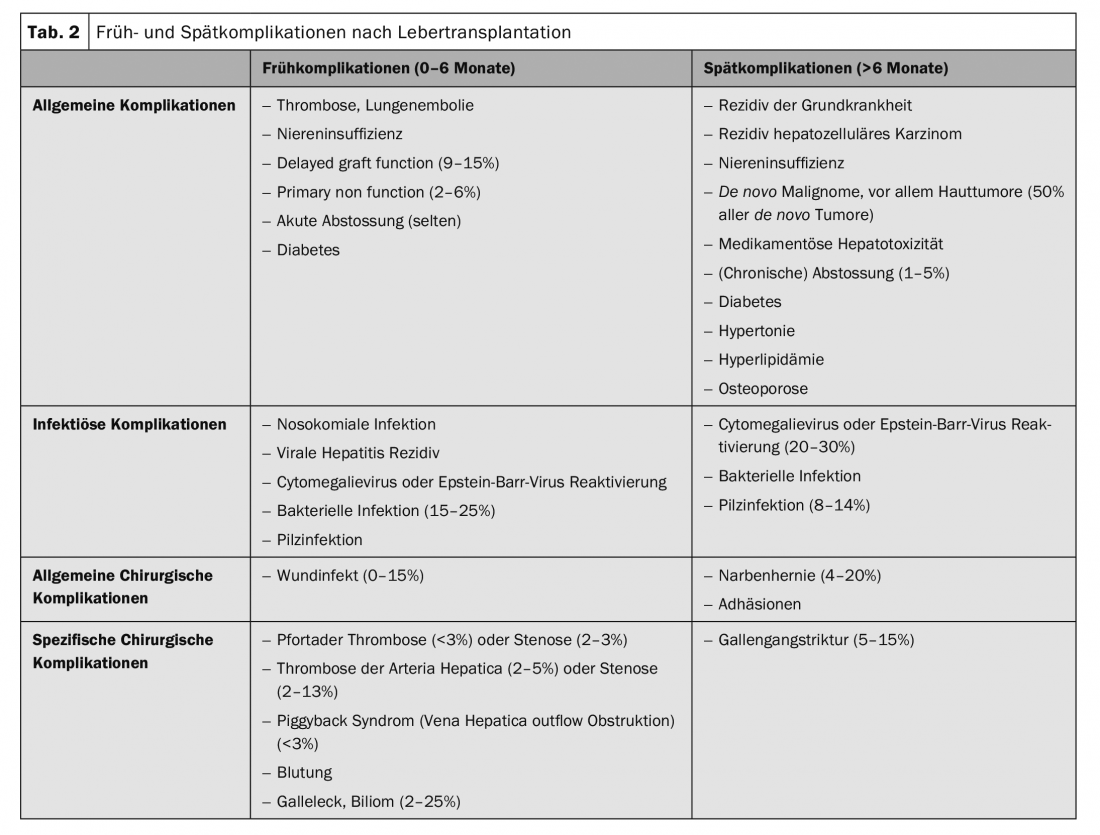
Sebbene la OLT sia diventata molto più sicura negli ultimi anni, ci sono ancora potenziali ostacoli da superare. La tabella 2 offre una panoramica delle complicanze precoci più comuni dopo l’OLT [7–9]. Nel complesso, la morbilità postoperatoria raggiunge il 78%, con una mortalità a 30 giorni del 5,7% [7]. Inoltre, i problemi al dotto biliare e le infezioni rimangono il tallone d’Achille della OLT. Quest’ultimo può essere ridotto in modo significativo utilizzando la dose più bassa possibile di immunosoppressori e vaccinazioni adeguate. Nella stragrande maggioranza dei casi, le strozzature del dotto biliare possono essere trattate per via endoscopica mediante papillotomia, dilatazione e posizionamento di stent. In assenza di una risposta, tuttavia, la revisione chirurgica con l’inserimento di un’epatico-giunostomia è spesso l’unica soluzione definitiva. Difficile è la terapia dei problemi diffusi del dotto biliare intraepatico. Un fenomeno che può verificarsi più frequentemente con i trapianti DCD (colangiopatia diffusa ischemica). In alcune circostanze, il trapianto è l’unica opzione terapeutica sensata in questa situazione.
Soprattutto per i pazienti appena trapiantati, è essenziale contattare tempestivamente il centro trapianti se si sospettano complicazioni, per discutere l’ulteriore procedura.
Follow-up a lungo termine
Le complicanze a lungo termine, che possono verificarsi da mesi ad anni dopo l’OLT, devono essere prese in considerazione nella cura dei pazienti trapiantati, poiché influenzano in modo significativo la prognosi a lungo termine. I sistemi di organi più importanti interessati e le misure raccomandate sono riassunti nella Tabella 3 [10].
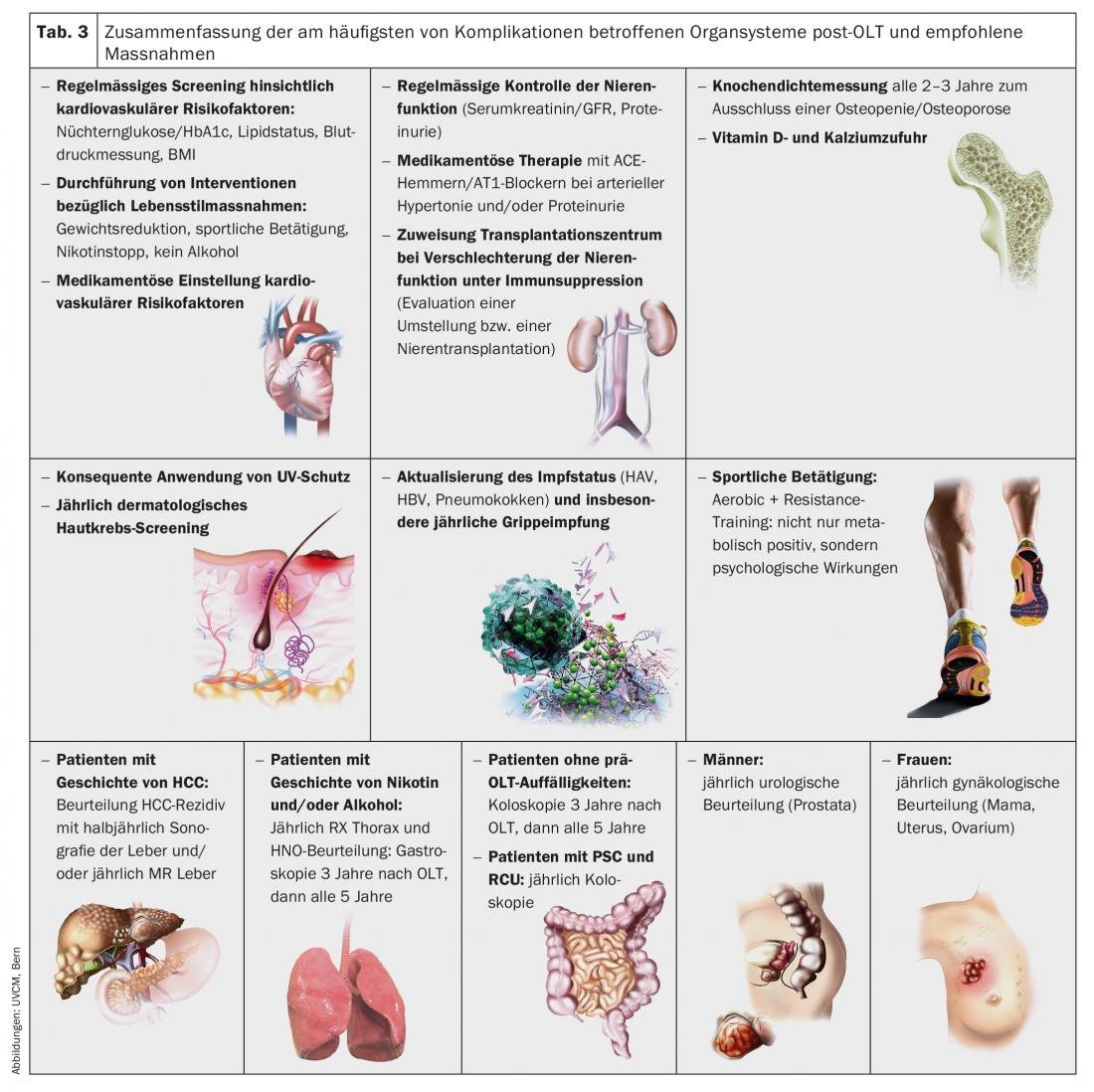
La prevenzione coerente e la regolazione rigorosa dei fattori di rischio cardiovascolare hanno un’influenza rilevante sulla sopravvivenza a lungo termine dopo la OLT. In particolare, la presenza di diabete mellito e di ipertensione arteriosa deve essere controllata regolarmente e trattata a un livello basso mediante misure di stile di vita o farmaci. Se sono presenti fattori di rischio come l’obesità o l’abuso di nicotina, è indicata una consulenza per l’adeguamento dello stile di vita, se necessario attraverso una consulenza specifica sulla dieta o sulla cessazione del fumo.
Obiettivo della terapia: aumentare la qualità della vita.
L’OLT può oggi essere considerata una “procedura di routine” altamente specializzata, con una bassa mortalità perioperatoria e, se correttamente indicata, un ottimo risultato a lungo termine. L’obiettivo finale non è solo quello di alleviare la malattia cronica del paziente a breve termine, ma anche di consentire una buona qualità di vita senza restrizioni significative nella vita quotidiana a lungo termine. In caso di carenza persistente di organi, tuttavia, si spera che in futuro altre terapie, come la terapia cellulare con cellule staminali o l’uso di fegati “bioartificiali”, sostituiscano la necessità di una OLT “classica”.
Messaggi da portare a casa
- I pazienti cirrotici devono essere indirizzati a un centro trapianti dopo che si è verificato il primo scompenso, o al più tardi quando viene raggiunto un punteggio MELD >10.
- La “riabilitazione” con l’ottimizzazione precoce e aggressiva dello stato nutrizionale e della funzione muscolare migliora in modo decisivo l’esito dopo la OLT.
- I progressi nella chirurgia, nell’anestesia e nella gestione perioperatoria dei pazienti dopo la OLT hanno portato a una riduzione significativa del rischio, con un recupero solitamente rapido e tempi di ospedalizzazione brevi.
- I problemi al dotto biliare e le infezioni sono le complicazioni post-operatorie più importanti e il rinvio tempestivo al centro trapianti è assolutamente indicato.
- Si deve procedere a un rigoroso aggiustamento dei fattori di rischio cardiovascolare, poiché questo influisce in modo significativo sulla sopravvivenza a lungo termine dopo la OLT.
Letteratura:
- Swisstransplant. Rapporto annuale 2017. www.swisstransplant.org/fileadmin/user_upload/Swisstransplant/Jahresbericht/SWT_Geschaeftsbericht_A4_2017_de_def_web.pdf, consultato il 17.12.2018
- Martin P, et al: Valutazione per il trapianto di fegato negli adulti: linea guida pratica 2013 dell’Associazione americana per lo studio delle malattie del fegato e della Società americana dei trapianti. Epatologia 2014; 59(3): 1144-1165
- Associazione Europea per lo Studio del Fegato. Linee guida di pratica clinica dell’EASL: gestione del carcinoma epatocellulare. Giornale di epatologia 2018; 69(1): 182-236.
- Associazione Europea per lo Studio del Fegato. Linee guida di pratica clinica dell’EASL sulla nutrizione nelle malattie epatiche croniche. Giornale di epatologia 2019; 70(1): 172-193.
- Registro europeo dei trapianti di fegato, dati dei riceventi. www.eltr.org, ultimo accesso 03 gennaio 2019.
- Jia JJ, et al: Perfusione artificiale per il trapianto di fegato: una revisione concisa degli studi clinici. Malattie epatobiliari e pancreatiche international. HBPD INT 2018; 17(5): 387-391.
- Agopian V, et al: L’evoluzione del trapianto di fegato nel corso di 3 decenni: analisi di 5347 trapianti di fegato consecutivi in un unico centro. Ann Surg 2013; 258(3): 409-421.
- Kochhar G, et al: World J Gastroenterol 2013; 19(19): 2841-2846.
- Piardi T, et al: World J Hepatol 2016; 8(1): 36-57.
- Lucey MR, et al: Gestione a lungo termine del trapianto di fegato adulto riuscito: linea guida pratica 2012 dell’Associazione Americana per lo Studio delle Malattie del Fegato e della Società Americana dei Trapianti. Trapianto di fegato 2013; 19(1): 3-26.
CARDIOVASC 2019; 18(1): 20-25