Cosa bisogna chiarire in caso di valori anomali di TSH? Esiste una disfunzione tiroidea subclinica o manifesta? In quali casi è necessaria la determinazione degli anticorpi o la scintigrafia? Queste e altre domande sul tema delle malattie della tiroide sono state affrontate in occasione della Medicina Interna della FOMF.
In presenza di sintomi e indicazioni cliniche che suggeriscono una malattia della tiroide, sono disponibili le seguenti opzioni diagnostiche: (a) Diagnostica di laboratorio (TSH, fT4 ed eventualmente fT3), (b) Sonografia (principalmente per rilevare i noduli in presenza di struma), (c) Determinazione degli anticorpi (TRAK, TPO, TAK), (d) Aspirazione con ago sottile (per noduli >2 cm), (e) Scintigrafia (per chiarire i noduli tiroidei nell’ipertiroidismo non chiaro) [1].
Se viene rilevata una forma subclinica di ipotiroidismo (TSH troppo alto, fT3 e fT4 nell’intervallo normale), ad esempio durante un esame di routine, il follow-up è essenziale. Il rischio di sviluppare un ipotiroidismo manifesto aumenta se il test degli anticorpi è positivo [2]. Lo stesso vale per l’ipertiroidismo subclinico.

Ipotiroidismo subclinico e manifesto: a cosa fare attenzione?
L’ipotiroidismo subclinico o latente non provoca alcun sintomo, in quanto vengono ancora prodotti ormoni tiroidei sufficienti e solo il valore del TSH è elevato (intervallo di normalità attualmente valido: TSH <5 mU/l). I sintomi tipici dell’ipotiroidismo manifesto (TSH troppo alto, fT3 e fT4 troppo bassi) comprendono bradicardia, ipertensione, iporeflessia e ipotermia. Sono comuni anche i cambiamenti nella voce (profonda, rauca) e nella pelle (pallida e giallastra). È molto raro che si verifichi un coma da ipotiroidismo, dice il Prof. Lehmann. In termini di eziologia, la più comune è la tiroidite autoimmune (41% dei casi) [3], una malattia infiammatoria cronica della ghiandola tiroidea nota come sindrome di Hashimoto o tiroidite linfocitaria cronica. Nelle fasi iniziali di questa malattia, l’ipertiroidismo si verifica per un breve periodo di tempo (hashitossicosi), mentre l’ipotiroidismo si sviluppa nelle fasi successive. I marcatori diagnostici sono gli infiltrati linfocitari e la presenza di anticorpi contro un enzima tiroideo (TPO positivo nell’80-99%, TAK positivo nel 35-60%) [3], nonché un gozzo diffuso in presenza della forma ipertrofica della sindrome di Hashimotos (distinta dalla forma atrofica). La seconda causa più comune è quella idiopatica; in circa il 37% dei casi non è possibile individuare alcuna causa [3]. Il terzo più comune è l’ipotiroidismo post-terapeutico, ad esempio dopo le radiazioni o dopo la tiroidectomia totale/subtotale. Al giorno d’oggi, l’ipotiroidismo congenito (cretinismo) è solo raro (circa il 9% dei casi); in Svizzera, tutti i neonati vengono sottoposti a screening. L’ipotiroidismo indotto da farmaci è presente in circa il 2,5% dei casi [3]. I principi attivi e le classi di sostanze che possono portare all’ipotiroidismo sono i farmaci tireostatici (inibitori della iodazione), l’amiodarone (farmaco aritmico), il litio (psicofarmaco), l’interferone-α, l’interleuchina-2, gli inibitori della tirosin-chinasi (usati in chemioterapia; ad esempio sunitinib e sorafenib).
La terapia standard per l’ipotiroidismo è la sostituzione ormonale (tiroxina, fT4) secondo il seguente schema di dosaggio: iniziare con la dose di mantenimento prevista: 1,6 µg/kg di peso corporeo 30 minuti prima della colazione. Una riduzione della dose deve essere effettuata nei pazienti anziani (>60 anni) e nelle persone con malattia coronarica. Una volta raggiunti i valori target, la dose deve essere regolata anche nel corso del monitoraggio della terapia; valore target di fT4 dopo due settimane: 14-16 nmol/l; valore target di TSH nel corso a lungo termine (non prima di 6 settimane): 0,5-2 mU/l [3].
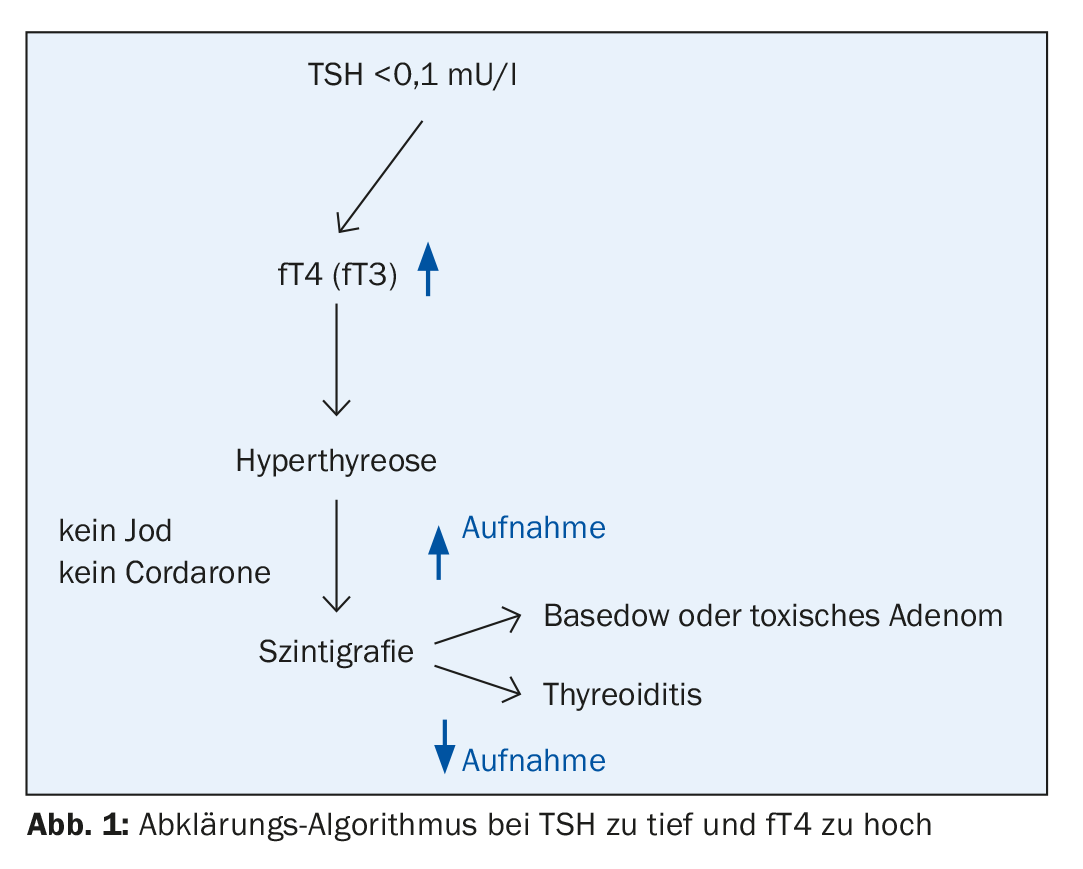
Valori di TSH soppressi: Cosa dovrebbe essere chiarito?
Anche una forma subclinica di ipertiroidismo è di solito un reperto incidentale. Secondo i dati di uno studio europeo, la frequenza varia tra lo 0,5% (nei bambini) e il 15% (nelle persone di età superiore ai 60 anni), e la diagnosi differenziale deve distinguere tra una disfunzione del circuito di controllo della tiroide stessa e cause non tiroidee [4]. La sostituzione di troppo o troppo poco ormone tiroideo come causa iatrogena è relativamente comune, dice il Prof. Lehmann. Il tasso di progressione dall’ipertiroidismo subclinico a quello manifesto varia a seconda della patogenesi ed è del 61% dopo due anni in presenza di un nodulo autonomo (adenoma tossico) [5]. Nelle linee guida, si raccomanda una scintigrafia per il TSH soppresso [6]. Questo metodo permette di differenziare in modo affidabile le varie cause di ipertiroidismo subclinico.
Se i livelli di TSH sono troppo bassi e gli ormoni tiroidei periferici sono elevati, si tratta di ipertiroidismo manifesto. Le caratteristiche cliniche includono tipicamente la perdita di peso, l’aumento della frequenza delle feci, l’intolleranza al calore e la sudorazione, oltre a diversi sintomi vegetativi (disturbi del sonno, irrequietezza interiore, nervosismo), oltre a prestazioni compromesse. In età avanzata, l’ipertiroidismo è spesso oligosintomatico, dice il Prof. Lehmann, e anche la mancanza di comprensione della malattia è comune. Solo molto raramente si sviluppa una crisi tireotossica (ipermetabolismo: febbre >40 gradi, debolezza muscolare; stimolazione simpatica: tachicardia, fibrillazione atriale, diarrea), continua il relatore. Dal punto di vista eziologico, circa il 70% dei casi è una tiroidite autoimmune (malattia di Graves), per la quale è caratteristica la triade di Merseburg (esoftalmo, gozzo, tachicardia) [3]. I risultati positivi nelle misurazioni degli anticorpi sono comuni (TRAK: 70-100%, TPO: 45-80%) e un’altra caratteristica clinica è il gozzo diffuso ed eventualmente un soffio di flusso [3]. In circa il 30% dei casi, l’eziologia non è autoimmunologica, il che si chiama autonomia funzionale. In circa il 2% dei casi, sono presenti altre cause di malattia (indotte da farmaci/contrastanti, ipertiroidismo di facciata, resistenza agli ormoni tiroidei ipofisari, tumori maligni della tiroide). Un reperto ecografico caratteristico nell’ipertiroidismo mostra un rigonfiamento diffuso con un modello ipoecogeno e lievi lobuli, nonché lobi tiroidei arrotondati (Fig. 1).
Le opzioni terapeutiche per l’ipertiroidismo di tipo Graves includono la tiroidectomia, la terapia con radioiodio o tireostatici (carbimazolo: Neomercazole®, propiltiouracile) e il trattamento sintomatico (β-bloccanti: propanololo o atenololo). Il trattamento con farmaci tireostatici è principalmente indicato; la terapia definitiva (radioiodio o chirurgia) è raccomandata in caso di resistenza alla terapia o di recidiva di ipertiroidismo [7]. Il carbimazolo tireostatico provoca una riduzione dei livelli di ormone tiroideo bloccando la perossidasi tiroidea responsabile della formazione di fT3 e fT4. Circa un terzo dei pazienti trattati con farmaci ha una remissione permanente, un terzo ha una ricaduta dopo poco tempo e un terzo ha una ricaduta dopo un intervallo di tempo più lungo.
Disfunzione tiroidea indotta da farmaci
L’amiodarone è un farmaco antiaritmico di classe III che ha una buona efficacia nei pazienti con aritmie cardiache, ma può causare disfunzioni tiroidee come effetto collaterale. Circa il 12% dei pazienti trattati con amiodarone (Cordarone®) sviluppa una disfunzione tiroidea come effetto collaterale, che può essere ipotiroidismo (10%) o ipertiroidismo (2%). La concentrazione di iodio dell’amiodorone è molto alta (30%), il che può portare ad un aumento di 200 volte dell’assorbimento di iodio nell’organismo. Il fabbisogno giornaliero di iodio raccomandato per gli adulti è di 150 µg; a causa dell’amiodarone (il 50% dello iodio contenuto viene assorbito), la dose giornaliera può arrivare a 30 mg di iodio. Poiché l’emivita è di 40-100 giorni a causa delle proprietà lipofile del principio attivo, lo iodio rimane nell’organismo per un tempo relativamente lungo. L’amiodarone influisce biochimicamente sui livelli di ormone tiroideo in più modi, bloccando la conversione fT4-fT3 e l’assorbimento di T4 da parte della cellula, nonché il legame intranucleare del recettore fT3.
Le seguenti forme di ipotiroidismo o ipertiroidismo possono verificarsi come effetto collaterale dell’assunzione di amiodorone (Cordarone®) [3]: Ipotiroidismo autoimmune (AIH), ipertiroidismo autoimmune di tipo 1 (AIT di tipo 1) e di tipo 2 (AIT di tipo 2). L’AIH è caratterizzata dalla presenza di molto iodio e da risultati positivi nelle misurazioni degli anticorpi tiroidei. L’AIT di tipo 1 è caratterizzata da un’eccessiva sintesi di T4, da una vascolarizzazione normale o aumentata, soprattutto nelle aree con carenza di iodio, e solitamente da una malattia tiroidea preesistente. La AIT di tipo 2 è infiammatoria-distruttiva, presenta una diminuzione della vascolarizzazione, di solito non c’è una malattia tiroidea preesistente e l’ipotiroidismo può svilupparsi successivamente.
A differenza dell’amiodorone (Cordarone®), il rischio di effetti collaterali legati alla tiroide del dronedarone (Multaq®), anch’esso un farmaco aritmico, non è problematico [3,8]. Per quanto riguarda le opzioni terapeutiche, la sostituzione dell’ormone tiroideo può essere intrapresa nell’AIH. Nell’AIT di tipo 1, è indicata la prescrizione di carbimazolo 40-60 mg al giorno o perclorato 1 g al giorno (50 gocce) per un periodo di 30-40 giorni. Nell’AIT di tipo 2, il prednisone deve essere prescritto a causa dei processi infiammatori-distruttivi, in una dose iniziale di 30-40 mg e una riduzione della dose entro tre mesi [3].
Incidentalomi tiroidei: per lo più benigni
La sensibilità degli esami radiologici di routine (ad esempio, l’ecografia) è molto più alta di quella delle palpitazioni. La percentuale di noduli tiroidei rilevati in una persona di 60 anni è del 50%, mentre con la palpitazione è solo del 5% circa [9]. Secondo la letteratura, la prevalenza degli incidentalomi tiroidei è fino al 60% [10]. La maggior parte degli incidentalomi tiroidei sono benigni (93,5-96%), mentre i tumori tiroidei maligni sono rari (4-6,5%) [3]. Gli esami FDG-PET hanno un’elevata specificità; un incidentaloma viene rilevato nel 2,3% dei casi, di cui il 47% sono tumori maligni [11].
Le seguenti caratteristiche sono tipiche degli incidentalomi maligni della tiroide [12]: ipoecogeno, microcalcificazioni, vascolarizzazione centrale, confine irregolare, alone incompleto, misto cistico-solido, ingrandimento documentato di un nodulo. Le seguenti caratteristiche sono indicative di incidentalomi tiroidei benigni: iperecogeni, calcificazioni grandi e grossolane (ad eccezione del carcinoma midollare della tiroide), vascolarizzazione periferica, ombreggiatura a coda di cometa. Dal momento che il 40% di tutte le persone di età superiore ai 50 anni si trova ad avere un incidentaloma tiroideo con un diametro di > 8 mm durante gli esami ecografici, ma la probabilità che si tratti di un tumore maligno è molto bassa (il tasso di mortalità dovuto al carcinoma tiroideo è di 5:1.000.000), la tiroidectomia come procedura standard è sproporzionata e non ha senso, spiega il Prof. Lehmann.
Fonte: Medicina interna FOMF, Aggiornamento, 4-8 dicembre 2018, Zurigo
Letteratura:
- Binz K, Beise U, Huber F: Linea guida mediX Malattie della tiroide. Ultimo aggiornamento 9/2017, www.medix.ch, ultimo accesso 05.12.2018.
- Dayan CM, Daniels GH: Tiroidite cronica autoimmune. N Engl J Med 1996; 335: 99-107.
- Ospedale universitario di Zurigo USZ. Clinica di Endocrinologia, Diabetologia e Nutrizione Clinica. Prof. Roger Lehmann, MD. Presentazione di diapositive alla FOMF Medicina Interna (dati clinici non pubblicati), 04.12.2018.
- Santos Palacios S, Pascual-Corrales E, Galofre JC: Gestione dell’ipertiroidismo subclinico. Int J Endocrinol Metab 2012; 10(2): 490-496.
- Schouten BJ, et al: Tireotossicosi subclinica in una popolazione ambulatoriale – predittori di esito. Endocrinologia clinica 2011; 74: 257-261.
- Surks MI, et al: Malattia tiroidea subclinica: revisione scientifica e linee guida per la diagnosi e la gestione. JAMA 2004; 291(2): 228-238.
- Krull I, Brändle M: Ipertiroidismo: diagnosi e terapia. Switzerland Med Forum 2013; 13(47): 954-960.
- Compendio svizzero dei farmaci: https://compendium.ch, ultimo accesso 05.12.2018.
- Mazzaferri EL: Gestione di un nodulo tiroideo solitario. N Engl J Med 1993; 328 (8): 553-559.
- Iyer NG, et al: Incidentalomi tiroidei: trattare o non trattare. Eur Arch Oto-Rhin-Laryngology 2010; 267: 1019-1026.
- Cohen MS, et al: Rischio di malignità negli incidentalomi tiroidei identificati dalla tomografia a emissione di fluorodesossiglucosio-positroni. Chirurgia 2001; 130(6): 941-946.
- American Thyroid Association: Linee guida per la gestione dei pazienti con noduli tiroidei e cancro differenziato della tiroide. Tiroide 2009; 19: 1167-1214.
PRATICA GP 2019; 14(1): 35-37