Sempre più pazienti esprimono di non volere alcuna misura terapeutica in caso di prevedibile incoscienza irreversibile o di danni cerebrali permanenti più gravi. Per tali decisioni, sono necessari parametri di prognosi validi, in cui deve essere presente la coincidenza di diversi indicatori di una prognosi sfavorevole.
Circa l’80% dei pazienti che raggiungono l’ospedale dopo la rianimazione cardiopolmonare rimangono inizialmente in coma. Questi pazienti hanno spesso una prognosi sfavorevole, cioè muoiono o sopravvivono con gravi danni cerebrali irreversibili [1,2]. Comprensibilmente, c’è un grande interesse nel valutare la prognosi nel modo più affidabile possibile, soprattutto perché sempre più pazienti esprimono nel testamento biologico o nei colloqui con i familiari di non volere alcuna misura terapeutica, ma solo palliativa, in caso di prevedibile incoscienza irreversibile o di gravi danni permanenti al cervello. Decisioni di tale importanza possono essere prese solo sulla base di parametri validi, per cui la massima certezza possibile della valutazione della prognosi dovrebbe basarsi sulla coincidenza di diversi indicatori di una prognosi sfavorevole (Tab. 1).
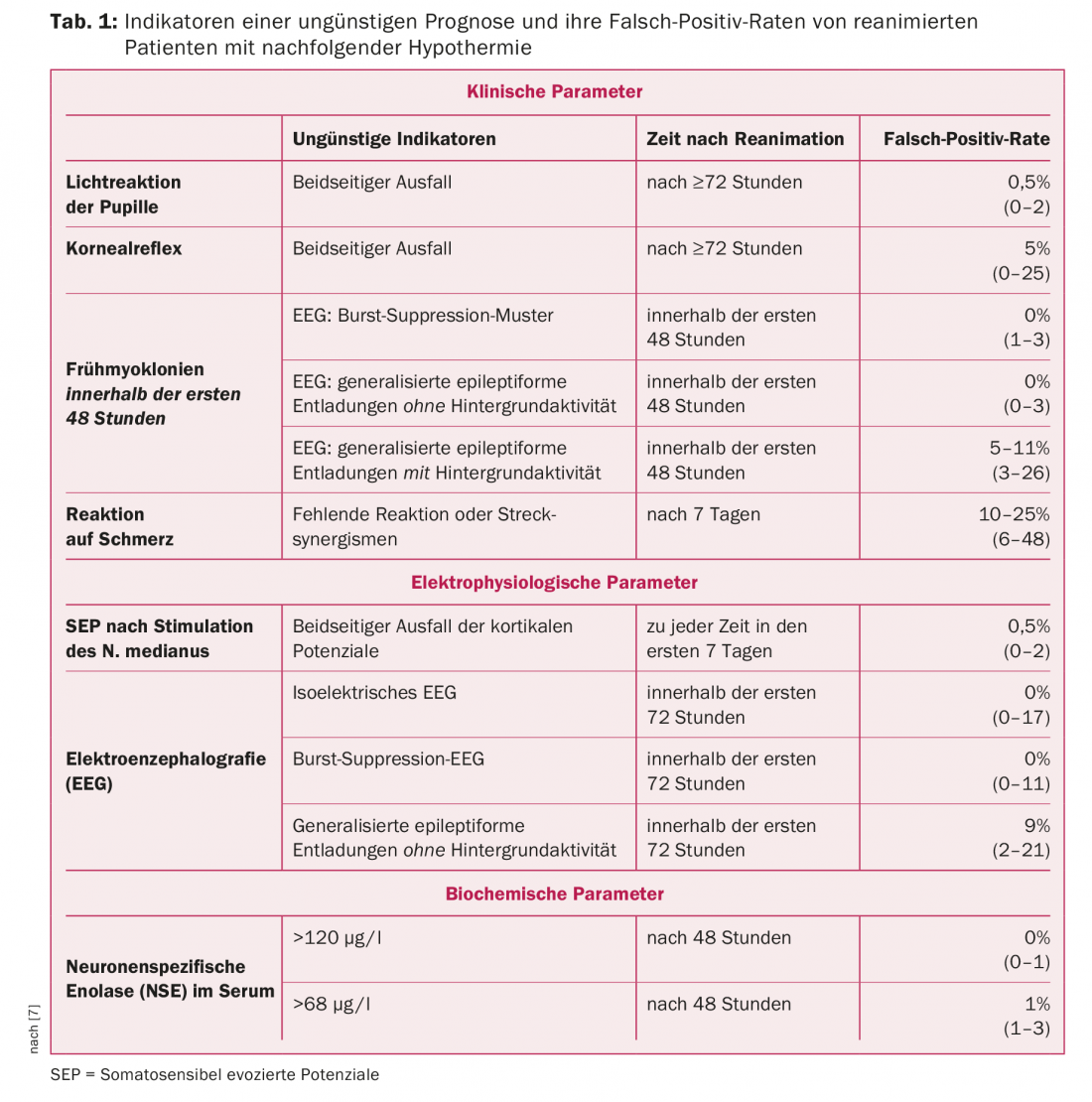
Dopo che 15 anni fa è stato dimostrato (in un gruppo molto selezionato di pazienti) che 24 ore di ipotermia (circa 33°C) dopo la rianimazione migliorano la prognosi [3], l’ipotermia terapeutica è stata rapidamente inserita nelle linee guida di trattamento corrispondenti. A seguito di ciò, è sorta la domanda sull’affidabilità dei parametri di previsione che finora sono stati considerati validi. Questo ha portato a tutta una serie di studi in cui sono stati esaminati molti più pazienti rispetto a quanto accadeva prima dell’introduzione dell’ipotermia terapeutica [recensioni 4-7]. Pertanto, gli indicatori di prognosi sfavorevole presentati di seguito possono essere considerati molto affidabili. Questi parametri hanno un’elevata specificità ma solo una sensibilità relativamente bassa, per cui in assenza di indicatori affidabili di una prognosi infausta, non si può ipotizzare con sicurezza una buona prognosi.
Valutazione della previsione
Il prerequisito fondamentale per una valutazione affidabile della prognosi è l’assenza di influenza dei farmaci sedativi negli esami clinici ed elettrofisiologici. Pertanto, è opportuno utilizzare solo sostanze con un’emivita breve (ad esempio, il propofol) per la sedazione nei primi giorni, che possono poi essere interrotte prima dell’esame. Bisogna considerare che le sostanze analgesiche e sedative vengono probabilmente degradate a un ritmo più lento durante l’ipotermia terapeutica. Tuttavia, mancano ancora studi sistematici su gruppi di pazienti più ampi.
Indicatori clinici di una prognosi infausta
I risultati clinici sono ancora il fattore principale nella valutazione della prognosi e continuano ad essere di grande importanza, nonostante il crescente uso di esami strumentali e biochimici. I seguenti indicatori clinici di una prognosi sfavorevole si basano sugli esami del maggior numero di pazienti in totale.
Riflessi del tronco encefalico: L’assenza della risposta pupillare alla luce e del riflesso corneale nel terzo giorno dopo la rianimazione (o almeno 24 ore dopo la sospensione dei farmaci analgesici e sedativi) sono indicatori validi di una prognosi sfavorevole quoad functionem, con la mancata risposta alla luce che è la più affidabile [4–7].
Mioclonia precoce: la mioclonia precoce post-anossica che si verifica nei primi due giorni dopo la rianimazione è un altro indicatore clinico di prognosi sfavorevole. Possono essere soppressi durante l’ipotermia dalla sedazione e/o dal rilassamento profondo e quindi diventare evidenti solo dopo il riscaldamento o la sospensione dei farmaci sedativi e/o rilassanti. Si tratta di brevi contrazioni spontanee e irregolari di singoli muscoli o gruppi muscolari, che in genere aumentano di gravità in presenza di stimoli esterni (toccare il paziente, aspirare, stimoli acustici) e talvolta solo in presenza di stimoli esterni. Questi interessano principalmente i muscoli del viso, della parte superiore delle braccia e delle spalle, nonché il diaframma, ma in linea di principio possono coinvolgere tutti i gruppi muscolari. I pazienti con mioclonia generalizzata hanno quasi invariabilmente una prognosi sfavorevole [4–7]. I pazienti con mioclonie focali hanno una prognosi molto migliore secondo i risultati recenti [8]. Questi ultimi non possono quindi essere considerati indicatori sicuri di una prognosi sfavorevole. In questo contesto, l’EEG può fornire ulteriori informazioni importanti, perché la prognosi è sfavorevole in caso di EEG a soppressione di burst o di scariche epilettiformi generalizzate senza attività di fondo conservata [9].
Risposta al dolore: la mancanza di risposta motoria al dolore o al sinergismo di stiramento non è un’indicazione valida di prognosi sfavorevole fino a sette giorni dopo la rianimazione. Ciò può essere dovuto al fatto che durante l’ipotermia terapeutica, i pazienti vengono trattati con sostanze analgesiche e sedative in dosi talvolta relativamente elevate, che vengono anche metabolizzate più lentamente in queste condizioni, per cui ci si aspetta un’attenuazione dei riflessi protettivi indotta dal farmaco più lunga.
Indicatori elettrofisiologici di una prognosi infausta
Non ci sono relazioni concentrazione-risposta confermate per le sostanze depressive a livello centrale, che possano portare a un’influenza dei parametri elettrofisiologici. Inoltre, i risultati ottenuti da pazienti sani dal punto di vista cerebrale non sono facilmente trasferibili ai pazienti con lesioni cerebrali ipossiche acute. Pertanto, per la massima certezza diagnostica possibile, solo i risultati dopo l’interruzione delle sostanze analgesiche e sedative devono essere valutati prognosticamente.
Potenziali evocati somatosensoriali (SEP): Il fallimento delle componenti corticali dopo la stimolazione del nervo mediano dopo la cessazione dell’ipotermia terapeutica indica in modo affidabile una prognosi inadeguata. Un buon risultato nella perdita bilaterale di componenti corticali è stato riportato solo molto occasionalmente [4–7].
Elettroencefalogramma (EEG): una mancata attività elettrica propria del cervello (EEG isoelettrico), un EEG a soppressione di burst (nella definizione comune delle società professionali o dei libri di testo standard), così come scariche epilettiformi generalizzate continue (come “spikes” o “onde acute”) senza attività di fondo e mancanza di reattività agli stimoli esterni sono indicatori affidabili di una prognosi sfavorevole quoad functionem [4–7].
Parametri biochimici di una prognosi infausta
Enolasi neurone-specifica (NSE) nel siero: le soglie superiori per una prognosi inadeguata riportate da diversi gruppi di ricerca variano, come accadeva anche prima dell’introduzione dell’ipotermia terapeutica. In questi studi, non è sempre possibile essere sicuri che altre cause di un NSE elevato siano state escluse in modo affidabile, poiché il decadimento degli eritrociti durante le procedure extracorporee o le trasfusioni di eritrociti o le malattie tumorali possono portare a un NSE elevato. Dopo 48 ore, un NSE superiore a 120 µg/l può essere considerato un valido indicatore di prognosi infausta [4–7]. Altri marcatori biochimici, come la proteina S-100, che possono anche essere altamente sensibili, sono stati studiati in un numero molto inferiore di pazienti e quindi non hanno una certezza prognostica così elevata come l’NSE.
Tecniche di imaging
I risultati precedenti indicano che alcuni reperti della TAC e della risonanza magnetica possono indicare una prognosi sfavorevole [6,7]. Tuttavia, in questo caso non è stato esaminato un numero di pazienti pari a quello dei parametri sopra citati, per cui questi parametri non devono essere considerati affidabili. Inoltre, questi esami non sono possibili ovunque. In particolare, la risonanza magnetica che è superiore alla TAC nel rilevare le lesioni strutturali e la possibilità di eseguire la risonanza magnetica in pazienti intubati e ventilati non sono disponibili ovunque.
Conseguenze per la pratica
Una prognosi infausta prevedibile, cioè la morte del paziente, un coma permanente o una sindrome di veglia non responsiva (“coma da svegli”, “sindrome apallica”, “stato vegetativo persistente”), così come una sindrome da grave difetto neurologico con necessità permanente di cura e assistenza, sono di notevole conseguenza. In questi casi, il tipo e l’entità dell’ulteriore terapia intensiva devono essere riconsiderati e discussi con i familiari e l’équipe del reparto di terapia intensiva. In particolare, se è nota la volontà del paziente, che avrebbe desiderato solo un trattamento palliativo in caso di prognosi sfavorevole prevedibile, questa deve essere rispettata e la terapia limitata di conseguenza. In questo caso, la somministrazione di morfine e benzodiazepine è giustificata e accolta con favore anche dai familiari, per escludere in modo sicuro la possibilità che la persona colpita soffra, anche se la percezione cosciente del dolore non è possibile con il danno cerebrale massiccio esistente. Decisioni di tale portata non possono essere prese sulla base di un singolo risultato. Solo nel caso della coesistenza contemporanea di (a) almeno un segno clinico sfavorevole; e b) un parametro elettrofisiologico impreciso o un NSE significativamente aumentato, preferibilmente entrambi, si può ipotizzare in modo affidabile una prognosi imprecisa.
Messaggi da portare a casa
- Esistono diversi indicatori clinici, strumentali e biochimici validi di una prognosi inadeguata.
- In assenza di indicatori validi di una prognosi imprecisa, non si può ipotizzare con sicurezza una prognosi buona.
- Il prerequisito fondamentale per una valutazione affidabile della prognosi è l’assenza di influenza dei farmaci sedativi negli esami clinici ed elettrofisiologici.
- Solo nel caso della coesistenza contemporanea di (a) almeno un segno clinico sfavorevole; e b) un parametro elettrofisiologico impreciso o un’enolasi neurone-specifica (NSE) significativamente elevata, preferibilmente entrambi, si può ipotizzare in modo affidabile una prognosi imprecisa.
Letteratura:
- Peberda MA, et al: Rianimazione cardiopolmonare degli adulti in ospedale: un rapporto di 14.720 arresti cardiaci dal Registro nazionale della rianimazione cardiopolmonare. Rianimazione 2003; 58: 297-308.
- Madl C, Holzer M: Funzione cerebrale dopo la rianimazione da arresto cardiaco. Curr Opin Crit Care 2004; 10: 213-217.
- Il Gruppo di studio sull’ipotermia dopo l’arresto cardiaco: Ipotermia terapeutica lieve per migliorare l’esito neurologico dopo l’arresto cardiaco. N Engl J Med 2002; 346: 549-556.
- Thömke F: Valutazione della prognosi dopo la rianimazione cardiopolmonare e l’ipotermia terapeutica. Dtsch Arztebl Int 2013; 110: 137-143.
- Cahill EA, et al: Un aggiornamento nella gestione dell’arresto cardiaco e nella prognosi nell’era dell’ipotermia terapeutica. Neurohospitalist 2014; 4: 144-152.
- Sandronia C, et al: Prognosi nei sopravvissuti in coma all’arresto cardiaco: una dichiarazione consultiva dell’European Resuscitation Council e della Società Europea di Medicina Intensiva. Rianimazione 2014; 85: 1779-1789.
- Rossetti AO, et al: prognosi neurologica dell’esito nei pazienti in coma dopo un arresto cardiaco. Lancet Neurol 2016; 15: 597-609.
- Bouwes A, et al: Mioclono acuto post-ipossico dopo la rianimazione cardiopolmonare. BMC Neurology 2012, 12: 63.
- Elmer J, et al: Fenotipi elettroencefalografici clinicamente distinti di mioclono precoce dopo un arresto cardiaco. Ann Neurol 2016; 80: 175-184.
CARDIOVASC 2018; 17(3): 25-28











