Un uso parsimonioso e mirato degli antibiotici aiuta a minimizzare il rischio di resistenza agli antibiotici. Ogni somministrazione di antibiotici lascia anche dei danni collaterali nel nostro microbioma. In generale, la terapia deve essere breve quanto necessario e il più possibile ad alto dosaggio.
Gli antibiotici hanno contribuito a rendere curabili malattie infettive che in passato erano gravi e spesso mortali, perdendo così l’orrore di un tempo. Per esempio, rispetto all’era pre-antibiotica, la mortalità della polmonite è stata ridotta da circa il 23% a circa il 7%, quella dell’endocardite dal 100% al 25% e quella della meningite batterica da >80% a <20% [1]. L’introduzione degli antibiotici ha portato un impulso allo sviluppo della moderna medicina ad alte prestazioni. Senza antibiotici efficaci, la medicina intensiva, la chirurgia, in particolare le endoprotesi e i trapianti, nonché le chemioterapie sono impensabili [2].
Resistenza agli antibiotici
Dopo l’introduzione di un nuovo antibiotico, di solito bastano pochi anni perché i batteri diventino resistenti. Gli antibiotici esercitano una pressione di selezione sulle varianti batteriche resistenti preesistenti, che quindi hanno un vantaggio di sopravvivenza rispetto ai batteri sensibili e si arricchiscono.
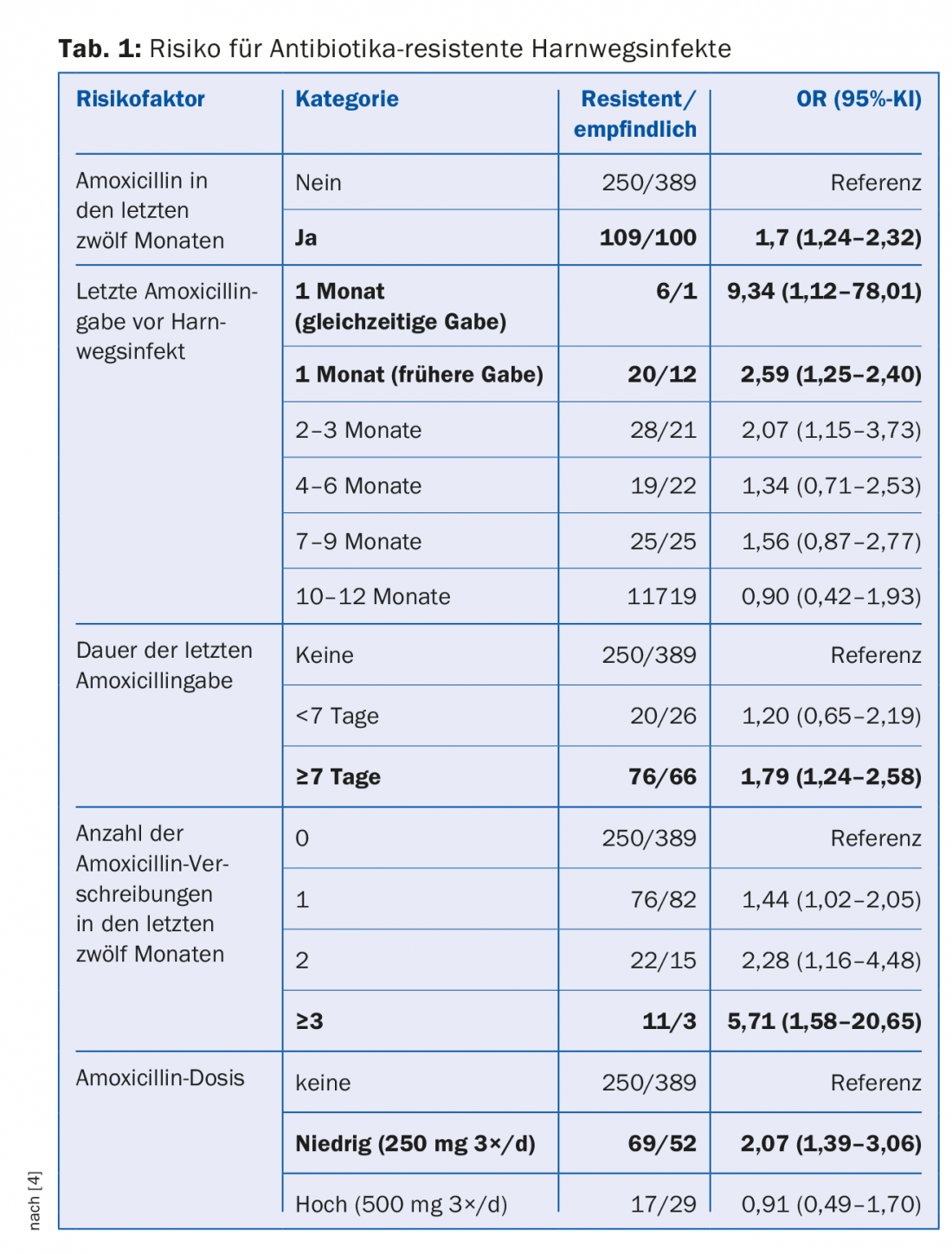
La resistenza agli antibiotici è presente in natura da milioni di anni, ma è chiaramente l’uso degli antibiotici in agricoltura e in medicina, e in ultima analisi nell’uomo, a costituire la forza trainante. Più antibiotici vengono prescritti in una popolazione, più alto è il rischio di batteri resistenti agli antibiotici [3]. In uno studio caso-controllo di pazienti con infezioni del tratto urinario, sono stati riscontrati diversi fattori di rischio: somministrazione frequente di antibiotici, lunga durata della terapia, basso dosaggio (Tab. 1) [4]. Il rischio di colonizzazione con pneumococchi resistenti alla penicillina aumenta del 4% nei bambini australiani per ogni giorno in cui hanno ricevuto antibiotici β-lattamici nei sei mesi precedenti [5]. Circa il 60-90% degli antibiotici per uso umano sono prescritti nel settore ambulatoriale e di questi, circa il 75-85% sono prescritti per infezioni respiratorie comunemente virali. Tuttavia, a livello globale, circa l’80% di tutti gli antibiotici viene utilizzato negli allevamenti, soprattutto come “promotori della crescita” per l’ingrasso del bestiame.
La resistenza agli antibiotici può insorgere e diffondersi in modi diversi. Possono essere intrinseche (cioè un batterio è sempre resistente a questo antibiotico), nascere de novo attraverso una mutazione spontanea e diventare selezionate a causa della pressione di selezione esercitata dall’antibiotico, essere trasferite da un batterio all’altro attraverso il trasferimento genico orizzontale (ad esempio per mezzo di plasmidi, che spesso contengono diversi geni di resistenza allo stesso tempo) e anche essere trasmesse tra pazienti attraverso una scarsa igiene (delle mani).
La resistenza agli antibiotici ha conseguenze rilevanti, come l’aumento della mortalità, l’allungamento delle degenze ospedaliere e l’aumento dei costi (panoramica 1) . Le previsioni più fosche prevedono un aumento da circa 25.000 morti nell’UE e circa 700.000 nel mondo a causa di infezioni da agenti patogeni resistenti agli antibiotici nel 2014, fino a 390.000 e 10 milioni rispettivamente nel 2050. Si teme che questo sia un passo indietro verso un’era pre-antibiotica con infezioni non curabili – già una realtà in molti Paesi – e costi indiretti di un’inimmaginabile cifra di 100.000 miliardi di dollari USA (amr-review.org).

In Svizzera, i dati sulla resistenza agli antibiotici sono raccolti con la sorveglianza nazionale e sono accessibili su www.anresis.ch in un database interattivo. Qui si possono osservare notevoli successi nel contenimento dello Staphylococcus aureus resistente alla meticillina (MRSA). Meno del 3% degli pneumococchi sono resistenti alla penicillina, in parte grazie alla vaccinazione pneumococcica nei bambini. Purtroppo, la resistenza agli antibiotici si sta diffondendo costantemente tra i patogeni Gram-negativi, soprattutto attraverso le beta-lattamasi a spettro esteso (ESBL), che sono sempre più responsabili di infezioni addominali e del tratto urinario. Ad esempio, circa il 10% di tutti gli Escherichia coli in Svizzera sono ESBL-former e circa il 20% sono resistenti alla ciprofloxacina.
Effetti degli antibiotici sul microbioma
Oltre alla selezione della resistenza, agli effetti collaterali indesiderati, alle reazioni allergiche e ai costi dei farmaci, ogni uso di antibiotici ha un impatto rilevante sul nostro microbiota (l’insieme di tutti gli organismi presenti nel nostro corpo) e sul nostro microbioma (microbiota e genoma) che dura fino a diversi anni [6]. La più nota è la predisposizione, dopo gli antibiotici , alladiarrea associata al Clostridium difficile, ma gli antibiotici aumentano anche il rischio, tra l’altro, di sepsi in corso, lo sviluppo di obesità, diabete mellito, asma e allergie [7]. L’influenza maggiore è sul microbiota in via di sviluppo del bambino, motivo per cui occorre prestare attenzione all’uso più restrittivo possibile degli antibiotici, in particolare nelle donne in gravidanza e nei bambini (soprattutto nei primi due anni di vita) [8].
Soprattutto, i batteri anaerobi della flora del sito del colon contribuiscono alla resistenza alla colonizzazione da parte di agenti patogeni, motivo per cui la terapia antibiotica diretta contro gli anaerobi predispone ad altre infezioni. È interessante notare che dopo un viaggio in un’area endemica, il rischio di una nuova colonizzazione con Enterobacteriaceae multiresistenti rispetto ai viaggiatori sani era due volte più alto nelle persone che avevano avuto la diarrea durante il viaggio e più di quattro volte più alto nelle persone che avevano assunto un antibiotico β-lattamico durante il viaggio (disbiosi della flora intestinale) [9]. Questo è un argomento importante contro una profilassi antibiotica troppo generosa contro la diarrea dei viaggiatori.
Regole di base per l’uso degli antibiotici
I seguenti aspetti devono essere presi in considerazione con qualsiasi terapia antibiotica:
Indicazione: qualsiasi somministrazione di antibiotici deve essere effettuata solo in base a un’indicazione rigorosa. L’uso di biomarcatori può essere utile a questo scopo. Poiché il rischio di infezione batterica è correlato al livello di procalcitonina (PCT), senza un aumento del rischio di complicazioni, l’uso di algoritmi PCT può ridurre il consumo di antibiotici del 35-45% nei pazienti con esacerbazione della broncopneumopatia cronica ostruttiva (BPCO) e di circa il 65% in quelli con infezioni del tratto respiratorio superiore [10]. Nei pazienti con sintomi virali tipici delle infezioni del tratto respiratorio superiore o della bronchite acuta (congiuntivite, rinite, artralgia, esantema), gli antibiotici devono essere evitati. Uno studio britannico ha dimostrato che un uso restrittivo degli antibiotici per le infezioni del tratto respiratorio superiore potrebbe far risparmiare più di 2000 prescrizioni di antibiotici in dieci anni in uno studio con 7000 pazienti all’anno [11]. Le complicanze temibili si verificano molto raramente (circa dieci episodi di polmonite e meno di un ascesso peritonsillare in dieci anni). Va notato che le vie respiratorie superiori e inferiori non sono sterili e quindi il rilevamento di batteri non indica automaticamente una terapia antibiotica.
La batteriuria asintomatica deve essere ricercata solo in gravidanza e prima di procedure urologiche che comportano lesioni della mucosa, e solo allora deve essere trattata con antibiotici. Altrimenti, la terapia antibiotica nella batteriuria asintomatica è associata a un aumento del rischio di sviluppare pielonefrite (presumibilmente ancora una volta attraverso la disbiosi del microbiota) e a un maggiore sviluppo di resistenza [12,13]. Lo stesso vale per gli utenti asintomatici di cateteri permanenti, che hanno un tasso di colonizzazione di circa l’8%/d, che non dovrebbe portare alla terapia antibiotica in assenza di sintomi evidenti.
La sinusite acuta di solito ha un’eziologia virale. Solo lo 0,5-2% degli adulti e fino al 5% dei bambini sviluppa una superinfezione batterica. Gli antibiotici sono raccomandati solo in caso di sintomi persistenti o assenza di miglioramento dopo almeno dieci giorni, sintomi gravi (febbre ≥39°C o espettorato purulento) per almeno tre o quattro giorni o peggioramento o decorso bifasico dopo almeno tre o quattro giorni. Il trattamento di scelta è l’amoxicillina 1 g ogni otto ore per cinque-sette giorni; nei casi gravi o con fattori di rischio, amoxicillina/acido clavulanico 1 g ogni dodici ore per cinque-sette giorni.
La terapia antibiotica immediata è indicata solo per l’otite media acuta (AOM) bilaterale nei bambini di età inferiore ai due anni o per l’AOM perforata. Altrimenti, la “vigile attesa” è raccomandata per 24-48 ore nei bambini di età inferiore ai due anni o per 48-72 ore nelle persone di età superiore ai due anni, in quanto la terapia antibiotica ha scarso effetto sulla durata dei sintomi o sul tasso di complicanze nell’AOM inizialmente prevalentemente virale. La terapia di scelta è l’amoxicillina, in caso di recidiva o di mancata risposta dopo 72 ore l’amoxicillina/acido clavulanico.
Nei pazienti di età superiore ai tre anni, il punteggio Centor (un punto ciascuno per essudato sulle tonsille; febbre >38°C; linfonodi cervicali anteriori dolenti e gonfi; assenza di tosse) deve essere calcolato se si sospetta una faringite non virale. Solo se il risultato è ≥3 punti, deve essere eseguito un test rapido per lo Streptococcus pyogenes. E solo se questo è positivo, la terapia antibiotica deve essere iniziata entro nove giorni per ridurre al minimo il rischio di febbre reumatica acuta. La terapia di scelta è l’amoxicillina 1 g ogni dodici ore per sei giorni (finora, la S. pyogenes è sempre sensibile alla penicillina, ma l’amoxicillina ha una biodisponibilità maggiore rispetto alla penicillina).
Diversi studi recenti hanno dimostrato che nella diverticolite acuta non complicata, la terapia antibiotica non è migliore del placebo in termini di sollievo dai sintomi, tasso di complicanze, necessità di intervento chirurgico e tasso di recidiva [14].
Nella gastroenterite acuta (diarrea con vomito/diarrea acquosa) senza febbre con/senza storia di viaggio, la terapia sintomatica è solitamente sufficiente. Gli antibiotici devono essere utilizzati solo in caso di diarrea sanguinolenta o febbrile o di tossicità sistemica.
Spettro patogeno: qualsiasi terapia antibiotica empirica deve tenere conto dello spettro patogeno previsto. Devono essere trattati sia i patogeni più comuni che alcuni patogeni rari associati a un decorso particolarmente grave. A seconda dell’infezione, è indicata una diagnosi microbiologica del patogeno. Se viene rilevato un agente patogeno, la terapia deve essere ridotta (de-escalation). Questo viene fatto in particolare per ridurre al minimo i possibili danni collaterali al microbioma e la selezione della resistenza agli antibiotici. Per esempio, è stato dimostrato che i pazienti con polmonite batteriemica da pneumococco avevano una mortalità inferiore quando venivano de-escalati alla monoterapia con penicillina o amoxicillina durante il decorso [15].
Modo di somministrazione: gli antibiotici con elevata biodisponibilità orale devono essere somministrati principalmente per via orale, ad esempio trimetoprim-sulfametossazolo, metronidazolo, clindamicina, chinoloni. Fanno eccezione i pazienti in cui l’assorbimento enterale è compromesso o le infezioni che richiedono livelli molto elevati nel sito di azione (ad esempio, infezioni molto gravi, infezioni endovascolari, infezioni ossee iniziali, infezioni del SNC).
Dosaggio: la dose dipende dalla concentrazione minima inibitoria (MIC) del patogeno, dalla carica germinale, dalla gravità dell’infezione, dai livelli tissutali attesi (per lo più bassi nella prostata, nel SNC) e dall’intervallo terapeutico dell’antibiotico (alto per gli antibiotici β-lattamici, basso per gli aminoglicosidi). La dose iniziale deve essere scelta il più alta possibile, poiché qui è presente il carico germinale più elevato e spesso è necessaria anche una dose di carico per raggiungere livelli attivi sufficienti il più rapidamente possibile. I dosaggi ottimali sono spesso superiori a quelli raccomandati nel compendio (vedere ad esempio www.guidelines.ch). In caso di insufficienza epatica o renale, può essere necessario prolungare l’intervallo, ma la dose di carico rimane la stessa. Gli antibiotici β-lattamici (penicilline, cefalosporine) hanno un effetto dipendente dal tempo, in cui il livello attivo deve rimanere al di sopra della MIC dell’agente patogeno il più a lungo possibile, dosando il più frequentemente possibile (brevi intervalli). Al contrario, i macrolidi, gli aminoglicosidi o i chinoloni hanno un effetto dipendente dalla concentrazione e raggiungono un effetto ottimale a concentrazioni di picco elevate. Per questi antibiotici, la dose deve essere la più alta possibile con un lungo intervallo di dosaggio.
Durata: la durata della terapia deve essere la più lunga possibile e la più breve possibile. L’idea di fondo è che si debba esercitare la minor pressione di selezione possibile per l’emergere e la diffusione della resistenza agli antibiotici. Questo concetto sta guadagnando sempre più attenzione anche a livello internazionale e nella maggior parte delle infezioni rilevanti per la medicina generale, la durata della terapia breve è ormai consolidata. A questo proposito, è opportuno fare riferimento a due ottimi articoli di sintesi [16,17]. Panoramica 2 offre una panoramica.

Anamnesi allergica: tra tutte le allergie agli antibiotici, l’allergia alla penicillina è quella più comunemente riportata dai pazienti. Tuttavia, probabilmente meno del 10% di questi pazienti ha una vera allergia alla penicillina e meno del 2% dei pazienti veramente allergici alla penicillina ha un’allergia incrociata alle cefalosporine di terza generazione [18]. Va notato che le penicilline e gli altri antibiotici β-lattamici sono di solito la classe di sostanze più efficace e la loro sospensione a causa di una presunta allergia comporta un aumento della morbilità e della mortalità nei pazienti “etichettati” in questo modo. Pertanto, le allergie devono sempre essere differenziate dalle reazioni avverse e il sospetto di un’allergia agli antibiotici deve essere chiarito allergologicamente.
Riparazione del microbiota danneggiato: proprio come un chirurgo è responsabile della sua ferita, anche le conseguenze (in particolare la selezione della resistenza e i danni collaterali per quanto riguarda il microbioma) devono essere considerate con ogni prescrizione di antibiotici. L’obiettivo dovrebbe essere quello di minimizzarli o di “compensarli”. Tuttavia, gli studi futuri devono prima fornire le prove su quale probiotico sia migliore in quale situazione. Diverse specie di Lactobacillus e Bifidobacillus, contenute in vari yogurt da bere o integratori alimentari disponibili in commercio, sono raccomandate per ripristinare il microbiota danneggiato dagli antibiotici [6].
Messaggi da portare a casa
- Il 60-90% degli antibiotici viene prescritto in ambulatorio e di questi, circa il 75-85% sono per infezioni respiratorie prevalentemente virali.
- Per ogni terapia antibiotica, si devono considerare i seguenti aspetti: Indicazione, spettro patogeno previsto, modalità di applicazione, dosaggio, durata.
- Utilizzare gli antibiotici con la massima parsimonia e selettività possibile aiuta a minimizzare il rischio di sviluppare resistenza agli antibiotici, effetti collaterali, allergie e costi.
- Ogni somministrazione di antibiotici lascia danni collaterali nel nostro microbioma, con effetti multipli e ancora incompletamente conosciuti sul rischio di varie malattie (diarrea associata al Clostridium difficile, sepsi, obesità e sindrome metabolica, allergie, ecc.)
- Regola empirica per la terapia antibiotica: la durata più breve possibile e la dose più alta possibile.
Letteratura:
- Spellberg B, et al: Combattere la resistenza antimicrobica: raccomandazioni politiche per salvare vite umane. Clin Infect Dis 2011; 52(Suppl 5): S397-428.
- Marston HD, et al: Resistenza antimicrobica. JAMA 2016; 316(11): 1193-1204.
- Albrich WC, Monnet DL, Harbarth S: Pressione di selezione antibiotica e resistenza nello Streptococcus pneumoniae e nello Streptococcus pyogenes. Emerg Infect Dis 2004; 10(3): 514-517.
- Hillier S, et al: Precedenti antibiotici e rischio di infezione del tratto urinario acquisita in comunità resistente agli antibiotici: uno studio caso-controllo. J Antimicrob Chemother 2007; 60(1): 92-99.
- Nasrin D, et al: Effetto dell’uso di antibiotici beta-lattamici nei bambini sulla resistenza dello pneumococco alla penicillina: studio prospettico di coorte. BMJ 2002; 324(7328): 28-30.
- Kahlert C, Müller P: Microbioma – la scoperta di un organo. Swiss Med Forum 2014; 14(16-17): 342-344.
- Willing BP, Russell SL, Finlay BB: Spostare l’equilibrio: effetti degli antibiotici sul mutualismo ospite-microbiota. Nat Rev Microbiol 2011; 9(4): 233-243.
- Blaser MJ: La teoria della scomparsa del microbiota e le epidemie di malattie croniche. Nature reviews Immunology 2017; 17(8): 461-463.
- Ruppe E, et al: Alto tasso di acquisizione ma breve durata del trasporto di Enterobacteriaceae multiresistenti dopo un viaggio ai Tropici. Clin Infect Dis 2015; 61(4): 593-600.
- Schuetz P, et al.: Meno è meglio: terapia antibiotica individualizzata attraverso la misurazione della procalcitonina. Swiss Med Forum 2012; 12(46): 887-892.
- Gulliford MC, et al: Sicurezza della riduzione della prescrizione di antibiotici per le infezioni autolimitanti del tratto respiratorio nell’assistenza primaria: studio di coorte con l’utilizzo di cartelle cliniche elettroniche. BMJ 2016; 354: i3410.
- Cai T, et al: Il ruolo della batteriuria asintomatica nelle giovani donne con infezioni ricorrenti del tratto urinario: trattare o non trattare? Clin Infect Dis 2012; 55(6): 771-777.
- Cai T, et al: Il trattamento della batteriuria asintomatica è associato a una maggiore prevalenza di ceppi resistenti agli antibiotici nelle donne con infezioni del tratto urinario. Clin Infect Dis 2015; 61(11): 1655-1661.
- Chabok A, et al: Studio clinico randomizzato sugli antibiotici nella diverticolite acuta non complicata. The British journal of surgery 2012; 99(4): 532-539.
- Cremers AJ, et al: Effetto della razionalizzazione degli antibiotici sull’esito del paziente nella batteriemia pneumococcica. J Antimicrob Chemother 2014; 69(8): 2258-2264.
- Llewelyn MJ, et al: Il corso di antibiotici ha fatto il suo tempo. BMJ 2017; 358: j3418.
- Dawson-Hahn EE, et al: Trattamento antibiotico orale di breve durata rispetto a quello di lunga durata per le infezioni trattate in ambito ambulatoriale: una revisione delle revisioni sistematiche. Medicina di famiglia 2017; 34(5): 511-519.
- Trubiano JA, Adkinson NF, Phillips EJ: L’allergia alla penicillina non è necessariamente per sempre. JAMA 2017; 318(1): 82-83.
PRATICA GP 2018; 13(4): 11-14