I nuovi farmaci per l’epatite C cronica sono ora disponibili per tutti i pazienti infetti, indipendentemente dallo stadio di fibrosi. Le combinazioni di DAA rendono la malattia curabile in oltre il 95% dei casi.
Secondo le stime dell’OMS, circa 71 milioni di persone in tutto il mondo sono infettate dal virus dell’epatite C (HCV) e circa 400.000 persone muoiono ogni anno a causa dell’infezione da virus dell’epatite C. Pertanto, l’eliminazione delle infezioni da virus dell’epatite B e C come condizioni pericolose per la vita entro il 2030 (riducendo il tasso di nuove infezioni del 90% e la mortalità del 65%) è stata formulata come uno dei principali obiettivi medici per i prossimi anni [1,2].
Secondo le stime, circa 40.000 persone in Svizzera sono affette dal virus dell’epatite C, il che corrisponde a circa lo 0,5% della popolazione, per cui bisogna ancora considerare un numero considerevole di casi non dichiarati (persone infette non diagnosticate) [3].
Trasmissione e accumulo di virus
Il virus si trasmette per via parenterale, oggi soprattutto attraverso la condivisione di aghi durante l’uso di droghe per via endovenosa e a causa degli scarsi standard igienici nelle attività mediche. In passato, molte trasmissioni si sono verificate attraverso prodotti ematici infetti prima del 1990, oltre alla mancanza di standard igienici, ad esempio quando si fanno i tatuaggi. L’infezione è possibile anche attraverso il sesso anale e per via verticale da madre a figlio (circa il 5% di rischio di trasmissione) [4].
Il virus dell’epatite C è un virus RNA a singolo filamento e possiede tre proteine strutturali (core, E1, E2) e sette proteine non strutturali (p7, NS2, NS3, NS4A, NS4B, NS5A e NS5B) [5]. Mostra una grande variabilità genetica, che si manifesta in sei diversi genotipi con ulteriori sottotipi. In tutto il mondo, l’infezione da genotipo 1 è la più comune (circa il 46%); il genotipo 1 è anche responsabile di poco meno della metà delle infezioni in Svizzera [6,7].
Decorso della malattia, diagnosi, terapia
Nell’infezione da HCV, si distingue una forma acuta da una forma cronica. L’epatite C acuta è spesso asintomatica con sintomi aspecifici come affaticamento, dolore addominale, mialgia e raramente ittero. Ha un decorso cronico in circa il 50-80% dei casi.
In un piccolo studio multicentrico tedesco, è stato dimostrato che sei settimane di terapia antivirale con sofosbuvir/ledipasvir in un totale di 20 pazienti con infezione acuta da virus dell’epatite C di genotipo 1 hanno portato a una risposta virologica sostenuta in tutti i casi, evitando così la cronicizzazione dell’infezione virale [8]. Tuttavia, poiché l’infezione acuta da virus dell’epatite C è raramente riconosciuta a causa dei sintomi aspecifici e spesso può anche essere asintomatica, la terapia dell’epatite C acuta svolge solo un ruolo subordinato rispetto alla terapia dell’epatite C cronica.
Un’infezione cronica da HCV può essere asintomatica per molto tempo e causare sintomi aspecifici come affaticamento, perdita di rendimento, disturbi addominali superiori, prurito o disturbi articolari solo in una fase avanzata. Possono verificarsi anche manifestazioni extraepatiche come la crioglobulinemia, la nefropatia mediata da immunocomplessi dell’HCV o il linfoma non Hodgkin a cellule B. Circa il 20-30% dei pazienti con HCV cronico sviluppa una cirrosi entro i 30 anni successivi. I fattori di rischio per la progressione della fibrosi del tessuto epatico sono principalmente l’età >40 anni al momento dell’infezione, il consumo di alcol superiore a 50 g al giorno e il sesso maschile [9].
L’incidenza del carcinoma epatocellulare nella cirrosi associata all’epatite C è di circa il 3-6% [10].
Lo Studio svizzero sulla coorte dell’epatite C ha rilevato che circa il 61% dei pazienti con HCV cronica sono nati tra il 1955 e il 1974 [11]. Soprattutto nei pazienti nati in questi anni con un’anamnesi di rischio corrispondente (abuso di droghe per via i.v., trasfusioni di sangue prima del 1990, tatuaggi), uno screening anti-HCV (Fig. 1) dovrebbe essere preso in considerazione in caso di affaticamento persistente o altri disturbi aspecifici e si dovrebbe cercare un trattamento in caso di risultato positivo. Altrimenti, devono essere testati i gruppi a rischio abituali, come le persone con transaminasi elevate, con infezione da HIV o HBV, con uso di droghe per via endovenosa/intranasale o con piercing/tatuaggi, i pazienti in dialisi e i figli di madri infette da HCV.
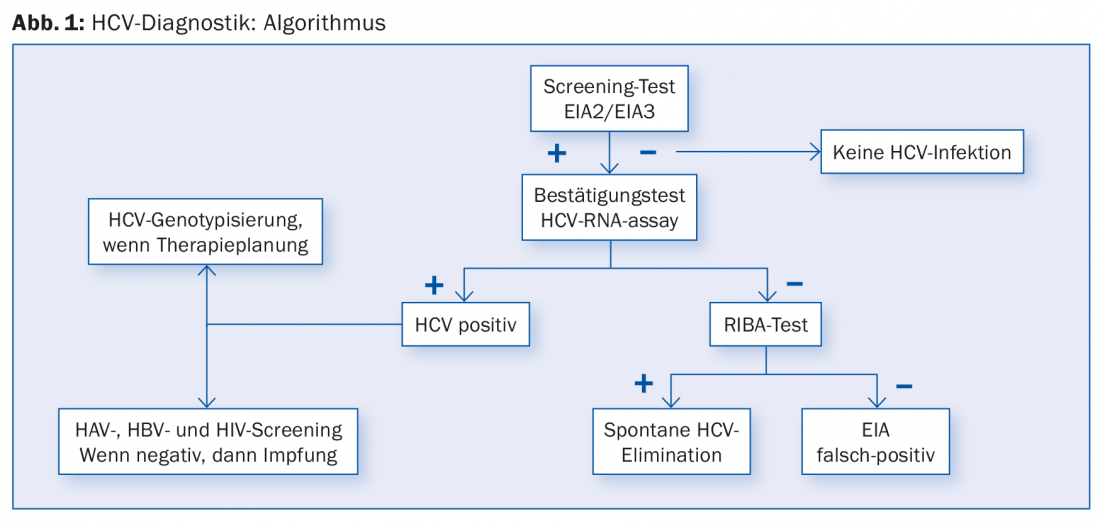
Tuttavia, un test di screening anti-HCV può essere falso positivo in alcuni casi (Fig. 1). Pertanto, in caso di test di screening positivo, si dovrebbe sempre effettuare una PCR dell’HCV RNA. Se la PCR HCV è negativa, è perché il paziente è già stato infettato dall’HCV o perché il test di screening è falso positivo. In questo caso, è utile un altro immunodosaggio, il cosiddetto RIBA (“recombinant immunoblot assay”). Questo test di conferma è più accurato del test di screening anti-HCV. Se il test RIBA è positivo, il paziente ha contratto l’epatite C. Se il risultato è negativo e contemporaneamente la PCR HCV è negativa, si può chiaramente ipotizzare un test di screening anti-HCV falso-positivo; non sono più necessari ulteriori esami.
Per molto tempo, la terapia per l’epatite C consisteva in una combinazione di interferone peghilato alfa e ribavirina, che nel peggiore dei casi poteva durare fino a 18 mesi. La terapia ha risposto solo nel 50-70% dei pazienti, con la contemporanea comparsa di effetti collaterali talvolta gravi, come effetti ematotossici, sintomi influenzali, affaticamento o sintomi psichiatrici. Lo sviluppo di nuovi antivirali ad azione diretta (DAA) ha rivoluzionato la terapia dell’HCV. Invece di una lunga terapia con interferone, con molti effetti collaterali e tassi di successo moderati, la terapia con una combinazione di DAA ha oggi tassi di successo superiori al 95% ed è molto ben tollerata senza effetti collaterali significativi [12].
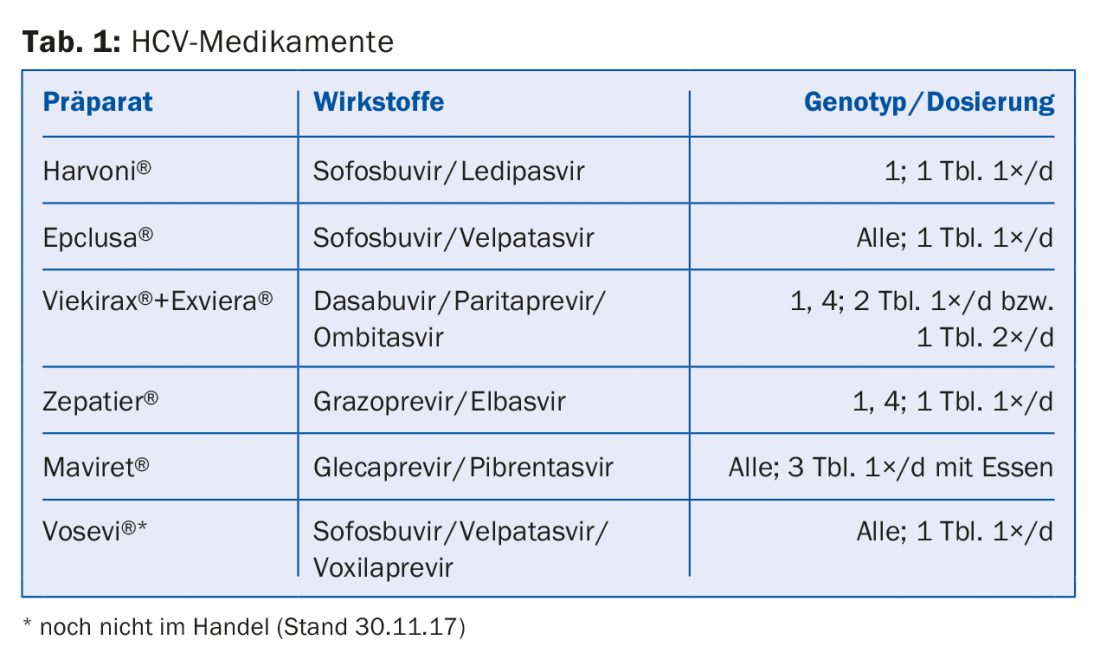
Gli inibitori dell’HCV NS5A, come ledipasvir o velpatasvir, inibiscono la proteina virale NS5A, che svolge un ruolo nella replicazione dell’HCV e nella modulazione della funzione cellulare, e terminano con il suffisso -asvir. Tra gli inibitori della polimerasi NS5B RNA-dipendente, gli inibitori nucleosidici (NI), come il sofosbuvir, si distinguono dagli inibitori non nucleosidici (NNI), come il dasabuvir: terminano con il suffisso -buvir. Gli inibitori della proteasi, come grazoprevir o glecaprevir, inibiscono la serina proteasi NS3/A4 del virus e terminano con il suffisso -previr. La tabella 1 presenta una selezione dei farmaci attualmente approvati in Svizzera e soggetti all’assicurazione sanitaria obbligatoria.
Indicatori di successo della terapia
Il successo della terapia antivirale viene valutato dodici settimane dopo la fine della terapia. Se l’RNA virale non viene più rilevato dalla biologia molecolare mediante la PCR, si parla di risposta virologica sostenuta (SVR), per cui i pazienti possono essere considerati liberi dal virus e guariti.
I metastudi dimostrano che la probabilità di un successivo ritorno del virus entro cinque anni dalla fine della terapia è inferiore all’1% nella popolazione normale e circa il 10% nella popolazione ad alto rischio (uso continuo di droghe per via endovenosa, detenuti). Tuttavia, le persone colpite hanno molte più probabilità di essere reinfettate dal virus, spesso con un genotipo diverso, che di avere una ricaduta in una fase successiva [13].
Ulteriori studi dimostrano che il raggiungimento della SVR riduce la mortalità associata al fegato ed extraepatica dovuta all’infezione da virus dell’epatite C [14]. Inoltre, il raggiungimento della SVR è anche associato a un aumento della qualità della vita, motivo per cui è un endpoint consolidato e rilevante per il paziente nella terapia dell’epatite C [14].
Se viene raggiunta la SVR nei pazienti senza cirrosi epatica, è necessario eseguire un controllo di laboratorio dell’HCV RNA dopo circa dodici mesi. Se il test continua ad essere negativo, i pazienti sono considerati definitivamente guariti e non necessitano di follow-up, a condizione che non vi siano altri fattori di rischio epatologico. I pazienti con cirrosi epatica devono continuare a essere visitati ogni sei mesi per il monitoraggio clinico e di laboratorio e per lo screening ecografico del carcinoma epatocellulare (HCC) anche dopo il raggiungimento della SVR.
Recidiva di HCC
Due diversi studi di coorte, condotti a Bologna [15] e a Barcellona [16], hanno riscontrato che i pazienti con HCC precedentemente trattato avevano inspiegabilmente una recidiva di HCC sei mesi dopo il completamento della terapia antivirale, rispettivamente nel 29% e nel 27,6% dei casi. Nei pazienti senza storia di HCC, l’HCC è stato rilevato in circa il 3,2% dei casi in entrambi gli studi. Questa associazione non ha potuto essere confermata in altri studi. Tuttavia, il numero di studi in merito è ancora esiguo. In attesa di ulteriori dati su questo argomento, raccomandiamo un esame ecografico del fegato nella pratica prima e dopo la terapia antivirale.
Pianificazione della terapia
Fino a poco tempo fa, in Svizzera la terapia con i DAA era disponibile solo per i pazienti con fibrosi epatica di grado 2 o superiore, a causa dei prezzi elevati. Tuttavia, al più tardi dal 1.10.2017, con la significativa riduzione dei prezzi, la limitazione non è più applicabile; da allora, la terapia DAA è obbligatoria per tutti i pazienti con infezione da HCV, indipendentemente dallo stadio di fibrosi.
Nella scelta e nella durata della terapia devono essere considerati i seguenti fattori: Genotipo dell’HCV, cirrosi/non cirrosi, terapia-nave/terapia-esperiente (e se sì, quale), nonché le comorbidità.
Le combinazioni di DAA raccomandate nelle Linee Guida SASL (Associazione Svizzera per lo Studio del Fegato) dell’agosto 2017 si trovano in forma modificata nelle tabelle da 2 a 5 per le rispettive costellazioni [17]. Inoltre, le raccomandazioni terapeutiche per il farmaco recentemente approvato Maviret® (glecaprevir/pibrentasvir) sono elencate in base alle informazioni sul prodotto [18]. Può essere utilizzato e prescritto dal 1.12.2017.
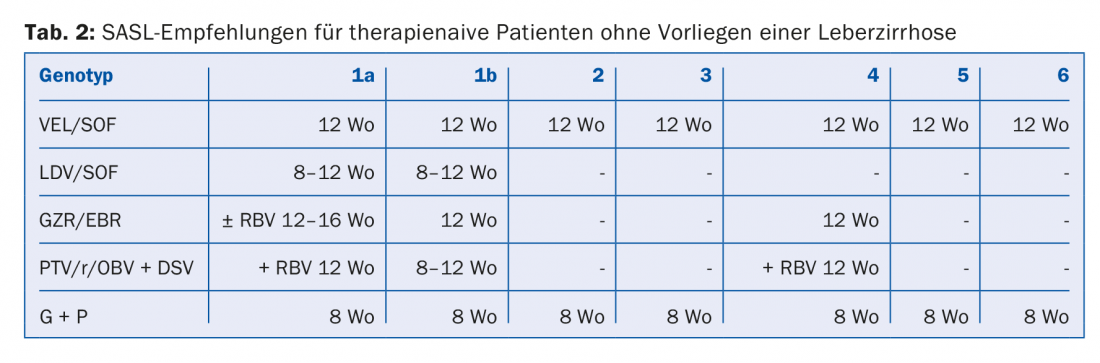
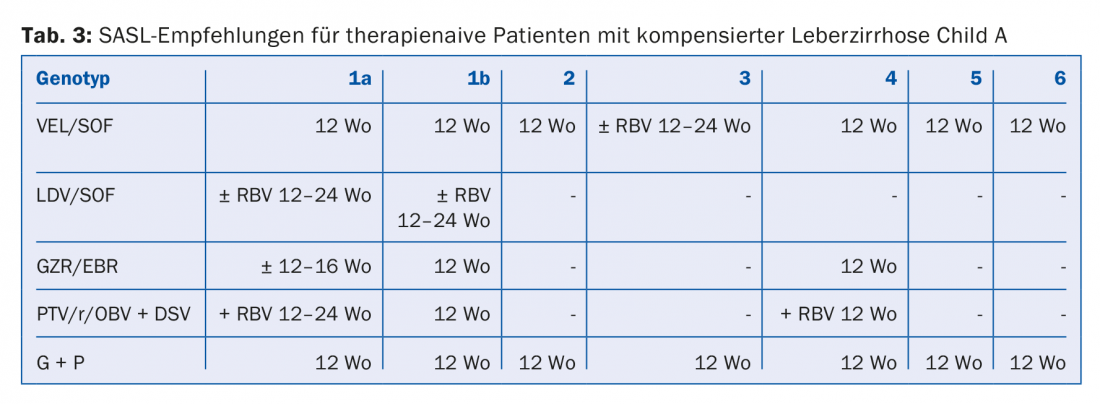
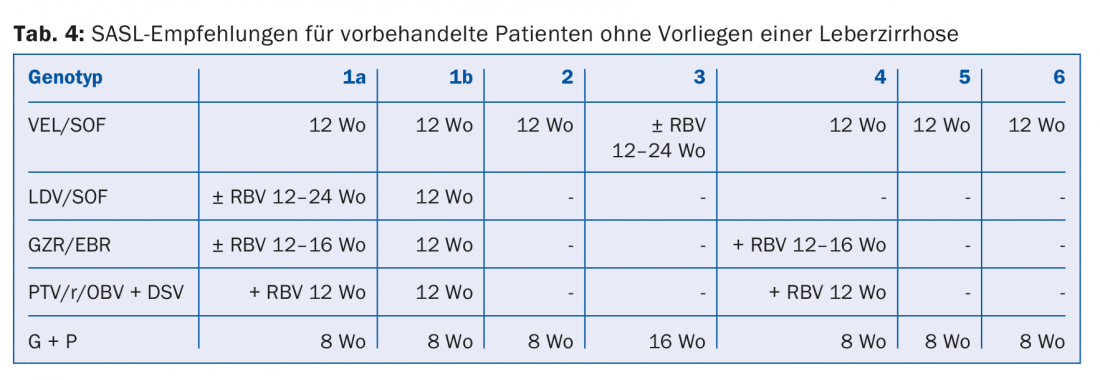
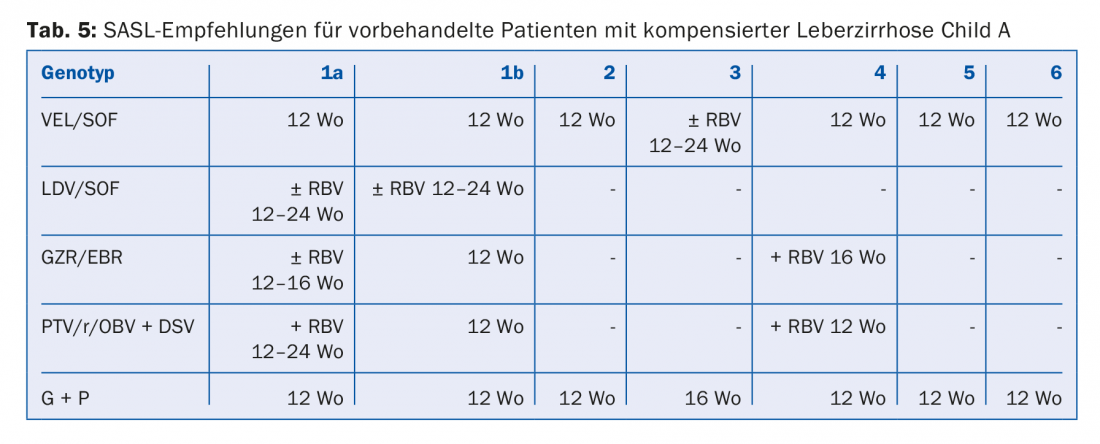
A causa del costante aggiornamento delle raccomandazioni terapeutiche, è consigliabile informarsi sulla terapia individuale, ad esempio sulla homepage www.sasl.ch o sull’applicazione per smartphone SASL HCV Advisor.
Di particolare rilievo sono le combinazioni DAA sofosbuvir/velpatasvir e glecaprevir/pibrentasvir, il cui vantaggio risiede nell’elevata efficacia pangenotipica. Inoltre, la combinazione glecaprevir/pibrentasvir richiede solo una durata totale della terapia di otto settimane ed è stata molto ben tollerata negli studi; gli effetti collaterali più comuni sono stati il mal di testa (18-19%) e l’affaticamento (9-12%) [19]. Di conseguenza, questa combinazione è considerata particolarmente vantaggiosa nei pazienti con una compliance difficile.
Fallimento della terapia
Il fallimento del trattamento di una combinazione DAA è solitamente dovuto a una situazione virologica complessa con la selezione di varianti associate alla resistenza (RAV), motivo per cui la ri-terapia con una combinazione DAA + ribavirina deve essere iniziata in un centro specializzato dopo aver effettuato il test di resistenza [20].
In alternativa, si può prendere in considerazione la terapia con i nuovi farmaci antivirali glecaprevir/pibrentasvir o sofosbuvir/velpatasvir/voxilaprevir. Per la combinazione sofosbuvir/velpatasvir/voxilaprevir su 12 settimane, due grandi studi di fase 3 (POLARIS 1 e 4) hanno raggiunto tassi di SVR del 96% e 98%, rispettivamente, in tutti i genotipi con precedente fallimento del trattamento con una combinazione di DAA [21]. Quest’ultimo dovrebbe essere approvato in Svizzera all’inizio del 2018.
Interazioni e controindicazioni
Se durante la terapia antivirale si assumono altri farmaci, è fondamentale informarsi sul loro potenziale di interazione con i DAA (ad esempio, alla pagina www.hep-druginteractions.org o sul sito www.compendium.ch).
Soprattutto gli antiaritmici, gli antibiotici, gli antidepressivi o gli anticonvulsivanti che inibiscono la glicoproteina P o interagiscono con il sistema CYP si rivelano spesso problematici. Ad esempio, l’uso contemporaneo di sofosbuvir e amiodarone può portare a bradiaritmie pericolose per la vita [22].
In presenza di insufficienza renale cronica con un eGFR <30 ml/min, devono essere utilizzate combinazioni senza sofosbuvir [23]. Inoltre, una terapia durante la gravidanza è controindicata, perché un possibile effetto teratogeno della DAA non poteva essere escluso dagli studi condotti finora.
Nei pazienti con cirrosi di Child B/C e con precedenti scompensi, l’uso degli inibitori della proteasi deve essere evitato, poiché raggiungono una concentrazione molto più elevata [23].
Solo se i fornitori di cure primarie e gli specialisti si uniscono, sarà possibile raggiungere l’obiettivo comune della Strategia svizzera contro l’epatite e dell’OMS, ossia l’eliminazione dell’HCV entro il 2030.
Messaggi da portare a casa
- Con l’abbassamento del limite per la maggior parte delle combinazioni di DAA (“antivirali ad azione diretta”), la terapia per l’epatite C cronica è disponibile per tutti i pazienti infetti, indipendentemente dallo stadio di fibrosi, ed è coperta dall’assicurazione sanitaria.
- Con le nuove combinazioni di DAA, l’epatite cronica C è curabile in oltre il 95% dei casi, senza la comparsa di effetti collaterali significativi.
- Se si raggiunge una situazione di SVR (“risposta virologica sostenuta”), la probabilità di una ricaduta tardiva dell’infezione da epatite C è inferiore all’1%.
- Le combinazioni DAA pangenotipicamente efficaci sofosbuvir/velpatasvir o sofosbuvir/velpatasvir/voxilaprevir e glecaprevir/pibrentasvir dovrebbero semplificare ulteriormente la terapia dell’infezione cronica da virus dell’epatite C in futuro.
Letteratura:
- OMS: Scheda informativa sull’epatite C. www.who.int/mediacentre/factsheets/fs164/en/
- OMS: Rapporto globale sull’epatite 2017. http://apps.who.int/iris/bitstream/10665/255016/1/9789241565455-eng.pdf?ua=1
- Zahnd C, et al.: Analisi della situazione delle epatiti B e C in Svizzera. UFSP marzo 2017.
- Yeung CY, et al.: Trasmissione verticale del virus dell’epatite C – conoscenze attuali e prospettive. World J Hepatol 2014; 6: 643-651.
- Webster DP, et al: Epatite C. Lancet 2015; 385: 1124-1135.
- Messina JP, et al: Distribuzione globale e prevalenza dei genotipi del virus dell’epatite C. Epatologia 2015; 61(1): 77-87.
- Bruggmann P: Epidemiologia dell’epatite C in Svizzera e ruolo dell’assistenza primaria. Pratica 2016; 105(15): 885-889.
- Deterding K, et al: Ledipasvir più sofosbuvir a dose fissa per 6 settimane in pazienti con monoinfezione acuta da virus dell’epatite C di genotipo 1 (HepNet Acute HCV IV): uno studio di fase 2 in aperto, a braccio singolo. Lancet Infect Dis 2017; 17: 215-222.
- Poynard T, et al.: Storia naturale della progressione della fibrosi epatica nei pazienti con epatite C cronica. I gruppi OBSVIRC, METAVIR, CLINIVIR e DOSVIRC. Lancet 1997; 349: 825-832.
- Fattovich G, et al: Carcinoma epatocellulare nella cirrosi: incidenza e fattori di rischio. Gastroenterologia 2004; 127: 35-50.
- Bruggmann P, et al: Distribuzione dell’anno di nascita nei casi di epatite C in Svizzera. Eur J Public Health 2015 Feb; 25(1): 141-143.
- Zeuzem S: Opzioni di trattamento nell’epatite C. Dtsch Arztebl Int 2017 Jan; 114(1-2): 11-21.
- Simmons B, et al.: Rischio di recidiva tardiva o di reinfezione con il virus dell’epatite C dopo aver raggiunto una risposta virologica sostenuta – una revisione sistematica e una meta-analisi. Clin Infect Dis 2016; 62: 683-694.
- Lee MH, et al: L’infezione cronica da virus dell’epatite C aumenta la mortalità per malattie epatiche ed extraepatiche – uno studio prospettico a lungo termine basato sulla comunità. J Infect Dis 2012; 206; 469-477.
- Conti F, et al: Insorgenza precoce e recidiva del carcinoma epatocellulare nella cirrosi HCV-correlata trattata con antivirali ad azione diretta. J of Hepatol 2016; 65(4): 727-733.
- Reig M, et al: Alto tasso inaspettato di recidiva tumorale precoce nei pazienti con HCC HCV-correlato sottoposti a terapia senza interferone. J of Hepatol 2016 Oct; 65(4): 719-726.
- SASL: Linee guida. https://sasl.unibas.ch/guidelines/SASL-SSI_HepC_EOS_Aug2017.pdf (ultimo accesso 16 ottobre 2017).
- Informazioni tecniche su Maviret®. www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Product_Information/human/004430/WC500233677.pdf (ultimo accesso 16 ottobre 2017).
- Zeuzem S: ENDURANCE-1: una valutazione di fase 3 dell’efficacia e della sicurezza del trattamento di 8 settimane contro 12 settimane con Glecaprevir/Pibrentasvir (precedentemente ABT-493/ABT-530) in pazienti con infezione da HCV di genotipo 1 con o senza coinfezione da HIV-1 e senza cirrosi. Meeting sul fegato dell’AASLD, Boston 2016; Presentazione orale.
- Vermehren J, et al: Ritiro dei pazienti che hanno fallito le terapie di combinazione DAA – Esperienza del mondo reale da un grande database di resistenza all’epatite C. J Hepatol 2016; 64; S188.
- Bourlière M, et al: Sofosbuvir, velpatasvir, voxilaprevir per l’infezione da HCV trattata in precedenza. N Engl J Med 2017; 376: 2134-2146.
- Fontaine H, et al: Bradiaritmie associate al trattamento con sofosbuvir. N Engl J Med 2015; 373: 1886-1888.
- EASL: Raccomandazioni sul trattamento dell’epatite C 2016. J Hepatol 2017 Jan; 66(1): 153-194.
PRATICA GP 2018; 13(1): 24-28











