I dosaggi in pediatria rappresentano una grande sfida per i pediatri, perché in molti casi non sono disponibili informazioni vincolanti. Questo è anche il caso della fitoterapia, perché i dati vincolanti possono essere trovati solo con gli studi clinici corrispondenti, che non vengono quasi mai realizzati per motivi etici, oppure non vengono quasi mai concessi i permessi per realizzarli.
Fitoterapia adatta ai bambini
La fitoterapia si offre come una forma di terapia adatta ai bambini per diversi motivi. Molti farmaci a base di erbe hanno un’ampia gamma terapeutica, quindi il rischio di sovradosaggio è molto ridotto nella maggior parte dei casi. Grazie al loro effetto per lo più lieve, molte piante medicinali sono adatte alle applicazioni pediatriche, sia come trattamento singolo che come trattamento aggiuntivo. Inoltre, i farmaci a base di erbe sono molto adatti alle indicazioni che spesso devono essere trattate nei bambini, come le malattie delle vie respiratorie, i disturbi del tratto gastrointestinale, l’irrequietezza e i disturbi del sonno, nonché le applicazioni dermatologiche. È di grande utilità che i professionisti, come i medici e i farmacisti, abbiano informazioni sufficienti sul dosaggio dei farmaci vegetali, in modo da poter consigliare in modo ottimale i genitori e utilizzare in modo sicuro i farmaci vegetali nelle indicazioni appropriate.
Nozioni di base sul dosaggio
Per il calcolo dei dosaggi dei medicinali per bambini, si utilizzano formule che cercano di rendere giustizia alla natura del bambino (Tab. 1). C’è poca letteratura sul dosaggio dei farmaci a base di erbe nei bambini [1–3]. Se le informazioni sui dosaggi per bambini sono riportate nel foglietto illustrativo di un medicinale, queste informazioni sono ovviamente valide, perché sono state approvate da Swissmedic. La Tabella 2 elenca i medicinali vegetali presenti nell’elenco delle specialità (SL) per i quali i dosaggi per bambini sono indicati nel foglietto illustrativo.
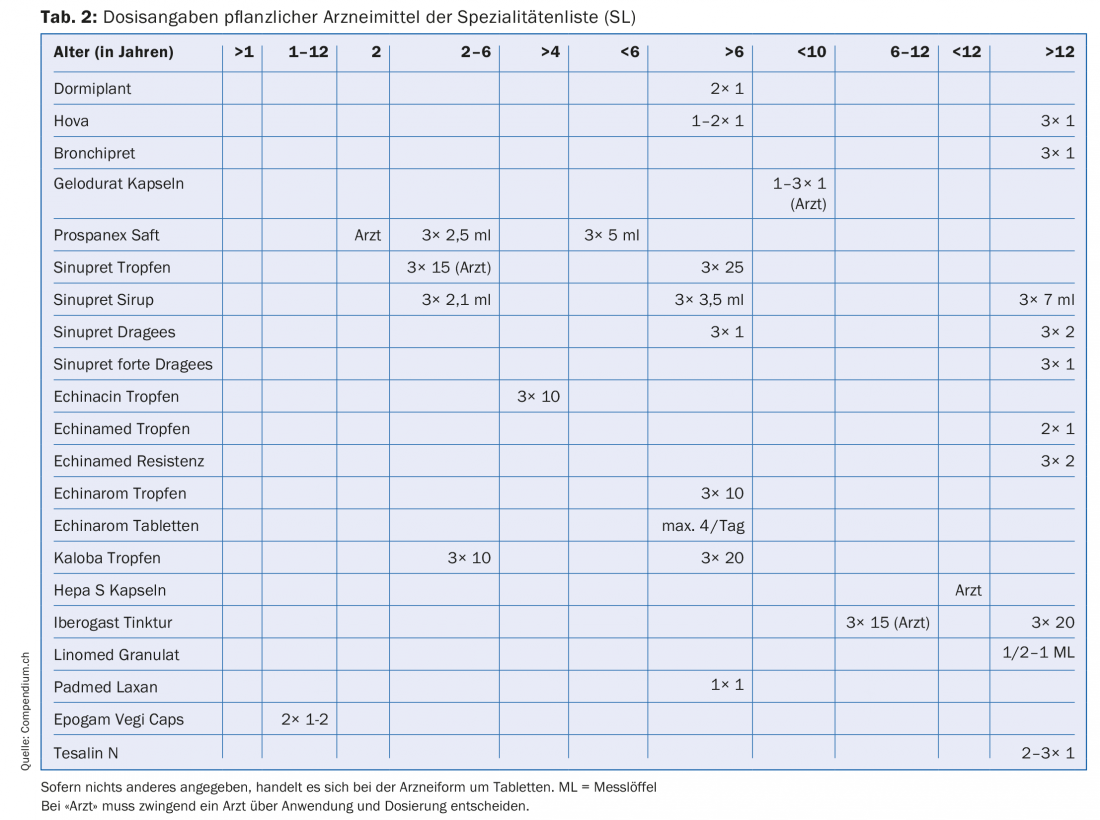
Le età
La Tabella 2 mostra che esistono indicazioni di dosaggio per gruppi di età molto diversi. La gamma dei gruppi di età va da >1 anno a >12 anni, con numerosi sottogruppi intermedi.
Inoltre, esistono foglietti informativi per i pazienti che rendono obbligatorio, per alcune fasce d’età, il coinvolgimento di un medico in merito a un uso pianificato. Ex. Sciroppo per la tosse Prospanex: nei bambini di età inferiore ai due anni, solo il medico deve decidere l’uso e la dose. Ci sono anche medicinali per i quali l’informativa al paziente fornisce le dosi per una certa fascia d’età, ma rimanda comunque al medico, che è il responsabile finale. Questo è il caso, ad esempio, di Iberogast gocce per i bambini di età compresa tra 6 e 12 anni.
Perché ci sono gruppi di età così diversi? Ci sono diverse ragioni per questo.
Agenzia Medica Europea (EMA)
L’Agenzia Medica Europea, l’autorità di registrazione dell’Unione Europea con sede a Londra, stabilisce che quando un medicinale è di nuova autorizzazione, il farmaco in questione è controindicato nei bambini e negli adolescenti di età inferiore ai 12 anni, a meno che il richiedente non sia in grado di fornire dati clinici adeguati [4].
Quindi, se un’azienda farmaceutica vuole registrare anche gli usi pediatrici nell’ambito di un’autorizzazione all’immissione in commercio o del rinnovo di un’autorizzazione all’immissione in commercio per un medicinale, deve presentare un cosiddetto Piano di Indagine Pediatrica (PIP). Questo documento, creato dall’EMA, regola esattamente quali documenti e che tipo di studi sono necessari per tale autorizzazione. Il PIP presentato viene esaminato dal Comitato pediatrico (PDCO), un’organizzazione dell’EMA. Il PDCO decide in merito all’approvazione delle domande di questi bambini.
Conferenza internazionale sull’armonizzazione (ICH)
La Conferenza internazionale sull’armonizzazione dei requisiti tecnici per la registrazione dei prodotti farmaceutici per uso umano, un’organizzazione fondata nel 1990, è responsabile della definizione delle classi di età dei bambini. Secondo il suo sito web, il suo scopo è quello di raggiungere una migliore armonizzazione nello sviluppo e nella registrazione di farmaci efficaci e sicuri in tutto il mondo. Promuove il dialogo tra i produttori e le autorità di registrazione. Nelle Linee guida “Indagine clinica dei medicinali nella popolazione pediatrica” [5], approvate il 20 luglio 2000, ICH definisce i seguenti gruppi di età pediatrica:
- Neonato: 0-27 giorni
- Neonati/lattanti: da 28 giorni a 23 mesi
- Bambini: 2-11 anni
- Adolescenti: da 12 a 16-18 anni
Questa classificazione è giustificata dalle differenze nello sviluppo del sistema nervoso centrale (SNC), del sistema immunitario, della clearance renale ed epatica e dei cambiamenti ormonali (adolescenti) di questi gruppi di età.
Approvazione senza PIP
Se un’azienda farmaceutica desidera ottenere una raccomandazione di dosaggio per uno o più di questi gruppi di età per un’indicazione specifica nel contesto dell’autorizzazione all’immissione in commercio di un medicinale, deve presentare un PIP con le informazioni corrispondenti, come già detto. Se non lo fa, o se le informazioni contenute nel PIP non vengono approvate, l’EMA dichiara che l’uso di questo medicinale è controindicato per i bambini e gli adolescenti di età inferiore ai 18 anni. Questo è il caso, ad esempio, del medicinale a base di erbe Kardionin, un preparato a base di Crataegus, registrato dal 2013. Poiché il fornitore di cardionina non è stato in grado o non ha voluto presentare la documentazione per l’uso nei bambini, cosa abbastanza possibile data l’indicazione del farmaco, il foglietto illustrativo indica l’uso solo per gli adulti. >18 anni di età, nonché l’informazione “L’uso e la sicurezza di Kardionin nei bambini e negli adolescenti non sono stati studiati finora”.
Informazioni divergenti
Nell’elenco di medicinali vegetali riportato di seguito (Tab. 2), che include informazioni sui dosaggi per bambini, ci sono molte indicazioni che non corrispondono alla classificazione ICH per età, ad esempio dosaggi per bambini di età superiore ai sei anni o tra i 2-6 anni. Queste indicazioni possono essere fatte perché i medicinali corrispondenti sono stati autorizzati dall’EMA e dall’ICH prima dell’entrata in vigore dei regolamenti e sono stati autorizzati a fare le indicazioni corrispondenti sulla base dei regolamenti di allora.
Sommario
Poiché i farmaci vegetali sono adatti all’uso pediatrico, è importante che i professionisti dispongano di una base affidabile per il dosaggio dei gruppi di età appropriati. In assenza di tali informazioni, si possono fare delle approssimazioni ai dosaggi appropriati utilizzando la superficie corporea, il peso o l’età del bambino. Tuttavia, queste sono approssimazioni e devono essere trattate con cautela. Nel caso di una nuova registrazione di un medicinale, quindi anche di un prodotto a base di erbe, il richiedente deve, in base ai regolamenti dell’EMA e dell’ICH, fornire informazioni precise sull’efficacia e la sicurezza del medicinale, corroborate da studi clinici, in modo da poter fornire le relative indicazioni. Altrimenti, il farmaco è controindicato nei bambini e negli adolescenti <18 anni.
Letteratura:
- Schicher H, Dorsch W: Fitoterapia in pediatria. Wissenschaftliche Verlagsgesellschaft Stuttgart 2006.
- Kooperation Phytopharmaka, Bonn: “Kinderdosierungen von Phytopharmaka” – 3a edizione rivista e ampliata 2002.
- von Mandach U, et al: Applicazione dei medicinali vegetali in pediatria. Fitoterapia 2002(5); 2: 8-16.
- www.ema.europa.eu
- www.ich.org
PRATICA GP 2017; 12(8): 2-4












