Il trattamento sistemico adiuvante migliora la sopravvivenza e l’assenza di recidiva nel carcinoma mammario precoce. Gli esami genetici del tumore possono aiutare nella scelta della terapia. La terapia di supporto è utile anche anni dopo il completamento della terapia adiuvante.
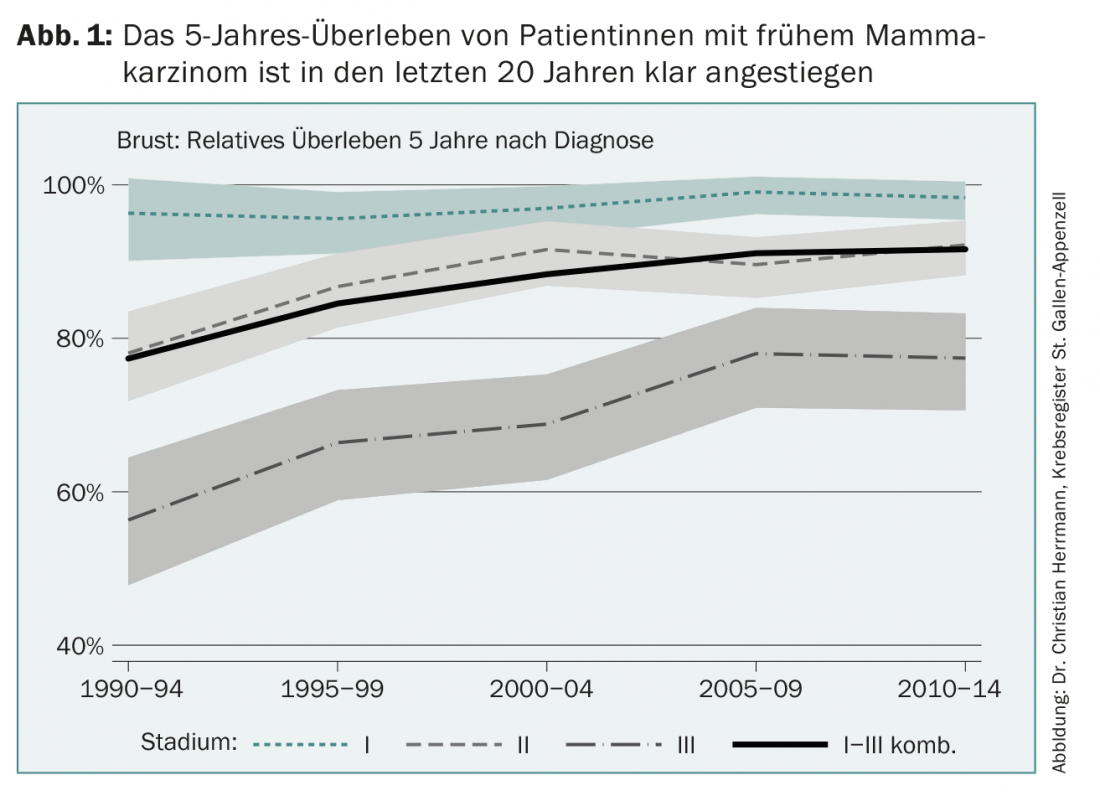
La terapia adiuvante per il cancro al seno precoce ha fatto passi da gigante da quando è stata introdotta, poco più di 40 anni fa. Oggi, oltre l’80% delle donne con cancro al seno in Europa può essere curato (Fig. 1). Questo progresso ha diverse cause, come il miglioramento della diagnosi precoce, i programmi di screening mammografico, le nuove opzioni chirurgiche e di radioterapia, ma anche il continuo sviluppo delle terapie aggiuntive del sistema farmacologico, note come adiuvanti. Questa storia di successo è il risultato di studi randomizzati internazionali e della loro successiva implementazione nella pratica clinica quotidiana, un processo che non è affatto scontato. In alcuni Paesi asiatici, ad esempio, il tasso di sopravvivenza a lungo termine dopo una nuova diagnosi di cancro al seno è oggi solo del 40% circa, per vari motivi.
Le conferenze periodiche di San Gallo sul trattamento del carcinoma mammario precoce, che ora si tengono ogni due anni, forniscono una buona illustrazione degli sviluppi scientifici dagli anni ’80 in poi. Questi congressi sono sempre accompagnati da un consenso di esperti di fama internazionale sul cancro al seno, che riceve attenzione a livello mondiale e viene pubblicato con grande rilievo.
Nelle discussioni interdisciplinari nei regolari consigli tumorali, le linee guida riconosciute vengono implementate nella pianificazione terapeutica ottimizzata e personalizzata, una procedura istituzionalizzata nei centri di senologia che contribuisce in modo significativo al miglioramento dei risultati terapeutici.
Il 15° Congresso di San Gallo sul tema della terapia primaria del carcinoma mammario precoce si è svolto per la seconda volta a Vienna dal 15 al 18 marzo 2017 e si è svolto all’insegna della pianificazione terapeutica personalizzata. Questo dovrebbe essere il più possibile non invasivo, ma forte quanto necessario (“de-escalating and escalating treatments for early stage breast cancer”). Le raccomandazioni di consenso successivamente formulate possono essere lette negli Annals of Oncology [1]. Negli anni precedenti, era stata sottolineata la personalizzazione della terapia in adattamento alla diversa biologia dei tumori. Le raccomandazioni generali devono anche essere adattate ai valori, ai desideri e alle possibilità individuali dei pazienti interessati, nonché alle possibilità economiche. Il Gruppo di esperti rileva inoltre nel consenso che gli studi randomizzati non possono fornire risposte adeguate in tutti i casi individuali e a tutte le domande cliniche pertinenti.
Con l’aumento della sopravvivenza a lungo termine delle pazienti con tumore al seno (“sopravvissute”), altri aspetti stanno acquisendo importanza, ad esempio le conseguenze a lungo termine delle terapie e le questioni sociali come il reinserimento professionale.
Se e quale terapia sistemica aggiuntiva sia possibile e utile dipende principalmente dalla biologia del carcinoma, ma anche dalla stadiazione e quindi dalla probabilità di recidiva o metastasi.
I diversi tipi di carcinoma mammario vengono distinti sulla base della biologia molecolare, una classificazione che, tuttavia, può essere effettuata in modo simile nella pratica, secondo le precedenti raccomandazioni di consenso, utilizzando metodi immunoistochimici ampiamente disponibili [2]. Questi sottotipi sono chiamati Luminal A, Luminal B, HER 2-positivi e tripel-negativi e mostrano un comportamento diverso con relative raccomandazioni terapeutiche.
Terapie a base ormonale
Nel caso di recettori estrogenici rilevati immunoistochimicamente nelle cellule tumorali, si raccomanda la terapia ormonale adiuvante, nel caso di tumori luminali A spesso come unica terapia di sistema o anche in aggiunta alla chemioterapia, a seconda della costellazione. Anche una bassa espressione di recettori estrogenici è sufficiente per questa indicazione.
Nelle donne in postmenopausa, uno degli inibitori dell’aromatasi, letrozolo, anastrozolo o exemestane, è preferibile al tamoxifene, grazie alla sua efficacia leggermente migliore. In caso di problemi di tolleranza o di comorbidità, il tamoxifene può essere utilizzato come alternativa, grazie al diverso profilo di effetti collaterali, soprattutto se il rischio di recidiva è inferiore.
Gli studi clinici hanno dimostrato che dieci anni di terapia ormonale adiuvante, che sia con tamoxifene [3], un inibitore dell’aromatasi [4] o una sequenza, è leggermente superiore a un periodo di trattamento di cinque anni, che è stato la norma. Questa durata più lunga della terapia è di importanza clinica, soprattutto per le donne con un rischio maggiore di ricaduta.
Nelle donne in premenopausa, la monoterapia con tamoxifene rimane un’opzione terapeutica riconosciuta come valida. Una terapia aggiuntiva con agonista LHRH o un inibitore dell’aromatasi e un agonista LHRH sono leggermente più efficaci – come hanno dimostrato gli studi randomizzati – ma sono associati a effetti collaterali molto più gravi [5]. Questo è generalmente giustificato nei casi di maggior rischio di recidiva, come nelle donne di età inferiore ai 35 anni, nei tumori con un grado di differenziazione più scarso e nei casi di coinvolgimento di almeno quattro linfonodi ascellari; situazioni che di solito hanno portato anche alla scelta di una chemioterapia adiuvante aggiuntiva.
Chemioterapia per il carcinoma mammario recettore-positivo
La chemioterapia adiuvante aggiuntiva per i tumori positivi al recettore è indicata quando il rischio di recidiva è più elevato; in genere questo è già il caso per il tipo Luminal B.
Il rischio di recidiva può essere dedotto dalla biologia e dipende anche dallo stadio del tumore, soprattutto dal numero di linfonodi ascellari colpiti. Fattori importanti sono il grado di differenziazione e il tasso di proliferazione, che possono essere misurati immunoistochimicamente con il marcatore Ki-67. La standardizzazione e la riproducibilità di questo fattore quantitativo è stata una sfida per i patologi.
Un ulteriore parametro prognostico interessante è il grado di infiltrazione del tumore da parte dei linfociti. Un numero più elevato di TIL (linfociti infiltranti il tumore) indica una risposta immunitaria antitumorale più pronunciata ed è associato a una prognosi migliore. Tuttavia, questo fattore non è attualmente sufficientemente standardizzato per essere utilizzato per le decisioni terapeutiche nella pratica di routine.
Esistono anche possibilità basate su Internet per ottenere un’indicazione della prognosi con un algoritmo basato su dati clinici/patologici, che può essere un aiuto nella consulenza ai pazienti (www.adjuvantonline.com o Predict www.predict.nhs.uk). Quest’ultimo algoritmo prende in considerazione anche il livello di proliferazione Ki-67 e lo stato HER 2.
Test genetici convalidati e riproducibili sul materiale tumorale possono influenzare ulteriormente la decisione a favore o contro la chemioterapia adiuvante aggiuntiva. Questo vale in particolare per i carcinomi mammari recettoriali positivi con un coinvolgimento linfonodale ascellare assente o limitato, se il risultato del test indica una prognosi molto buona e quindi consente di rinunciare alla chemioterapia aggiuntiva. Esistono diversi test concorrenti consolidati a disposizione dei medici, come Oncotype®, Endopredict® o Mammaprint®. L’uso di tali test in queste situazioni è esplicitamente sostenuto dal Consenso di San Gallo.
Tumori HER 2 positivi
Un anno di trattamento con trastuzumab, attualmente disponibile anche in forma sottocutanea, in aggiunta alla chemioterapia ed eventualmente alla terapia anti-ormonale, migliora sostanzialmente la sopravvivenza libera da recidiva. La chemioterapia può essere una terapia contenente antracicline e taxani; per i tumori piccoli con un rischio minore di recidiva, può anche essere limitata ai soli taxani.
Nella situazione preoperatoria, la somministrazione combinata degli anticorpi anti-HER-2 trastuzumab e pertuzumab può anche migliorare sostanzialmente la risposta [6]. Questo suggerisce anche un uso adiuvante post-operatorio. I dati tanto attesi degli studi Aphinity sono stati presentati al Congresso ASCO 2017 e hanno mostrato un miglioramento statisticamente significativo della libertà da recidiva, ma in termini assoluti in una piccola fascia dell’1% [7]. Questo costoso trattamento aggiuntivo, quindi, probabilmente apporterà un beneficio aggiuntivo clinicamente rilevante nella situazione adiuvante, solo in un gruppo ristretto di pazienti con un rischio maggiore di recidiva.
Carcinomi triplo-negativi
Questi tumori privi dell’espressione dei recettori dell’estrogeno e del progesterone e privi della sovraespressione dei recettori HER 2 sono biologicamente un gruppo eterogeneo. Se si sceglie la terapia adiuvante, si considera solo la chemioterapia, di solito una combinazione di antracicline/alchilanti e taxani.
I carcinomi mammari con mutazioni BRCA 1 o 2 sono frequenti, ma non sempre tripli negativi. Per questi pazienti, si può scegliere la chemioterapia contenente platino. Al di fuori degli studi attualmente in corso, l’uso degli inibitori PARP non è (ancora?) giustificato in questa situazione.
Terapie neoadiuvanti
Sebbene non vi sia alcun vantaggio in termini di sopravvivenza se la terapia di sistema necessaria viene eseguita prima dell’intervento chirurgico per il carcinoma mammario (cioè neoadiuvante). Tuttavia, l’intervento deve riguardare solo l’area del tumore residuo, cioè non l’estensione del tumore originale. Se l’esame del linfonodo sentinella eseguito dopo la chemioterapia non mostra alcun coinvolgimento del tumore, si può evitare l’escissione ascellare. Il vantaggio del trattamento neoadiuvante è quindi la possibilità di una terapia chirurgica meno invasiva, che può eventualmente anche essere eseguita in modo conservativo del seno, nonostante un tumore inizialmente grande.
La terapia neoadiuvante dà anche il tempo per la pianificazione chirurgica, che può essere importante per le donne con sospette mutazioni BRCA, al fine di effettuare la consulenza genetica e l’analisi genetica e successivamente discutere l’opzione della mastectomia, eventualmente anche bilaterale.
Il consenso raccomanda terapie neoadiuvanti per i carcinomi mammari HER 2positivi e triplo-negativi.
Terapie antiriassorbitive
Sulla base degli studi austriaci che affermano che lo zoledronato o il denosumab non solo proteggono dall’osteoporosi, ma riducono anche il rischio di ricaduta [8,9], il panel di consenso ha accettato che il trattamento aggiuntivo con bifosfonati (non ancora denosumab) fosse indicato nello stato ormonale della postmenopausa.
Terapie di supporto
Molti pazienti sono molto ricettivi alle raccomandazioni dietetiche. È motivante poter contribuire al recupero in un’area che generalmente è oggetto di molte discussioni e mantenere il controllo sul trattamento, almeno in alcune aree. Sebbene non esista una dieta vera e propria che i pazienti sperano possa avere un effetto su un tumore esistente, la consulenza nutrizionale è utile. Sia la chemioterapia che i trattamenti (anti)ormonali possono occasionalmente causare un marcato aumento di peso. Per questo motivo è utile una consulenza proattiva, che includa un’informazione equilibrata sul fatto che una dieta priva di zucchero, lattosio o glutine è una misura non provata nel trattamento del cancro. Tuttavia, l’obesità ha una comprovata efficacia nello sviluppo del cancro e le pazienti con tumore al seno senza obesità possono sperare in una mortalità inferiore [10] e in un tasso di recidiva.
Un altro aspetto importante è l’esercizio fisico sufficiente. Ci sono sempre più dati che indicano che l’attività fisica può ridurre il tasso di recidiva [11]. Occorre fare un orientamento appropriato e riferimenti alle offerte regionali.
Nel 2010, in Svizzera c’erano già quasi 300.000 cosiddetti “sopravvissuti” a vari tipi di tumore, di cui il cancro al seno è il gruppo più importante [12]. A causa dei numeri in continuo aumento, oggi ce ne saranno circa 350.000. Esistono programmi speciali, secondo la Krebsliga Ostschweiz (Lega contro il cancro della Svizzera orientale), che consigliano le donne in queste aree dopo aver completato il trattamento del tumore. Un altro servizio importante è il supporto psico-oncologico. È anche importante prevenire attivamente l’osteoporosi, soprattutto quando si assumono inibitori dell’aromatasi (determinazione della densità ossea, assunzione sufficiente di calcio e vitamina D, se necessario anche Prolia®).
Dopo un trattamento intensivo adiuvante, un numero considerevole di pazienti spesso soffre di sintomi di affaticamento di lunga durata, nonché di riduzione della concentrazione, difficoltà a trovare le parole e dimenticanza (“cervello da chemio”). Questi disturbi non devono essere semplicemente liquidati come psicogeni. Ci sono prove che indicano cambiamenti organici e misurabili nel cervello e hanno dimostrato che i processi infiammatori nel cervello sono causali [13].
Prospettiva
Altri nuovi farmaci troveranno spazio nella terapia adiuvante, probabilmente gli inibitori della chinasi ciclina-dipendente 4 e 6 (palbociclib) e gli inibitori PARP nelle pazienti con mutazioni BRCA. Il trattamento dei pazienti con neratinib dopo il trastuzumab nei carcinomi HER 2-positivi ha portato a un tasso di recidiva inferiore [14]. Una possibile speranza per i carcinomi mammari tripel-negativi sono le nuove immunoterapie.
Con le moderne terapie neoadiuvanti per il carcinoma mammario HER 2 positivo, è possibile ottenere una risposta completa senza tumore residuo al momento dell’intervento chirurgico in oltre la metà delle situazioni. La possibilità di rinunciare completamente alla chirurgia in queste situazioni sarà oggetto di studi clinici. In questo caso, la terapia farmacologica non sarebbe più adiuvante, ma la terapia principale per il carcinoma mammario precoce.
Messaggi da portare a casa
- Il trattamento sistemico adiuvante migliora significativamente la sopravvivenza e l’assenza di recidiva nel carcinoma mammario precoce.
- Un’équipe di trattamento interdisciplinare, con regolari schede tumorali, è un fattore importante per la raccomandazione di una terapia ottimale.
- Gli esami genetici del tumore possono aiutare nella scelta della terapia adiuvante o portare all’omissione della chemioterapia.
- L’assistenza di supporto anche anni dopo il completamento della terapia adiuvante è una parte importante del trattamento (“programma di sopravvivenza”).
Letteratura:
- Curigliano G, et al: De-escalation e Escalation dei trattamenti per il tumore al seno in fase iniziale: la Conferenza internazionale di consenso degli esperti di San Gallo sulla terapia primaria del tumore al seno in fase iniziale 2017. Annals of Oncology 2017; 28(8): 1700-1712.
- Goldhirsch A, et al: Strategie per i sottotipi – affrontare la diversità del cancro al seno: i punti salienti del consenso internazionale degli esperti di San Gallo sulla terapia primaria del cancro al seno precoce 2011. Ann Oncol 2011; 22(8): 1736-1747.
- Davies C, et al: Effetti a lungo termine della prosecuzione del tamoxifene adiuvante a 10 anni rispetto all’interruzione a 5 anni dopo la diagnosi di tumore al seno positivo al recettore degli estrogeni: ATLAS, uno studio randomizzato. Lancet 2013; 381(9869): 805-816.
- Goss PE, et al: Estendere la terapia adiuvante con inibitori dell’aromatasi a 10 anni. N Engl J Med 2016; 375(3): 209-219.
- Pagani O, et al: Exemestane adiuvante con soppressione ovarica nel carcinoma mammario in premenopausa. N Engl J Med 2014; 371: 107-118.
- Gianni L, et al: Analisi a 5 anni di pertuzumab e trastuzumab neoadiuvanti in pazienti con carcinoma mammario HER2-positivo localmente avanzato, infiammatorio o in fase iniziale (NeoSphere): uno studio randomizzato multicentrico, in aperto, di fase 2. Lancet Oncol 2016; 17(6): 791-800.
- von Minckwitz G, et al: Pertuzumab e trastuzumab adiuvanti nel carcinoma mammario precoce HER2-positivo. N Engl J Med 2017; 377: 122-131.
- Gnant M, et al: Acido zoledronico combinato con la terapia endocrina adiuvante di tamoxifene rispetto ad anastrozolo più soppressione della funzione ovarica nel carcinoma mammario precoce in premenopausa: analisi finale dell’Austrian Breast and Colorectal Cancer Study Group Trial 12. Ann Oncol 2015; 26: 313-320.
- Gnant M, et al: Denosumab adiuvante nel cancro al seno (ABCSG-18): uno studio multicentrico, randomizzato, in doppio cieco, controllato con placebo. Lancet 2015; 386: 433-443.
- Chan DS, et al: Indice di massa corporea e sopravvivenza nelle donne con cancro al seno – revisione sistematica della letteratura e meta-analisi di 82 studi di follow-up. Annali di Oncologia 2014; 25(10): 1901-1914.
- Dieli-Conwright CM: Ridurre il rischio di recidiva del cancro al seno: una valutazione degli effetti e dei meccanismi della dieta e dell’esercizio fisico. Curr Breast Cancer Rep 2016; 8(3): 139-150.
- Herrmann C: I sopravvissuti al cancro in Svizzera: una popolazione in rapida crescita da curare. BMC Cancer 2013; 13: 287.
- Morant R: Disturbo cognitivo associato alla chemioterapia. Info @ oncologia 2016; 6: 14-17.
- Chan A, et al: Neratinib dopo la terapia adiuvante a base di trastuzumab in pazienti con carcinoma mammario HER2-positivo (ExteNET): uno studio multicentrico, randomizzato, in doppio cieco, pl acebo-controllato, di fase 3. Lancet Oncology 2016; 17: 367-377.
InFo ONCOLOGIA & EMATOLOGIA 2017; 5(4): 10-13