La sindrome dell’ovaio policistico (PCO-S) è una delle cause più comuni di infertilità ed è uno dei disturbi endocrinologici più comuni nelle donne (5-10%) [1,2]. La definizione attualmente più utilizzata (criteri di Rotterdam) comprende due dei tre sintomi seguenti: ovaie policistiche – oligo/amenorrea e/o segni clinici di iperandrogenaemia. Circa il 50% delle persone colpite sono obese. In queste donne in particolare, di solito è possibile rilevare l’insulino-resistenza e la transizione verso la sindrome metabolica è agevole. Nelle pazienti PCO-S magre, l’iperandrogenismo e/o l’anovulazione sono in primo piano. La terapia della PCO-S dipende dai sintomi che sono in primo piano.
La malattia si presenta in varie forme, dalla PCO-S lieve e asintomatica alla forma estrema, la sindrome di Stein-Leventhal. Le persone colpite si rivolgono al consultorio per due motivi: per il desiderio insoddisfatto di avere figli (fino al 74%) o per disturbi del ciclo, soprattutto oligo- o amenorrea (fino al 50%), che di solito si verificano durante la pubertà.
Oltre ai sintomi più comuni, tuttavia, ci sono anche quelli più comuni:
- Segni di crescente androgenizzazione
- Cambiamenti di laboratorio con aumento dell’LH e livelli di FSH normali o diminuiti.
- Aumento dei livelli di androgeni
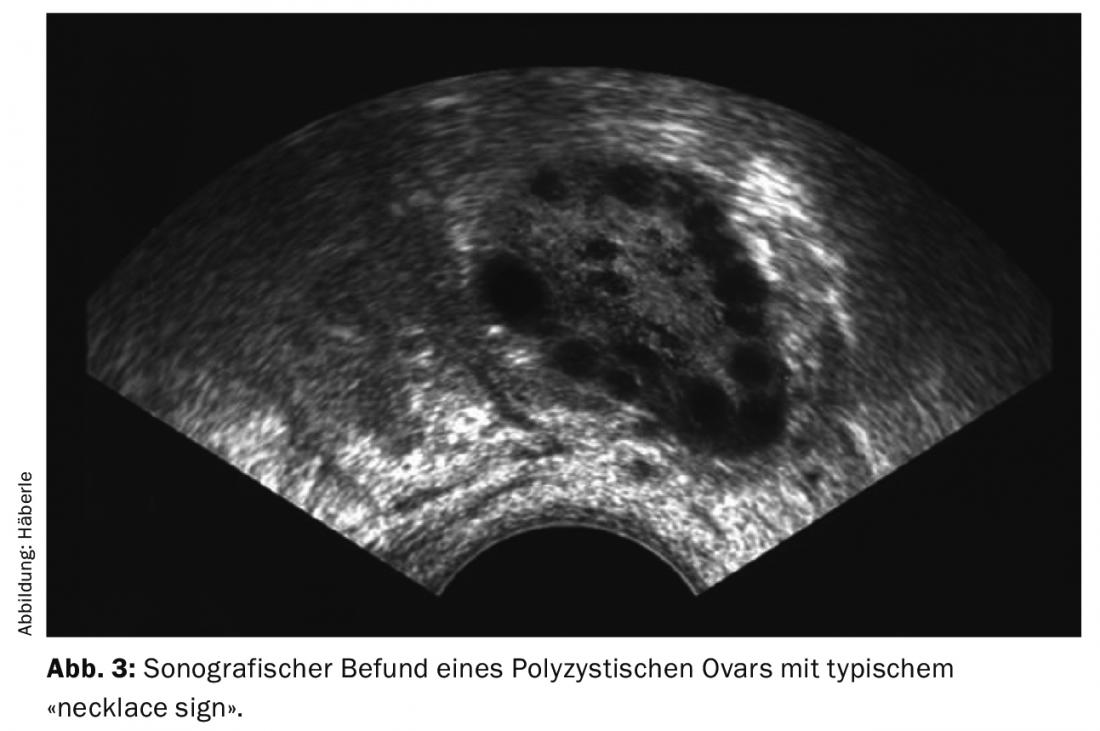
- L’analisi ecografica mostra l’immagine tipica di ovaie ingrossate con numerosi piccoli follicoli disposti a livello sottocorticale come un filo di perle (segno della collana).
Questi segni clinici non devono verificarsi tutti nello stesso momento. Anche i singoli sintomi possono già indicare una malattia.
Se inizialmente la PCO-S era considerata principalmente una sindrome caratterizzata dalla comparsa di androgenizzazione e dal desiderio insoddisfatto di avere figli, oggi sta venendo alla ribalta la sindrome metabolica associata alla PCO-S con le sue conseguenze a lungo termine pericolose per la vita [3]. Pertanto, la diagnosi e la terapia precoci sono di grande importanza per ridurre il successivo aumento del rischio di malattie cardiovascolari, diabete di tipo 2 e carcinoma endometriale.
A causa della sua importanza clinica, la PCO-S non interessa solo i ginecologi e i dermatologi, ma sempre più anche gli internisti. Le cause esatte della PCO-S non sono ancora chiare. Alla luce del clustering familiare e dei risultati degli studi sui gemelli, si presume che le cause genetiche giochino un ruolo. Infatti, sono stati identificati diversi loci genici che si pensa siano associati allo sviluppo della PCOS [4].
Patogenesi della PCO-S
Gli androgeni femminili sono prodotti in proporzioni diverse nella corteccia surrenale e nelle ovaie. La produzione di testosterone nella corteccia surrenale e nelle ovaie è regolata dal rilascio di ormoni da parte dell’ipofisi. Il cortisolo e l’estradiolo provocano un feedback negativo inibendo il rilascio degli ormoni rilascianti (Fig. 1).
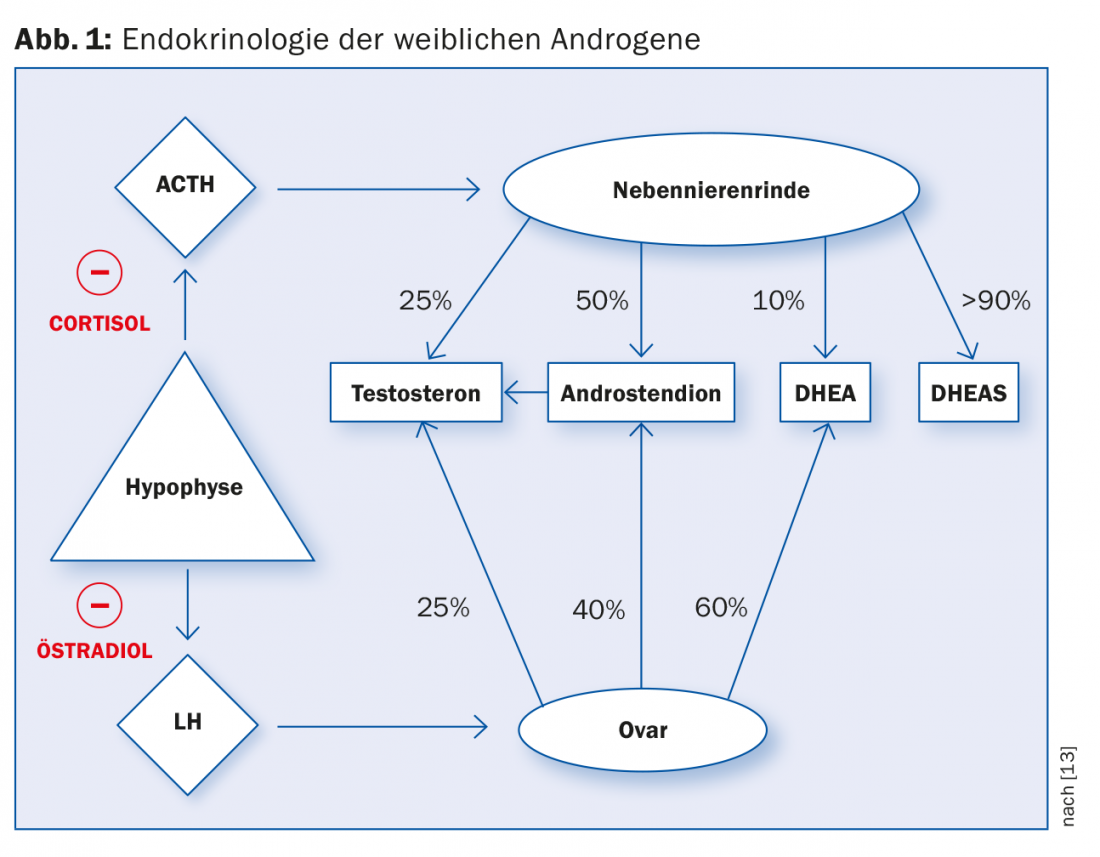
In linea di principio, si presume che la PCO-S sia causata da un disturbo del circuito regolatore endocrino ipotalamo-ipofisi-ovaio. Probabilmente c’è una mancanza di attività delle aromatasi nelle cellule della granulosa dell’ovaio, che sono stimolate dall’FSH nelle donne sane. L’ispessimento ialino della membrana basale porta all’inibizione dell’azione dell’FSH, per cui le cellule della granulosa degenerano a causa di una stimolazione inadeguata. Allo stesso tempo, la biosintesi steroidea nell’ovaio viene interrotta a causa della continua stimolazione gonadotropica da parte dell’LH, per cui vengono prodotti più androgeni. L’ipotiroidismo subclinico si riscontra nel 10-25% dei pazienti. Il collegamento e l’influenza sul circuito regolatorio ipofisario-ovarico non sono ancora chiari [5].
Misure diagnostiche
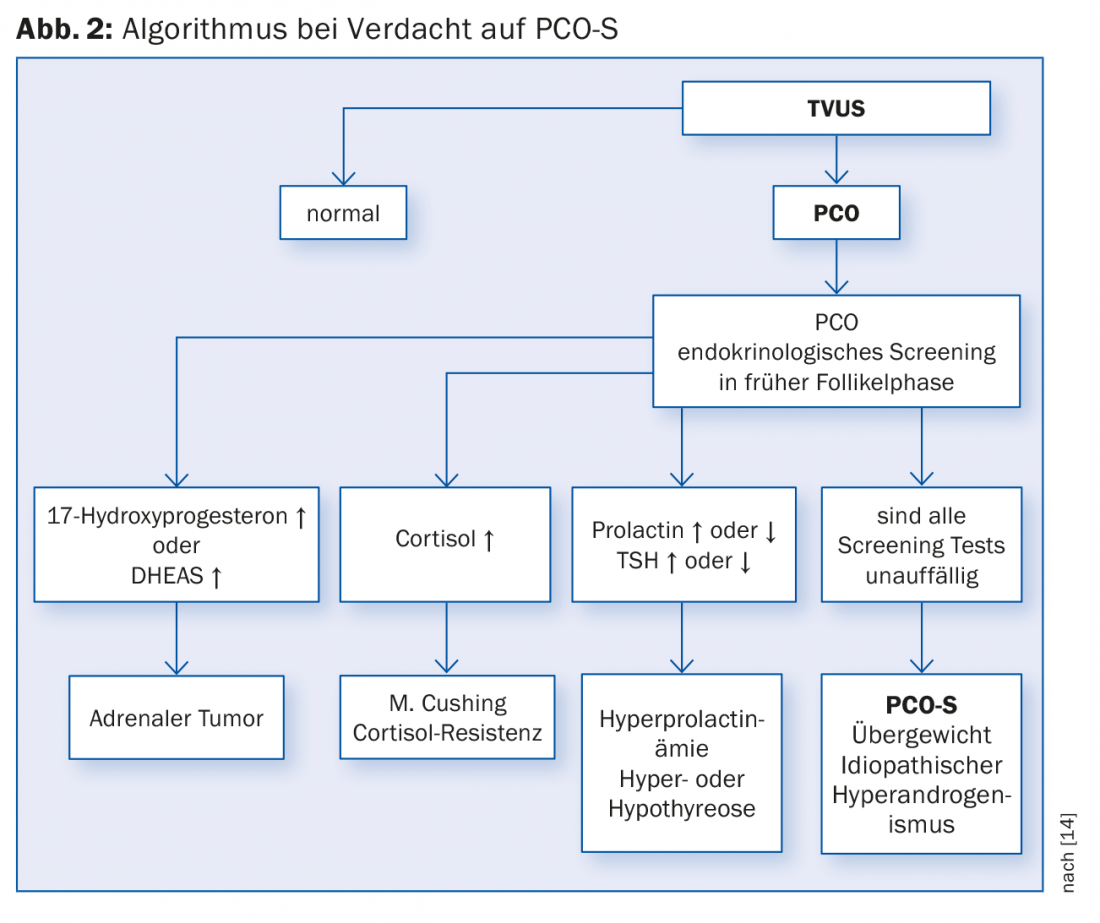
Oltre ai sintomi più comuni di sterilità e oligo-risposta. L’amenorrea fa parte della conferma della diagnosi (vedere anche Fig. 2):
- Un’anamnesi approfondita su menarca, ciclo mestruale, storia familiare.
- Esame clinico con particolare attenzione alla crescente androgenizzazione con irsutismo fino al 70%, acne fino al 35%, alopecia, obesità fino all’85% (BMI).
- Valutazione ormonale nella fase follicolare precoce, a digiuno con determinazione di: LH, FSH, prolattina, estrone (E1), estradiolo (E2), SHBG (globulina legante gli ormoni sessuali), DHEA (deidroepiandrosterone), DHEA-S (deidroepiandrosterone solfato), 17-alfa-OH-progesterone, cortisolo, TSH, testosterone, androstenedione.
- L’ecografia transvaginale mostra ovaie ingrossate con numerosi piccoli follicoli.
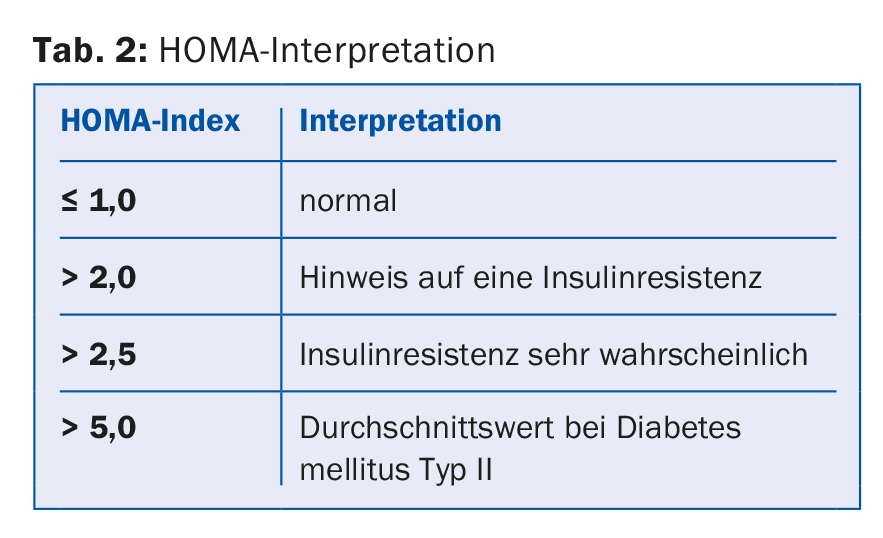
- Se si sospetta una sindrome metabolica, è necessario indagare anche la resistenza all’insulina. Glucosio a digiuno, insulina a digiuno, calcolo del punteggio HOMA (Homeostasis Model Assessment), determinazione di LDL, HDL e trigliceridi, pressione sanguigna.
ad 1) Circa l’80% dei pazienti riferisce disturbi mestruali, per lo più oligo- o amenorrea fino al 50% ciascuno, che di solito si verificano durante la pubertà. È importante chiedere l’età del menarca e il successivo andamento del ciclo, poiché l’iperandrogenismo spesso porta all’anovulazione cronica o all’amenorrea secondaria precoce. Chieda anche informazioni su altri membri della famiglia che hanno sofferto di acne o irsutismo.
ad 2) Nell’esame clinico, l’irsutismo viene registrato mediante il Ferriman and Gallwey Score [6].
ad 3) La chiarificazione ormonale rivela un aumento dei valori di LH e di FSH normali o diminuiti. Questo perché l’LH viene rilasciato in modo pulsatile dall’ipofisi anteriore in risposta al rilascio pulsatile di GnRH (ormone di rilascio delle gonadotropine) dall’ipotalamo. Anche l’androstenedione, il testosterone e, un po’ meno frequentemente, il DHEA sono elevati. Allo stesso modo, i livelli di estrone (E1) sono elevati rispetto ai livelli di estradiolo (E2) nella fase follicolare iniziale [7]. Nelle donne con irsutismo, è necessario misurare prima il testosterone libero. Se si sospetta un tumore surrenalico, si devono misurare anche il DHEA e il DHEA-S.
Risultati ormonali tipici nella PCO-S:
- Androgeni borderline alti o elevati (testosterone, androstenedione, DHEAS)
- Aumento del quoziente LH/FSH (cioè FSH nell’intervallo normale) > 1.0 all’inizio del ciclo
- Diminuzione della SHBG
ad 4) Questi segni clinici non devono manifestarsi tutti contemporaneamente. La comparsa di singoli sintomi può già indicare una malattia. A causa dell’eterogeneità di questo quadro clinico, a volte è difficile fare una diagnosi certa. Pertanto, diversi gruppi hanno sviluppato diversi criteri diagnostici. Nel 2012, un workshop del National Institute of Health (NIH) ha analizzato i diversi criteri diagnostici e ha raccomandato che la diagnosi di PCO-S sia fatta secondo i criteri di Rotterdam [8]. I criteri di Rotterdam sono il risultato di una riunione di consenso internazionale tenutasi a Rotterdam nel 2003 [9].

La diagnosi di ovaie policistiche (PCO) viene fatta ecograficamente (preferibilmente mediante ecografia vaginale) (Fig. 3). Secondo la definizione attuale (criteri di Rotterdam), 12 o più follicoli di 2-9 mm per ovaio e/o una dimensione ovarica di >10 ml (volume ovarico = 0,5 × lunghezza × larghezza × spessore) sono considerati policistici. Per la diagnosi, è sufficiente che un’ovaia soddisfi i criteri. Quando si assumono gli inibitori dell’ovulazione, le ovaie non possono essere valutate a questo proposito.
ad 5) Se si sospetta una sindrome metabolica, è necessario chiarire anche la resistenza all’insulina. A tal fine, vengono determinati il glucosio e l’insulina a digiuno e da questi viene calcolato l’indice HOMA. [10] (Tab. 2).
Formula per determinare l’indice HOMA:
Indice HOMA = insulina (a digiuno, µU/ml) × glicemia (a digiuno, mg/dl) / 405
Indice HOMA = insulina (a digiuno, µU/ml) × glicemia (a digiuno, mmol/l) / 22,5
Invece di determinare l’indice HOMA, si può eseguire un test di tolleranza al glucosio orale (oGTT) con 75 g di glucosio. La sindrome metabolica nelle donne obese comprende anche elevati livelli di LDL combinati con bassi livelli di HDL e trigliceridi.
Si sta discutendo se sia necessario determinare anche la concentrazione di ormone anti-mülleriano (AMH) nel siero per confermare la diagnosi. Tuttavia, i dati finora disponibili sono inconcludenti e quindi la determinazione dell’AMH non è ancora raccomandata per l’uso di routine [11]. La diagnosi finale di PCO-S viene fatta dopo aver escluso altre diagnosi differenziali come l’ipotiroidismo primario, l’iperprolattinemia, l’iperplasia surrenale, i tumori che producono androgeni, la sindrome adrenogenitale (AGS) e la malattia di Cushing. È anche importante escludere l’apporto di androgeni esogeni.
Conseguenze a lungo termine sulla salute della PCO-S
Le donne con PCO-S diagnosticata secondo questi criteri sono ad alto rischio per le seguenti malattie concomitanti: I cicli irregolari dovuti all’anovulazione sono per lo più causati dalla mancanza di progesterone, la “controparte” degli estrogeni, che porta a un desiderio insoddisfatto di avere figli. L’obesità comporta un aumento del rischio di sviluppare la sindrome metabolica, il diabete di tipo 2, anche come conseguenza di un’anamnesi familiare positiva di diabete di tipo 2 e di un’attività insulinica difettosa (resistenza all’insulina e disfunzione delle cellule beta). Pertanto, aumenta anche il rischio di ipertensione arteriosa e di malattie cardiovascolari. La combinazione di obesità e iperandrogenismo porta ad un aumento dei livelli di estrogeni a causa dell’aromatizzazione degli androgeni nel tessuto adiposo. Questo aumenta il rischio di sviluppare un tumore dell’endometrio.
Terapia
La PCO-S è molto eterogenea non solo dal punto di vista biochimico, ma anche clinico.
Il trattamento dipende principalmente da ciò che è più importante per il paziente. Inoltre, l’obiettivo a lungo termine è evitare le malattie concomitanti.
Sterilità: l’obiettivo della terapia è l’induzione dell’ovulazione attraverso la stimolazione ormonale. La somministrazione dell’antiestrogeno clomifene (che deve essere ordinato in Svizzera presso una farmacia internazionale) è il trattamento di prima scelta. I pazienti che manifestano iperprolattinemia devono essere trattati con bromocriptina o cabegolina. I glucocorticoidi devono essere somministrati ai pazienti con una componente surrenale con livelli elevati di DHEA-S prima della stimolazione con clomifene. Le gonadotropine, come la gonadotropina umana della menopausa (HMG) o l’FSH, devono essere utilizzate solo in caso di resistenza alla terapia. In questi casi, a volte è utile anche un pre-trattamento con un agonista del GnRH prima della terapia con gonadotropine, che aumenta il successo della terapia [12]. Questa forma di terapia deve essere eseguita solo da medici esperti che monitorano attentamente la crescita follicolare con gli ultrasuoni. Nelle pazienti PCO-S, un piccolo dosaggio è talvolta sufficiente per stimolare la crescita dei numerosi follicoli, nonostante l’assenza spontanea di ovulazione. Questo può portare alla sindrome da iperstimolazione e, di conseguenza, a gravidanze multiple di ordine superiore.
Una procedura chirurgica come la resezione bilaterale del cuneo ovarico o la distruzione del tessuto ovarico con elettrocoagulazione deve essere intrapresa solo come “ultima ratio”. Non è ancora stato dimostrato che dopo tale terapia si verifica un ciclo regolare. Inoltre, a seguito di tali operazioni possono verificarsi delle aderenze, che possono ostacolare il concepimento. Dopo una terapia conservativa infruttuosa di sei mesi con stimolazione ormonale con o senza inseminazione, è indicata la FIV/ICSI.
Obesità e sindrome metabolica con resistenza all’insulina: la prima misura terapeutica è la riduzione dell’IMC attraverso un cambiamento dello stile di vita con attività fisica regolare, supportata da una consulenza nutrizionale. Se queste misure non portano al successo, la chirurgia bariatrica può portare all’obiettivo. La perdita di peso corregge praticamente tutti i parametri patologici della PCO-S e può quindi portare a un ciclo ovulatorio. Già una riduzione del peso dal 5 al 10% migliora l’irsutismo in circa il 50% dei pazienti entro sei mesi.
Metformina (2 × 500 mg fino a 3 × 850 mg di metformina/giorno, massimo. a 2500 mg/die), un derivato biguanide e un farmaco antidiabetico, migliora la possibilità di ritorno dei cicli ovulatori normali, riducendo la secrezione di androgeni ovarici. La metformina può essere combinata con gli inibitori dell’ovulazione senza problemi. Viene utilizzato in modo sempre più generoso per tutte le forme di PCO-S.
Acne e irsutismo: gli antiandrogeni ciclici (ad esempio, il ciproterone acetato) come i progestinici, i contraccettivi orali, che da un lato causano un ridotto rilascio di androgeni ovarici e dall’altro un aumento della concentrazione periferica di SHBG, aiutano in questo caso. Questo spesso porta a una riduzione dell’attività degli androgeni periferici. In circa il 60% dei pazienti, l’acne non è più rilevabile dopo sei mesi di trattamento. I glucocorticoidi sono utilizzati nei pazienti con un’aumentata produzione di androgeni surrenali.
Letteratura:
- Azziz R, Woods KS, Reyna R, et al: La prevalenza e le caratteristiche della sindrome dell’ovaio policistico in una popolazione non selezionata. J Clin Endocrinol Metab. 2004; 89(6): 2745.
- Ehrmann DA: Sindrome dell’ovaio policistico. N Engl J Med 2005 24 marzo; 352(12): 1223-36.
- Comitato di scrittura sulla sindrome dell’ovaio policistico dell’American Association of Clinical Endocrinologists. Associazione Americana degli Endocrinologi Clinici Presa di posizione sulle conseguenze metaboliche e cardiovascolari della sindrome dell’ovaio policistico. Endocr Practice. 2005 Mar-Apr; 11(2): 126-34.
- World CK, Duran JM: Genetica della sindrome dell’ovaio policistico. Semin Reprod Med. 2014 maggio; 32(3): 177-82.
- Pergialiotis V, et al: Gestione della malattia endocrina: l’impatto dell’ipotiroidismo subclinico sulle caratteristiche antropometriche, sui lipidi, sul glucosio e sul profilo ormonale delle pazienti PCOS: una revisione sistematica e una meta-analisi. Eur J Endocrinol. 2017 Mar;176(3): R159-R166.
- Hatch R, Rosenfield RL, et al: Irsutismo: implicazioni, eziologia e gestione. Am J Obstet Gynecol. 1981 Aug 1;140(7): 815-30.
- Rebar R, Judd HL, et al: Caratterizzazione della secrezione inappropriata di gonadotropine nella sindrome dell’ovaio policistico. J Clin Invest. 1976 maggio; 57(5):1320-9.
- NIH. Sindrome dell’ovaio policistico (PCOS) – Risorse. http://prevention.nih.gov/workshops/2012/pcos/resources.aspx (consultato il 19 marzo 2013).
- Gruppo di lavoro di consenso sulla PCOS sponsorizzato da Rotterdam ESHRE/ASRM. Consenso rivisto del 2003 sui criteri diagnostici e sui rischi per la salute a lungo termine legati alla sindrome dell’ovaio policistico (PCOS). Hum Reprod 2004; 19: 41.
- Carmina E, Lobo RA: Uso del sangue a digiuno per valutare la prevalenza dell’insulino-resistenza nelle donne con sindrome dell’ovaio policistico. Fertile Sterile. 2004 Sep; 82(3): 661-5.
- Eilertsen TB, Vanky, et al: Ormone antimulleriano nella diagnosi della sindrome dell’ovaio policistico: la descrizione morfologica può essere sostituita? Hum Reprod. 2012 Aug; 27(8): 2494-502.
- Filicori M, Valdiserri A, et al.: Induzione dell’ovulazione con ormone di rilascio della gonadotropina pulsatile: modalità tecniche e prospettive cliniche. Fertil Steril 56: 1, 1991.
- Da Burger HG: Fertil Steril. 2002; 77 Suppl 4): S3-S5 e Simon JA: Fertil Steril.2002; 77(Suppl 4): 77-82) e Brand JS et al: Int J Impot Res. 2010; 22(2): 91-104.
- Da Buggs C, Rosenfield RL: Sindrome dell’ovaio policistico nell’adolescenza. Endocrinol Metab Clin North Am 2005; 34: 677.
PRATICA GP 2017; 12(3): 28-32










