Solo il 5-10% dei pazienti con ipertensione ha un’ipertensione secondaria. Nei pazienti giovani (<30 anni) raccomandiamo lo screening, poiché la cura dell’ipertensione può essere ottenuta trattando la causa. A causa della natura costosa e lunga dello screening, raccomandiamo che questo venga effettuato solo in casi selezionati. La pseudo-resistenza deve essere esclusa prima dello screening con la misurazione ambulatoriale della pressione arteriosa nelle 24 ore. Le cause più comuni di ipertensione secondaria sono l’apnea ostruttiva del sonno, la malattia parenchimale renale, la malattia renovascolare e l’iperaldosteronismo primario.
L’ipertensione secondaria è definita come un’elevata pressione sanguigna sistemica (BP) dovuta a una causa identificabile. La prevalenza dell’ipertensione secondaria varia a seconda della popolazione di pazienti studiata e dell’intensità della diagnosi. Tuttavia, il 90-95% di tutti i pazienti con ipertensione arteriosa presenta una forma essenziale (idiopatica o primaria) [1]. Pertanto, al fine di migliorare il rapporto costo-efficacia, non tutti i pazienti con pressione elevata dovrebbero essere sottoposti a uno screening per le forme secondarie attraverso uno screening elaborato e costoso. Nei pazienti giovani, nell’ipertensione refrattaria alla terapia o nei pazienti che non hanno una storia familiare di ipertensione arteriosa, la probabilità di presenza di ipertensione secondaria è significativamente più alta. L’identificazione precoce e la terapia specifica dell’ipertensione secondaria possono, nel migliore dei casi, ma raramente, portare alla normalizzazione della pressione arteriosa o più spesso a una migliore risposta alla terapia farmacologica, liberando così il paziente da molti anni di polimedicazione.
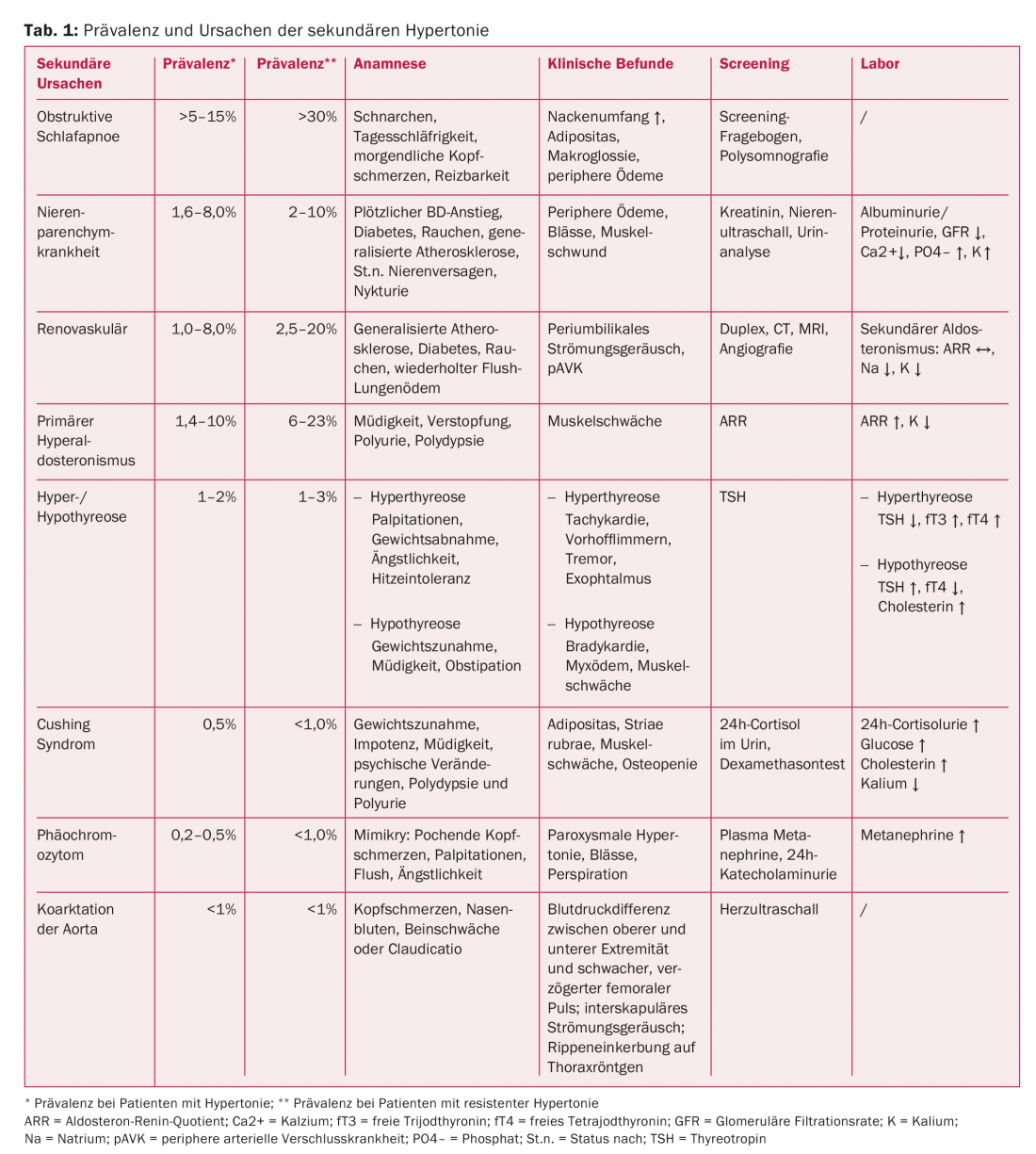
L’ipertensione arteriosa è il fattore di rischio cardiovascolare più comune e importante negli adulti, con una prevalenza crescente con l’età. Oltre il 50% della popolazione tra i 55 e i 64 anni soffre di ipertensione arteriosa [2,3]. Solo il 5-10% dei pazienti ha una causa identificabile. La prevalenza dell’ipertensione secondaria varia a seconda della popolazione di pazienti studiata e del metodo di screening utilizzato per identificare una causa [4–7]. Nei pazienti con ipertensione refrattaria (resistente), la prevalenza di una causa secondaria è significativamente più alta rispetto ai pazienti con pressione ben controllata (Tab. 1) [8]. L’ipertensione resistente si verifica quando la pressione arteriosa è elevata nonostante l’uso di tre antipertensivi, compreso un diuretico tiazidico a dosi ottimali.
Chi dovrebbe essere esaminato?
Gli indizi clinici generali che indicano la presenza di una forma secondaria di ipertensione sono elencati nella tabella 2.
Età: l ‘ipertensione nei bambini in età prepuberale è solitamente dovuta a una malattia renale (renoparenchimatosa o renovascolare) o alla coartazione dell’aorta [9]. I giovani adulti (<30 anni) senza storia familiare o altri fattori di rischio dovrebbero essere sottoposti a screening.
L’habitus: i pazienti in sovrappeso con ipertensione resistente devono essere sottoposti a screening per l’apnea ostruttiva del sonno (OSA), la causa secondaria più comune negli adulti [10], e l’ipercortisolismo/ipotiroidismo.
Pressione arteriosa: i pazienti con ipertensione resistente, ipertensione grave alla presentazione iniziale (>180/110 mmHg), emergenze ipertensive [5], assenza di calo notturno della pressione (“dipping”) di >10% rispetto al valore diurno durante la misurazione ambulatoriale della pressione arteriosa nelle 24 ore (ABPM) o aumento della pressione notturna (“reverse dipper”) [11,12] necessitano di chiarimenti.
Aterosclerosi generalizzata: solo circa il 15-30% dei pazienti con ipertensione arteriosa e aterosclerosi diffusa presenta una stenosi significativa dell’arteria renale (definita come ≥50%) [13,14]. Altre indicazioni includono l’ipertensione resistente, un aumento improvviso della pressione arteriosa in un’ipertensione precedentemente ben controllata, l’ipertensione grave o il mancato calo.

Cosa deve essere escluso prima dello screening?
La pseudo-resistenza deve essere esclusa prima di iniziare lo screening [8]. Le cause comuni sono:
Misurazione inadeguata della pressione arteriosa: il paziente non è rimasto seduto per cinque minuti prima o è stata scelta una misura di bracciale non corretta; una misura troppo piccola può portare a valori di pressione erroneamente elevati [15].
Controllo insufficiente del trattamento: da un lato, i medici controllano troppo poco la terapia (“inerzia terapeutica”), poiché non sono consapevoli che l’ipertensione deve essere trattata in modo coerente [16]. Ciò significa che la terapia non è adattata ai valori target della BP secondo le linee guida.
Mancanza di aderenza al trattamento: d’altra parte, i pazienti mostrano un’aderenza insufficiente, con solo il 40% che continua a seguire il trattamento prescritto dopo dieci anni di follow-up [17]. Nel 50% dei pazienti con ipertensione resistente, l’analisi delle urine può mostrare che non hanno assunto i farmaci come prescritto [18]. In molti pazienti con ipertensione resistente, la pressione arteriosa si normalizza non appena si monitora l’aderenza o si somministrano i farmaci tramite un dosatore elettronico [19]. Sono state discusse diverse strategie di miglioramento, come la misurazione della concentrazione del farmaco nel sangue/urina, il dosatore elettronico o i programmi di supporto. Un’opzione semplice è anche quella di assumere il farmaco sotto supervisione e poi eseguire una misurazione della pressione arteriosa 24 ore su 24 [20].
Ipertensione da camice bianco: si tratta di una pressione arteriosa >140/90 mmHg, mentre i valori della pressione arteriosa nell’ABPM sono nell’intervallo normale. Questa è una causa comune di pseudo-resistenza ed è presente fino al 30% dei pazienti con una pressione elevata nella pratica [21]. Pertanto, l’ABPM delle 24 ore deve essere eseguito in tutti i pazienti con sospetta ipertensione secondaria.
Ipertensione indotta da farmaci: farmaci come i FANS, i glucocorticoidi, i soppressori dell’appetito, gli stimolanti, i decongestionanti della mucosa o la liquirizia possono portare alla resistenza al trattamento [22,23].
Esiste anche una pseudo-ipertensione, definita come una differenza di 15 mmHg nella pressione diastolica tra la misurazione del bracciale e la misurazione intra-arteriosa simultanea [61]. Questo può essere riscontrato a causa dei vasi calcificati e rigidi nei pazienti anziani con ipertensione arteriosa senza danni agli organi finali [16,20].
Chiarimenti sull’ipertensione secondaria
La diagnostica di base per l’ipertensione comprende l’anamnesi, l’esame fisico, l’analisi del sangue e lo stato delle urine. Questo fornisce già un primo sospetto sulle forme secondarie più comuni di ipertensione. Nella Figura 1, proponiamo un algoritmo diagnostico per le sospette cause secondarie di ipertensione.
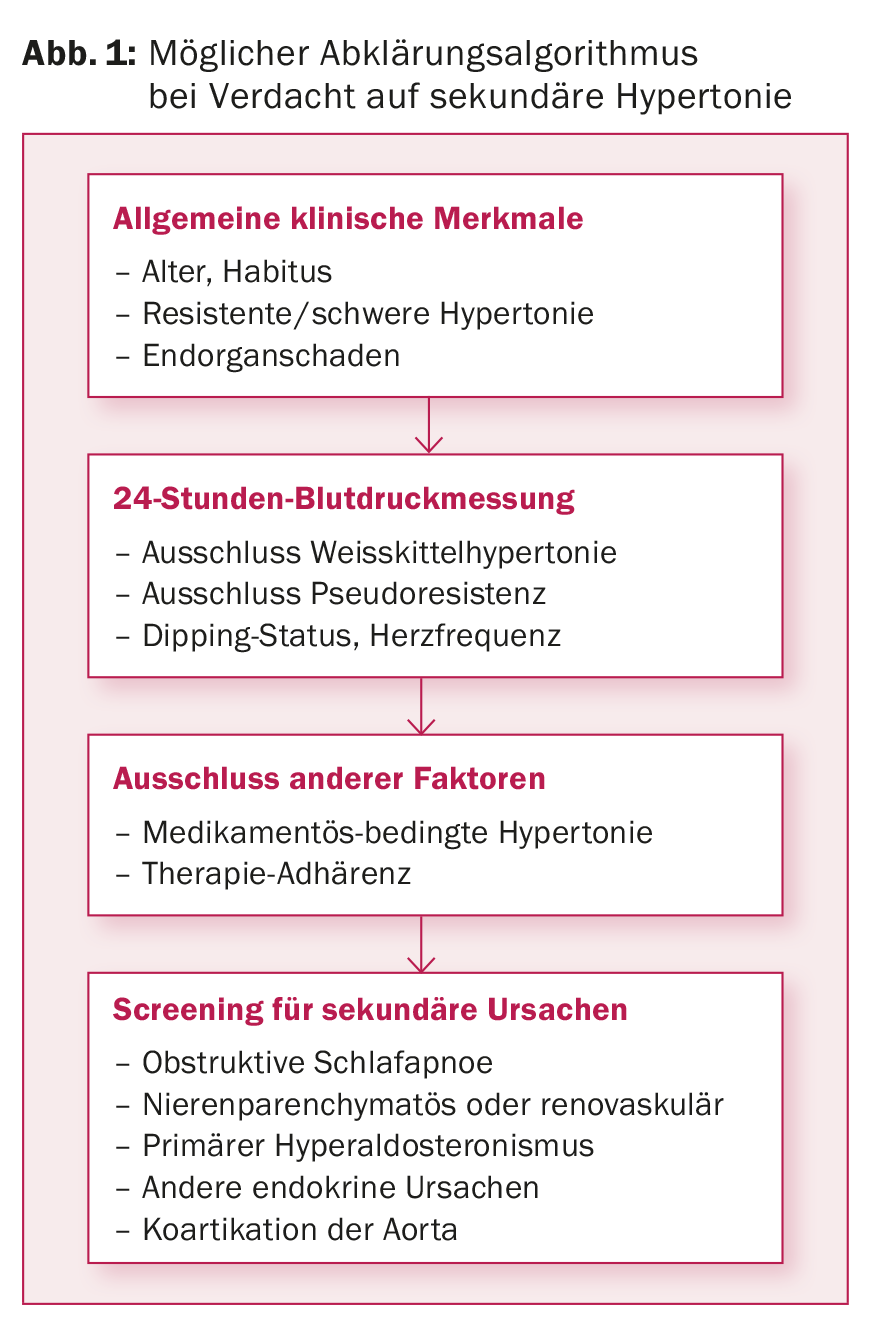
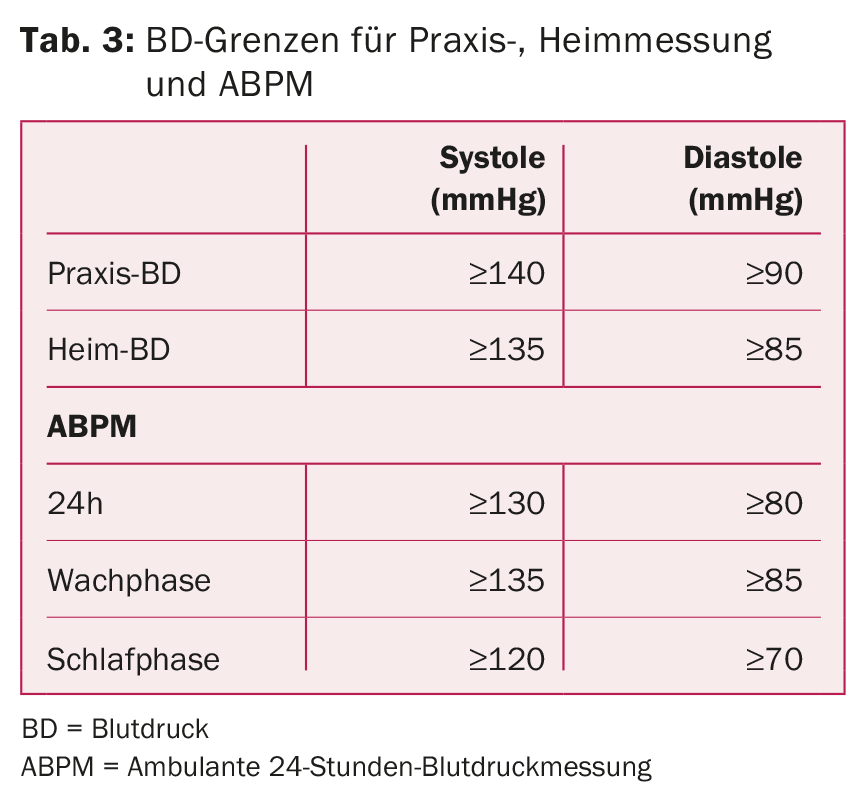
Misurazione ambulatoriale della BP nelle 24 ore: l’ABPM è il gold standard per valutare la BP arteriosa [12]. In questo modo è possibile escludere l’ipertensione da camice bianco, monitorare l’aderenza alla terapia, rilevare la presenza di ipertensione resistente e valutare lo stato di dipping notturno. Il dipping inverso notturno con possibile aumento della frequenza cardiaca indica la presenza di una forma secondaria (ad esempio, OSA, stenosi dell’arteria renale). La tabella 3 elenca i valori target della pressione arteriosa.
Apnea ostruttiva del sonno: questa è la causa più comune di ipertensione secondaria [10,24] ed è classificata come lieve (AHI 5-15/h), moderata (AHI 16-30/h) e grave (AHI>30/h) in base all’indice di apnea-ipopnea (AHI, numero di apnee più ipopnee per ora di sonno). La causa è un collasso delle vie aeree superiori durante il sonno, che provoca apnee e ipopnee ostruttive ricorrenti. I fattori che portano all’aumento della pressione comprendono l’aumento dell’attività simpatica, l’attivazione del sistema renina-aldosterone a causa dell’ipossiemia ripetuta e la disfunzione endoteliale causata dallo stress ossidativo [25–32].
I sintomi tipici e la clinica sono descritti nella Tabella 1 [33]. Se la clinica è appropriata, deve essere eseguita una Epworth Sleepiness Scale [34,35] e con un punteggio ≥10 e un elevato sospetto clinico di OSA deve essere chiarito con una poligrafia o polisonnografia ambulatoriale [36]. La terapia con pressione positiva continua delle vie aeree (CPAP) ha dimostrato di ridurre la BP in diversi studi [37–40].
Malattie del parenchima renale: La malattia parenchimale renale (glomerulare, ad esempio glomerulonefrite, interstiziale, ad esempio malattia policistica del rene o microvascolare) è la causa più comune di ipertensione secondaria nei bambini e la seconda più comune negli adulti [9,41]. Lo screening viene effettuato analizzando l’albuminuria/proteinuria e la creatinina sierica. Se entrambi sono normali, la probabilità di una malattia parenchimale renale significativa è molto bassa. In caso di valori patologici, l’ecografia dei reni è indicata per valutare le dimensioni, la forma, la massa renale e per escludere l’ostruzione delle vie urinarie.
Malattia renale: nei bambini e nei giovani adulti, la displasia fibromuscolare è la causa più comune di ipertensione secondaria e deve essere esclusa da studi di imaging (screening con ecografia duplex, conferma con angiografia). Se la displasia fibromuscolare è confermata, è indicata l’angiografia RM dei vasi cerebrovascolari [42]. Negli adulti, invece, la stenosi arteriosclerotica dell’arteria renale (NAS) è la forma più comune [13], particolarmente diffusa nei pazienti ipertesi con arteriosclerosi generalizzata [43–45]. Le indicazioni cliniche includono il peggioramento della funzione renale con gli inibitori dell’enzima di conversione dell’angiotensina (ACE-inibitori) o con i bloccanti del recettore dell’angiotensina (ARB), l’ipertensione grave o l’innalzamento improvviso della pressione arteriosa, soprattutto nei fumatori, nei diabetici con aterosclerosi diffusa, l’edema polmonare ripetuto [46,47] e un soffio di flusso periromuscolare. Nei pazienti con evidenza della presenza di RAS e probabile risposta favorevole alla rivascolarizzazione (tab. 4), raccomandiamo di eseguire una diagnostica per immagini (ecografia duplex, TC o RM) [48] e, se confermata, di eseguire una misurazione emodinamica per dimostrare un gradiente significativo. Clinicamente, il RAS associato all’ipertensione arteriosa deve essere distinto dal RAS che causa l’ipertensione arteriosa [49]. Più a lungo è stato presente il RAS, meno si può ottenere la normalizzazione della BP dopo la correzione [49].

Iperaldosteronismo primario: è definito come un aumento della produzione di aldosterone indipendente dal sistema renina-angiotensina, che non può essere soppresso dal carico di sodio. La causa è solitamente un adenoma surrenale, un’iperplasia surrenale unilaterale o bilaterale o un iperaldosteronismo dipendente dai glucocorticoidi. L’iperaldosteronismo è sospettato nei pazienti con ipokaliemia ripetuta (ma presente solo nel 40% circa dei pazienti) [50], ipokaliemia eccessiva nonostante piccole dosi di diuretici, ipertensione resistente, debolezza muscolare, costipazione e affaticamento, alcalosi metabolica, eccessiva escrezione di sodio o ipernatriemia concomitante.
Il quoziente aldosterone-renina può essere utilizzato come metodo di screening. Tuttavia, vari fattori come gli antipertensivi possono influenzare questo [51]. La diagnosi deve essere confermata da un test di carico di sodio o da un test di soppressione con captopril [52]. La prima può essere effettuata con una misurazione dell’aldosterone plasmatico prima e dopo l’infusione di 2000 ml di NaCl 0,9% per quattro ore. Una concentrazione di aldosterone <5 ng/dl dopo l’infusione è contraria, una concentrazione di aldosterone >10 ng/dl per l’iperaldosteronismo. Un calo dell’aldosterone plasmatico >30% del valore basale tre ore dopo l’assunzione di 25-50 mg di captopril è suggestivo di iperaldosteronismo secondario (ipertensione essenziale o renovascolare). Per la differenziazione del sottotipo, si raccomanda di eseguire un cateterismo della vena surrenale separato lateralmente, dopo la conferma con la diagnostica per immagini (TAC/MRI). Un adenoma unilaterale può essere operato in modo minimamente invasivo; per le patologie bilaterali, esiste l’opzione di una terapia con antagonisti mineralcorticoidi.
Cause rare di ipertensione secondaria
Sindrome di Cushing: nei pazienti con habitus tipico (obesità, pienezza facciale, collo di toro, irsutismo e strie rubrae) [53,54] deve essere presa in considerazione una sindrome di Cushing. Deve essere effettuato uno screening appropriato, ad esempio con un test di 1 mg di desametasone [55] o un’escrezione di cortisolo nelle 24 ore. Se lo screening è positivo, si consiglia di rivolgersi a un centro specializzato.
Iper/ipotiroidismo: l’ipotiroidismo è indicato dai segni clinici corrispondenti e dalla pressione arteriosa diastolica elevata (bassa produzione e compensazione per mantenere la perfusione mediante vasocostrizione periferica), mentre l’ipertiroidismo è più probabilmente associato a una pressione arteriosa sistolica elevata.
Feocromocitoma: si tratta di una causa molto rara di ipertensione secondaria. Le caratteristiche cliniche sono le cinque P: ipertensione parossistica, palpitazioni, sudorazione, pallore e cefalea pulsante [56]. Lo screening è consigliato nei casi di ipertensione resistente, presentazione clinica appropriata, anamnesi familiare adeguata o tumori surrenalici e può essere effettuato mediante urine di 24 ore di metanefrina/normetanefrina o determinazione delle metanefrine libere nel plasma [57]. In caso di esito positivo, si consiglia di rivolgersi a un centro specializzato.
Coartazione dell’aorta/stenosi dell’istmo aortico: è la seconda causa più comune di ipertensione nei bambini e nei giovani adulti [9,58]. I sintomi tipici sono mal di testa, piedi freddi e dolore alle gambe durante l’attività fisica. I risultati clinici includono pulsazioni femorali deboli, una differenza di pressione arteriosa sistolica tra il braccio destro e la gamba destra e una pressione sistolica. Per lo screening, si consiglia un ecocardiogramma. In questa popolazione, è indicato un rigoroso follow-up a lungo termine anche dopo il trattamento [59,60].
Letteratura:
- Mancia G, et al.: Linee guida ESH/ESC 2013 per la gestione dell’ipertensione arteriosa. La Task Force per la gestione dell’ipertensione arteriosa della Società Europea di Ipertensione (ESH) e della Società Europea di Cardiologia (ESC). European Heart Journal 2013: 34; 2159-2219.
- Roger VL, et al: Statistiche sulle malattie cardiache e l’ictus – aggiornamento 2011: un rapporto dell’American heart association. Circolazione 2011; 123: e18-e209.
- Wolf-Maier K, et al: Prevalenza dell’ipertensione e livelli di pressione sanguigna in 6 Paesi europei, Canada e Stati Uniti. JAMA 2003; 289: 2363-2369.
- Anderson GH, et al.: L’effetto dell’età sulla prevalenza di forme secondarie di ipertensione in 4429 pazienti referenziati consecutivamente. Journal of Hypertension 1994; 12: 609-615.
- Borgel J, et al: Cause secondarie non riconosciute di ipertensione nei pazienti con urgenza/emergenza ipertensiva: prevalenza e co-prevalenza. Ricerca clinica in cardiologia 2010; 99: 499-506.
- Omura M, et al: Studio prospettico sulla prevalenza dell’ipertensione secondaria tra i pazienti ipertesi che visitano un ambulatorio generale in Giappone. Ricerca sull’ipertensione 2004; 27: 193-202.
- Sinclair AM, et al: Ipertensione secondaria in una clinica della pressione. Archivi di Medicina Interna 1987; 147: 1289-1293.
- Calhoun DA, et al: Ipertensione resistente: diagnosi, valutazione e trattamento: una dichiarazione scientifica del comitato di formazione professionale dell’American Heart Association del Consiglio per la ricerca sull’ipertensione. Circolazione 2008; 117: e510-526.
- Arar MY, et al: Eziologia dell’ipertensione sostenuta nei bambini nel sud-ovest degli Stati Uniti. Pediatr Nephrol 1994; 8: 186-189.
- Pedrosa RP, et al: Apnea ostruttiva del sonno: la causa secondaria più comune di ipertensione associata a ipertensione resistente. Ipertensione 2011; 58: 811-817.
- Davies CW, et al: Studio caso-controllo della pressione arteriosa ambulatoriale nelle 24 ore in pazienti con apnea ostruttiva del sonno e soggetti di controllo normali abbinati. Thorax 2000; 55: 736-740.
- Pickering TG, et al: Monitoraggio ambulatoriale della pressione sanguigna. The New England Journal of Medicine 2006; 354: 2368-2374.
- Garovic VD, Textor SC: Ipertensione renale e nefropatia ischemica. Circolazione 2005; 112: 1362-1374.
- Leertouwer TC, et al: Stenosi accidentale dell’arteria renale nella malattia vascolare periferica: un caso da trattare? Kidney International 2001; 59: 1480-1483.
- Pickering TG, et al: Raccomandazioni per la misurazione della pressione arteriosa nell’uomo e negli animali da esperimento: Parte 1: Misurazione della pressione arteriosa nell’uomo: una dichiarazione per i professionisti del sottocomitato per l’educazione professionale e pubblica del Consiglio per la ricerca sull’ipertensione dell’American Heart Association. Circolazione 2005; 111: 697-716.
- Rimoldi SF, et al: Ipertensione arteriosa secondaria: quando, chi e come fare lo screening? European Heart Journal 2014; 35: 1245-1254.
- Van Wijk BL, et al: Tasso e determinanti della persistenza a 10 anni con i farmaci antipertensivi. Journal of Hypertension 2005; 23: 2101-2107.
- Jung O, et al.: Ipertensione resistente? Valutazione dell’aderenza mediante analisi tossicologica delle urine. J Hypertens 2013; 3: 766-774.
- Burnier M, et al: Monitoraggio elettronico della compliance nell’ipertensione resistente: la base per decisioni terapeutiche razionali. J Hypertens 2001; 19: 335-341.
- Rimoldi SF, et al: Ipertensione resistente: cosa deve sapere il cardiologo. European Heart Journal 2015; 36: 2686-2695.
- Verdecchia P, et al.: Ipertensione da camice bianco ed effetto camice bianco. Similitudini e differenze. American Journal of Hypertension 1995; 8: 790-798.
- Grossman E, Messerli FH. Ipertensione indotta da farmaci: una causa non apprezzata di ipertensione secondaria. Am J Med 2012; 125: 14-22.
- Sigurjonsdottir HA, et al: Aumento della pressione sanguigna indotto dal CSF: una relazione lineare dose-risposta. Journal of Human Hypertension 2001; 15: 549-552.
- Logan AG, et al: Alta prevalenza di apnea notturna non riconosciuta nell’ipertensione resistente ai farmaci. Journal of Hypertension 2001; 19: 2271-2277.
- Jurado-Gamez B, et al.: Relazione tra stress ossidativo e disfunzione endoteliale nell’apnea del sonno. Eur Respir J 2011; 37: 873-879.
- Fletcher EC: L’iperattività simpatica nell’eziologia dell’ipertensione dell’apnea ostruttiva del sonno. Sonno 2003; 26: 15-19.
- Leuenberger UA, et al.: Effetti dell’ipossia intermittente sull’attività simpatica e sulla pressione sanguigna negli esseri umani. Auton Neurosci 2005; 121: 87-93.
- Calhoun DA, et al: Escrezione di aldosterone tra i soggetti con ipertensione resistente e sintomi di apnea notturna. Chest 2004; 125: 112-117.
- Goodfriend TL, Calhoun DA: Ipertensione resistente, obesità, apnea notturna e aldosterone: teoria e terapia. Ipertensione 2004; 43: 518-524.
- Ip MS, et al: Funzione endoteliale nell’apnea ostruttiva del sonno e risposta al trattamento. American Journal of Respiratory and Critical Care Medicine 2004; 169: 348-353.
- Rimoldi SF, et al: Disfunzione vascolare sistemica nei pazienti con mal di montagna cronico. Chest 2012; 141: 139-146.
- Bailey DM, et al: Stress ossidativo-nitrosativo e funzione vascolare sistemica negli highlander con e senza ipossiemia esagerata. Chest 2013; 143: 444-451.
- Alonso-Fernandez A, et al.: Disturbi del ritmo cardiaco ed episodi di depressione del segmento st nei pazienti con sindrome di apnea ostruttiva del sonno e i suoi meccanismi. Chest 2005; 127: 15-
- Johns MW: Un nuovo metodo per misurare la sonnolenza diurna: la scala Epworth-sonnolenza. Sonno 1991; 14: 540-545.
- Johns MW: Sonnolenza diurna, russamento e apnea ostruttiva del sonno. La scala Epworth della sonnolenza. Chest 1993; 103: 30-36.
- Thurnheer R, et al.: Poligrafia respiratoria nella diagnosi dell’apnea del sonno. Rapporto del registro svizzero di poligrafia respiratoria e revisione sistematica della letteratura. Swiss Med Weekly 2007; 137: 97-102.
- Pepperell JC, et al: Pressione arteriosa ambulatoriale dopo la pressione positiva nasale continua terapeutica e subterapeutica per l’apnea ostruttiva del sonno: uno studio randomizzato parallelo. Lancet 2002; 359: 204-210.
- Becker HF, et al: Effetto del trattamento con pressione positiva nasale continua delle vie aeree sulla pressione sanguigna nei pazienti con apnea ostruttiva del sonno. Circolazione 2003; 107: 68-73.
- Logan AG, et al. Ipertensione refrattaria e apnea del sonno: effetto della cpap sulla pressione sanguigna e sul barorefl ex. Eur Respir J 2003; 21: 241-247.
- Suzuki M, et al: la somministrazione a lungo termine della pressione positiva nasale continua delle vie aeree può normalizzare l’ipertensione nei pazienti con apnea ostruttiva del sonno. Sonno 1993; 16: 545-549.
- Whaley-Connell AT, et al: Ckd negli Stati Uniti: Kidney early evaluation program (keep) e national health and nutrition examination survey (nhanes) 1999-2004. American Journal of Kidney Diseases 2008; 51: S13-20.
- Slovut DP, Olin JW: Displasia fibromuscolare. The New England Journal of Medicine 2004; 350: 1862-1871.
- Kalra PA, et al: Malattia renovascolare aterosclerotica in pazienti statunitensi di età pari o superiore a 67 anni: Fattori di rischio, rivascolarizzazione e prognosi. Kidney International 2005; 68: 293-301.
- Rimoldi SF, et al: Angiografia di screening dell’arteria renale nei pazienti ipertesi sottoposti ad angiografia coronarica e follow-up a 6 mesi dopo una rivascolarizzazione percutanea ad hoc. Journal of Hypertension 2010; 28: 842-847.
- Textor SC, Lerman L: Ipertensione renale e nefropatia ischemica. American Journal of Hypertension 2010; 23: 1159-1169.
- Messerli FH, et al.: Edema polmonare flash e stenosi bilaterale dell’arteria renale: la sindrome di Pickering. European Heart Journal 2011; 32: 2231-2235.
- Rimoldi SF, et al: Edema polmonare flash. Progressi nelle malattie cardiovascolari 2009; 52: 249-259.
- Baumgartner I, Lerman LO. Ipertensione renale: screening e gestione moderna. European Heart Journal 2011; 32: 1590-1598.
- Bavishi C, et al. Stenosi aterosclerotica dell’arteria renale e ipertensione: pragmatismo, insidie e prospettive. Am J Med 2016; 129(6): 635.e5-635.e14.
- Mulatero P, et al: Aumento della diagnosi di aldosteronismo primario, comprese le forme correggibili chirurgicamente, nei centri di cinque continenti. Il Journal of Clinical Endocrinology and Metabolism 2004; 89: 1045-1050.
- Funder JW, et al: Individuazione dei casi, diagnosi e trattamento dei pazienti con aldosteronismo primario: una linea guida di pratica clinica della Società endocrina. Il Journal of Clinical Endocrinology and Metabolism 2008; 93: 3266-3281.
- Mulatero P, et al: Confronto tra i test confirmativi per la diagnosi di aldosteronismo primario. Il Journal of Clinical Endocrinology and Metabolism 2006; 91: 2618-2623.
- Newell-Price J, et al: Sindrome di Cushing. Lancet 2006; 367: 1605-1617.
- Nieman LK, et al: La diagnosi della sindrome di Cushing: una linea guida di pratica clinica della Società endocrina. Il Journal of Clinical Endocrinology and Metabolism 2008; 93: 1526-1540.
- Findling JW, et al: The Journal of Clinical Endocrinology and Metabolism 2004; 89: 1222-1226.
- Young WF, Jr: Cause surrenali di ipertensione: feocromocitoma e aldosteronismo primario. Reviews in Endocrine & Metabolic Disorders 2007; 8: 309-320.
- Singh RJ: I progressi del test della metanefrina per la diagnosi del feocromocitoma. Clinics in Laboratory Medicine 2004; 24: 85-103.
- Prisant LM, et al: Coartazione dell’aorta: una causa secondaria di ipertensione. J Clin Hypertens (Greenwich) 2004; 6: 347-350, 352.
- Weber HS, et al: Lo stenting endovascolare per la coartazione nativa dell’aorta è un’alternativa efficace all’intervento chirurgico nei bambini più grandi. Malattie cardiache congenite 2008; 3: 54-59.
- Stewart AB, et al: Coartazione dell’aorta vita e salute 20-44 anni dopo la riparazione chirurgica. British Heart Journal 1993; 69: 65-70.
CARDIOVASC 2016; 15(5): 24-28
PRATICA GP 2017; 12(1): 18-23