Le terapie sistemiche per la psoriasi sono cambiate molto negli ultimi anni. In passato, venivano utilizzate soprattutto la terapia della luce o le terapie sistemiche convenzionali, come il metotrexato, l’acitretina, la ciclosporina A e gli esteri dell’acido fumarico. Oggi, questi sono sempre più sostituiti nel corso della terapia dal trattamento con i più recenti biologici e il gruppo di piccole molecole.
In base alla loro importanza nell’innescare i focolai della malattia, i fattori precipitanti della psoriasi devono essere sistematicamente eliminati: Innanzitutto, si tratta di infezioni, stress, farmaci e cura della pelle inadeguata.
Oltre alle infezioni streptococciche, che sono spesso ritenute la causa, anche lo stress psicologico è considerato un importante fattore di provocazione, soprattutto nell’infanzia e nell’adolescenza. I giovani soffrono più spesso di stigmatizzazione, che può portare a situazioni di conflitto psicosociale importanti, soprattutto durante la pubertà. I giovani hanno la stessa perdita di qualità della vita a causa della psoriasi e dell’acne.
Anche farmaci come i β2-bloccanti, gli ACE-inibitori, gli antimalarici, il litio e i FANS possono provocare la psoriasi, per cui è importante un’anamnesi farmacologica approfondita.
Infine, ma non meno importante, bisogna prendersi cura della pelle anche quando non c’è la comparsa o l’espressione minima di una malattia. L’uso regolare di preparati per la cura della pelle non solo aiuta a ripristinare la funzione di barriera disturbata della pelle, ma ha anche lo scopo di prevenire la comparsa di nuovi sintomi cutanei dovuti all’irritazione, come la disidratazione (bagni o docce frequenti, permanenza in ambienti riscaldati con bassa umidità). Pertanto, la pelle deve essere curata quotidianamente con prodotti appropriati.
Serie complete di trattamenti per la pelle sviluppate appositamente per i pazienti affetti da psoriasi (ad esempio, Aqeo®), ma anche formulazioni dermatologiche comprovate o altri prodotti per la cura della pelle sono adatti per la cura quotidiana della pelle, a condizione che siano ben tollerati dal paziente.
Terapia topica
Per le placche desquamanti infiltrate, è utile innanzitutto una terapia decalcificante con cheratolitici, non da ultimo per migliorare la penetrazione degli agenti attivi. In questo caso si consiglia di utilizzare l’acido salicilico in concentrazioni comprese tra il 5 e il 10%, a seconda della localizzazione, in una base di vaselina, carbowax o olio. Altri cheratolitici sono l’urea, l’acido lattico e lo zolfo colloidale.
Mentre l’acido salicilico viene utilizzato essenzialmente per rimuovere la forfora, l’urea (in concentrazioni comprese tra l’8 e il 12%), l’acido lattico (2,5-10%) e lo zolfo sono adatti per la cura e il trattamento sotto forma di additivi in creme, lozioni o bagni di olio di zolfo.
Nei bambini di età inferiore ai 12 anni, l’applicazione locale su vasta scala di preparati topici contenenti acido salicilico può portare a una tossicità da riassorbimento (salicilismo) con danni al sistema nervoso centrale e ai reni. Pertanto, l’uso di creme emulsionanti come Unguentum emulsificans aquosum, se necessario con l’aggiunta di urea (5%), è consigliato per la desquamazione nei bambini.
Una volta desquamate le placche, si utilizzano i corticosteroidi topici. Questi sono tra i terapici locali più comunemente utilizzati per la psoriasi. Sono caratterizzati da un’ottima efficacia e tollerabilità, nonché – se usati correttamente – da bassi effetti indesiderati, con un rapporto prezzo-prestazioni relativamente favorevole.
La valutazione negativa del cortisone nella popolazione non ha alcuna base medico-dermatologica. Solo se la durata della terapia è troppo lunga (terapia ininterrotta per più di sei settimane) si verifica l’atrofia cutanea, anche se in molti casi può essere irreversibile. In genere, gli steroidi di classe III-IV che sono sia antinfiammatori che antiproliferativi, come il clobetasolo dipropionato (Dermovate®), il betametasone (Betnovate®) o, soprattutto nei bambini, il mometasone furoato (Elocom®) sono ben efficaci, preferibilmente in combinazione con analoghi topici della vitamina D, come il calcipotriolo (Daivobet®), il tacalcitolo (Curatoderm®) e il calcitriolo (Silkis®). Sono anche disponibili in combinazioni fisse di betametasone e calcipotriolo, sia per l’applicazione cutanea (Daivobet®) che per il cuoio capelluto (Xamiol®) [1]. Per i focolai localizzati, i corticosteroidi possono anche essere applicati in modo occlusivo per migliorare l’efficacia, ad esempio sotto forma di cerotto (Betesil®).
In linea di principio, la terapia ininterrotta con corticosteroidi oltre un mese non è raccomandata, da un lato a causa dell’atrofia e di altri effetti collaterali cutanei, dall’altro a causa dell’assorbimento e del rischio di atrofia della corteccia surrenale. In alternativa ai preparati corticosteroidi, gli inibitori topici della calcineurina tacrolimus o pimecrolimus (Protopic®, Elidel®) sono adatti nelle aree intertriginose (psoriasi inversa).
Fototerapia
La fototerapia è molto apprezzata nel trattamento della psoriasi moderata e grave. È facile da usare, esteticamente accettabile, non molto costoso ed economico. Infine, può essere vantaggiosamente combinato con i trattamenti topici. Oggi si utilizzano soprattutto lampade UVB che emettono 311 nm [2]. I raggi UVA a lunghezza d’onda maggiore possono anche essere molto efficaci in combinazione con psoraleni e retinoidi fotosensibilizzanti [3].
Terapia sistemica
Le terapie sistemiche sono indicate per i casi da moderati a gravi di psoriasi che non possono essere adeguatamente controllati con misure locali e fototerapia, e per l’artrite psoriasica. Viene fatta una distinzione tra le terapie sistemiche standard con metotrexato, acitretina, ciclosporina A e gli esteri dell’acido fumarico e il trattamento con i biologici più recenti.
Il metotrexato (MTX) è un’opzione conveniente con prospettive limitate a lungo termine. Dosaggio basso (da 7,5 a massimo). 30 mg/settimana), l’MTX mostra un effetto particolarmente buono in tutte le forme pustolose di psoriasi, nell’eritroderma psoriatico e nell’artrite psoriasica, ma anche nella psoriasi estesa a placche. Il MTX ha un effetto antiproliferativo e antinfiammatorio inibendo l’enzima diidrofolato reduttasi, impedendo così la formazione dell’importante metabolita acido tetraidrofolico dall’acido folico. Porta a un miglioramento del 75% della psoriasi superficiale in circa il 60% dei casi (60% PASI75) [4,5]. La risposta si vede entro due-sei settimane [6]. La somministrazione iniziale è di 7,5 mg/settimana. A causa della cinetica di assorbimento variabile con la somministrazione orale, si preferisce la forma parenterale. Entro le prime due settimane, la dose deve essere aumentata fino alla normale dose di mantenimento di 10-15 mg settimanali, aggiustando la dose ogni tre o quattro settimane. La somministrazione di 5 mg di acido folico p.o. 24-48 ore dopo migliora la tolleranza. Il principale svantaggio dell’MTX è la dose cumulativa limitata di circa 1,5 g, che in genere viene raggiunta dopo due o quattro anni. A questo limite, le determinazioni del procollagene III o le biopsie epatiche sono ora raccomandate per escludere la fibrosi epatica.
I retinoidi sono analoghi della vitale vitamina A liposolubile. Hanno un effetto antiproliferativo e immunomodulante. Il retinoide sistemico più comunemente usato, l’acitretina (Neotigason®), alla dose di 20-75 mg, mostra un PASI75 nel 25-41% dei pazienti entro otto-dodici settimane [7,8]. Dosi inferiori non mostrano alcun effetto. L’acitretina è preferita per le forme pustolose di psoriasi e per l’eritroderma psoriasico. La dose iniziale è solitamente di 0,5-1 mg/kg/d. Dopo la risposta, può essere ridotto a 0,3-0,5 mg/kg/d come terapia di mantenimento. Poiché si verificano effetti collaterali frequenti, anche se per lo più reversibili, e il farmaco è inferiore agli altri preparati come monoterapia, viene utilizzato quasi solo come preparato combinato per la fotochemioterapia. Qui si raggiungono tassi di remissione superiori al 94% [3]. In ogni caso, i pazienti devono essere informati dell’effetto teratogeno e viene prescritta un’efficace anticoncezione per due anni.
Il peptide enterico ciclosporina A (Sandimmun Neoral®), derivato dalla muffa del terreno Tolypocladium inflatum, inibisce i fattori di trascrizione nucleare nelle cellule T. In questo modo si ottiene una rapida immunosoppressione cellulare. Con la somministrazione orale di 2,5-3 mg/kgKG/d in due dosi singole (il dosaggio più basso descritto per il trattamento a lungo termine [9,10]), si raggiunge un PASI75 nel 50-70% dei casi dopo 8-16 settimane di terapia [11,12]. La ciclosporina A ha lo svantaggio di molti effetti collaterali, tra cui lo sviluppo di ipertensione arteriosa, insufficienza renale, tremore, infezioni e ipertricosi. Di solito non può essere utilizzato per più di qualche mese, quindi non è adatto come terapia a lungo termine per i pazienti psoriasici. Oggi viene utilizzata principalmente come terapia di salvataggio in situazioni in cui lo stato della pelle deve migliorare rapidamente (entro quattro settimane), come ad esempio nella psoriasi eritrodermatica.
Gli esteri dell’acido fumarico (Fumaderm®) hanno dimostrato la loro efficacia in studi in doppio cieco sin dal loro sviluppo da parte di Schweckendiek, un chimico che era lui stesso affetto da psoriasi [13–15]. Questa classe di sostanze è un sottoprodotto del ciclo del citrato e ha il vantaggio di un profilo di efficacia molto sicuro, anche se spesso si manifesta con effetti collaterali fastidiosi all’inizio della terapia, ad esempio vampate di calore, mal di testa, nausea, diarrea e linfopenia passiva. Tuttavia, se tollerato, può essere assunto per decenni e sopprimere completamente la psoriasi. Il PASI75 viene raggiunto dal 50-70% dei pazienti dopo 16 settimane [13–15]. Non è approvato in Svizzera, ma può essere facilmente ottenuto dalle farmacie internazionali, dopo aver ottenuto l’approvazione dalla compagnia di assicurazione sanitaria.
Biologici
Poiché la psoriasi è considerata una malattia immunitaria mediata dalle cellule T, in cui anche le citochine giocano un ruolo essenziale, sorgono punti di partenza specifici per la terapia. I biologici, ossia gli anticorpi ricombinanti o i recettori solubili, possono inibire efficacemente le citochine attivanti le cellule T. Attualmente sono approvati in Svizzera per il trattamento della psoriasi a placche da moderata a grave negli adulti, in determinate condizioni, gli antagonisti del fattore di necrosi tumorale (TNF)-α infliximab (Remicade®), etanercept (Enbrel®) e adalimumab (Humira®), il bloccante dell’IL-12/23 ustekinumab (Stelara®) e l’antagonista dell’IL-17A secukinumab (Cosentyx®).
Antagonisti del TNF-α: attualmente i biologici più utilizzati per il trattamento della psoriasi e dell’artrite psoriasica sono gli antagonisti del TNF-α.
Etanercept (Enbrel®) è un recettore solubile del TNF-α che viene somministrato per via s.c.. Utilizzi 50 mg settimanalmente, oppure 50 mg due volte alla settimana per i casi gravi. Il farmaco determina un miglioramento del 75% del PASI nel 30% dei pazienti entro dodici settimane [16]. È l’unico biologico approvato anche per la psoriasi pediatrica [17]. La domanda per il futuro, soprattutto per l’artrite psoriasica nell’infanzia, è in che misura il trattamento precoce con etanercept possa prevenire un decorso distruttivo e invalidante.
Infliximab (Remicade®) è un anticorpo chimerico topo-umano contro il TNF-α, che viene somministrato come infusione ogni otto settimane dopo la somministrazione iniziale. Infliximab è adatto ai pazienti pesanti, in quanto può essere somministrato in modo adattato al peso. Attualmente è uno dei biologici più efficaci, ma presenta lo svantaggio di un effetto decrescente nel tempo a causa della formazione di anticorpi.
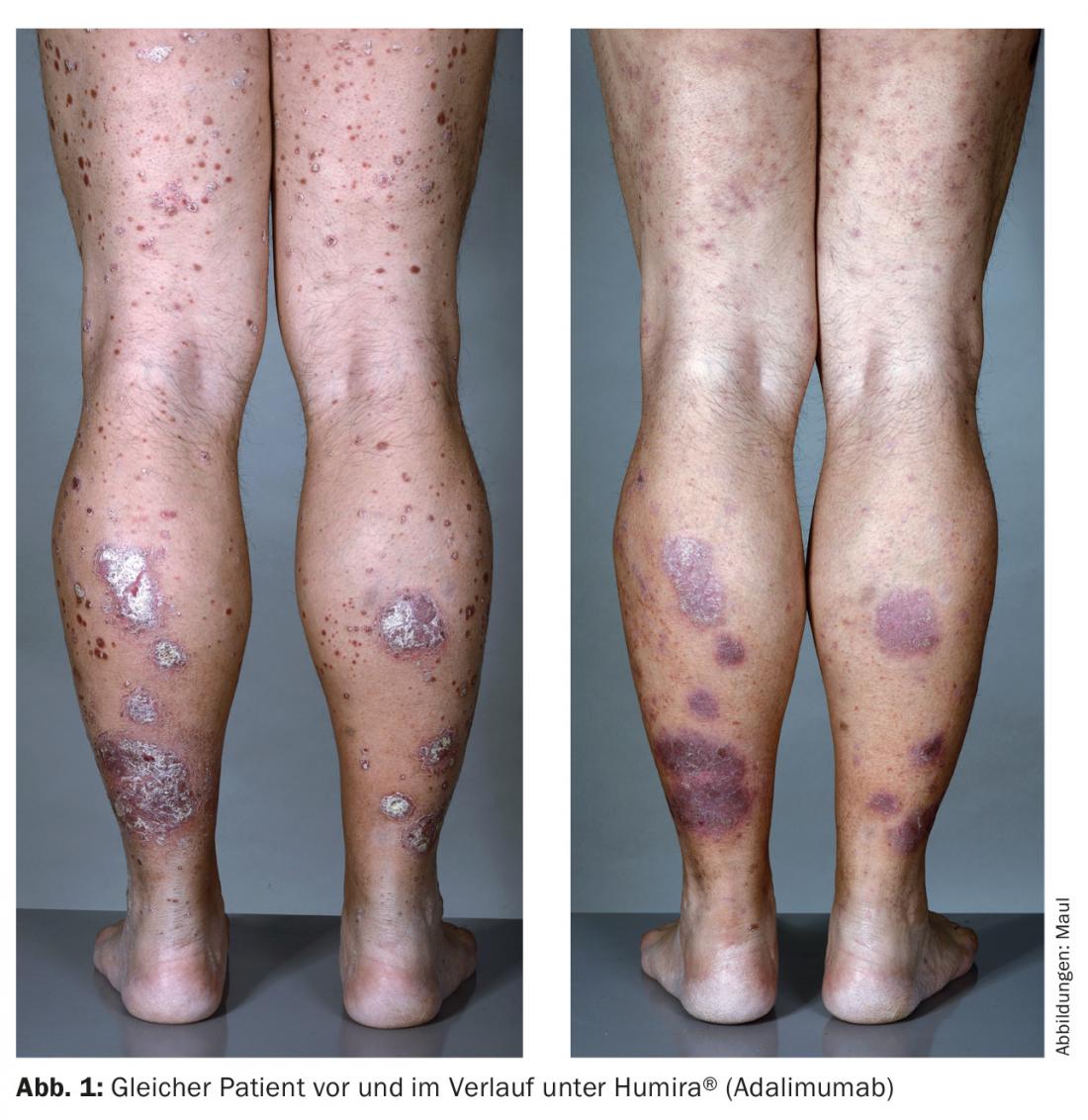
L’adalimumab (Humira®) è un anticorpo TNF-α completamente umanizzato che viene iniettato s.c. ogni due settimane e combina una buona efficacia con una grande autonomia del paziente (Fig. 1). Sia infliximab che adalimumab sono superiori a etanercept in termini di efficacia.
Bloccante dell’IL-12/23: il bloccante dell’IL-12/23 ustekinumab (Stelara®) è un anticorpo completamente umanizzato che lega la subunità comune dell’IL-12 e dell’IL23. Queste citochine sono importanti nelle risposte immunitarie locali. Sebbene siano essenziali per lo sviluppo delle lesioni cutanee psoriasiche, non sembrano essere essenziali per la normale immunità, in quanto negli studi non si sono verificati effetti avversi significativi rispetto al placebo. Gli studi a lungo termine non hanno inoltre evidenziato un aumento dei tassi di infezione, rendendo il farmaco una delle terapie per la psoriasi più sicure disponibili [18,19].
Antagonista dell’IL-17A: un nuovo biologico che è stato introdotto sul mercato nel 2015 è il bloccante dell’IL-17A secukinumab (Cosentyx®). L’IL-17A è una sostanza messaggera prodotta dal sottogruppo di cellule T-helper Th17, tra gli altri, ed è responsabile in modo molto specifico dell’infiammazione locale, reclutando granulociti neutrofili e monociti a livello locale nei siti di infiammazione. Il vantaggio di questa inibizione selettiva della risposta immunitaria è che gli effetti collaterali sono limitati a causa dell’inibizione di queste citochine. Secukinumab viene somministrato 300 mg s.c. settimanalmente nel primo mese, dalla quinta settimana in poi viene somministrato mensilmente. Due studi di fase III sul secukinumab nella psoriasi da moderata a grave hanno dimostrato che il miglioramento del PASI75 alla settimana 12 di terapia della psoriasi (rispetto alla condizione pre-terapia) è stato raggiunto nel 77,1-81,6% di tutti i pazienti [20]. In uno studio comparativo, il trattamento con etanercept è stato confrontato con il placebo; in questo caso, solo il 44,0% dei pazienti ha raggiunto un PASI75 alla settimana 12 con etanercept, mentre il placebo ha raggiunto questo endpoint in meno del 5% dei casi. Alla settimana 52, è stata osservata una risposta PASI90 nel 39% dei pazienti che assumevano Enbrel® rispetto al 70,6% che assumevano secukinumab 300 mg. Gli effetti collaterali degli antagonisti dell’IL-17 sono stati studiati in studi di fase III [20]. Il farmaco ha mostrato un profilo di sicurezza e di effetti collaterali simile a quello dei biologici più vecchi. Rispetto al placebo, il periodo di induzione ha mostrato un’incidenza leggermente maggiore di effetti avversi, soprattutto quelli di natura infettiva non pericolosi. L’IL-17 svolge un ruolo chiave nella difesa contro gli agenti patogeni microbici della mucocutanea. Tra l’altro, questi vengono difesi dai granulociti neutrofili, per i quali l’IL-17-A svolge un ruolo importante nella migrazione e nella granulopoiesi. Questo spiega perché l’incidenza delle infezioni da Candida non complicate aumenta in modo dose-dipendente. Tutte le infezioni da Candida potevano essere trattate con terapie standard e non comportavano l’interruzione della terapia con biologici. Inoltre, si sono verificate alcune neutropenie, che tuttavia sono scomparse spontaneamente.
Gli studi hanno dimostrato che il secukinumab è anche una buona terapia alternativa per l’artrite psoriasica. L’endpoint utilizzato è l’ACR20, un punteggio standard che misura il miglioramento del 20% dei sintomi dell’artrite psoriasica. Alla 24esima settimana, questo valore aveva raggiunto circa. 50% dei pazienti trattati con secukinumab rispetto al 18% dei pazienti trattati con placebo. In un secondo studio, il 39% dei pazienti trattati con 300 mg di secukinumab ha raggiunto un ACR20 rispetto al 15% del gruppo placebo [21].
Piccole molecole
Un altro farmaco approvato in Svizzera nel 2015 è apremilast (Otezla®), una piccola molecola orale inibitrice della fosfodiesterasi 4 (PDE4) per il trattamento della psoriasi (PsO) e dell’artrite psoriasica (PsA), che appartiene al gruppo delle “piccole molecole mirate”. L’inibitore della PDE4 apremilast regola a livello intracellulare la produzione di citochine infiammatorie, che svolgono un ruolo nell’immunofisiologia della PsO, aumentando i livelli di cAMP intracellulare. La produzione di citochine proinfiammatorie (come TNF-α, IL-23, IL-17) viene ridotta, mentre viene promossa la produzione di citochine antinfiammatorie. Negli studi ESTEEM 1 e 2, circa sei volte più pazienti hanno ottenuto una risposta PASI75 alla settimana 16 con apremilast rispetto al placebo (in particolare, un terzo dei pazienti con apremilast ha avuto un miglioramento del 75% della psoriasi entro 16 settimane). La risposta è stata mantenuta per 52 settimane. Il 22% dei pazienti trattati con apremilast ha anche ottenuto una guarigione quasi completa della PsO dopo 16 settimane (sPGA: 21,7% vs. 3,9%). Inoltre, apremilast ha mostrato buoni risultati nei siti difficili da trattare, come il cuoio capelluto (scPGA) e l’infestazione delle unghie (NAPSI) già alla 16a settimana. Il prurito è diminuito maggiormente durante questo periodo rispetto al placebo, ma anche in questo caso, i singoli biologici hanno un effetto più rapido e forse più forte. La qualità della vita è migliorata clinicamente in modo significativo rispetto al gruppo placebo (riduzione DLQI ≥5: 70% vs. 34%) [22]. Il trattamento con Apremilast è stato ben tollerato (nessun aumento del rischio di infezioni) e di conseguenza ha portato a un tasso inferiore di interruzione del trattamento. Gli effetti collaterali sperimentati includono: Diarrea, nausea, mal di testa e infezioni del tratto respiratorio superiore, soprattutto nelle prime due settimane di trattamento. I sintomi della diarrea sono generalmente scomparsi entro quattro settimane senza intervento medico con il proseguimento della terapia con Otezla® [22,23]. Apremilast viene aumentato inizialmente come titolazione per cinque giorni (confezione di titolazione di 10/20/30 mg), poi viene somministrato come terapia di mantenimento a 30 mg 2×/d. Apremilast può essere utilizzato anche per trattare l’artrite psoriasica, come dimostrato dallo studio PALACE1 (n=504). Il trattamento con apremilast ha comportato una risposta ACR20 significativamente più elevata (38,1% rispetto al 19,0%) rispetto al placebo alla settimana 16. Il tasso di risposta ACR20 è migliorato progressivamente tra la settimana 24 e la settimana 52, rispettivamente al 63% (apremilast 20 mg BID) e al 55% (apremilast 30 mg BID). Apremilast ha anche mostrato un miglioramento significativo dei sintomi della PsA (gonfiore, dolore, entesite, dattilite), del funzionamento fisico e della qualità di vita (SF36, HAQ-DI). I miglioramenti nei parametri rilevanti sono stati mantenuti fino alla settimana 52 [23].
Prospettiva
Con i progressi dell’immunologia nella comprensione della patogenesi della psoriasi, lo sviluppo di farmaci con maggiore selettività e il riconoscimento della natura sistemica della psoriasi, la terapia è migliorata. Allo stesso tempo, è diventato più complicato. In particolare, l’integrazione di biologici e piccole molecole nel trattamento della psoriasi grave ha portato a un cambiamento di paradigma in dermatologia: La pelle torna a far parte dell’intero organismo, che è ugualmente colpito dalla psoriasi nell’area della psiche, del sistema cardiovascolare o dell’apparato muscolo-scheletrico come il tegumento. Non da ultimo, grazie agli studi clinici con i biologici, è aumentata l’attenzione per gli strumenti di qualità della vita come altra misura del successo del trattamento. Siamo estremamente curiosi di vedere in che misura l’uso dei biologici avrà anche un effetto favorevole sulle comorbidità e sull’aspettativa di vita a lungo termine. Sia nella clinica che nella pratica dermatologica: i fattori decisivi in ogni singolo caso sono l’indicazione medica e la mancanza di alternative terapeutiche genuine più economiche. La psoriasi e l’artrite psoriasica devono essere trattate da un team composto da dermatologi, reumatologi e medici di base.
È di grande importanza riconoscere precocemente sia le manifestazioni cutanee della psoriasi che le sue comorbidità e trattarle in modo efficace.
Letteratura:
- Jemec GB, et al: Una nuova formulazione per il cuoio capelluto di calcipotriene più betametasone confrontata con i suoi principi attivi e il veicolo nel trattamento della psoriasi del cuoio capelluto. Uno studio randomizzato, in doppio cieco e controllato. J Am Acad Dermatol 2008; 59: 455-463.
- Barbagallo J, et al: Fototerapia UVB a banda stretta per il trattamento della psoriasi. Una revisione e un aggiornamento. Cutis 2001; 68: 345-347.
- Saurat JH, et al: Studio multicentrico randomizzato in doppio cieco che confronta acitretina-PUVA, etretinato-PUVA e placebo-PUVA nel trattamento della psoriasi grave. Dermatologica 1988; 177: 218-224.
- Heydendael VM, et al: Methotrexate rispetto alla ciclosporina nella psoriasi a placche cronica da moderata a grave. N Engl J Med 2003; 349: 658-665.
- Nyfors A: Benefici ed esperienze farmacologiche avverse durante il trattamento a lungo termine con metotrexato di 248 psoriasici. Dan Med Bull 1978; 25: 208-211.
- Trüeb RM: Raccomandazioni di consenso sul metotrexato. Gebro Pharma 2008.
- van de Kerkhof PC, et al: L’effetto dell’aggiunta dell’unguento di calcipotriolo (50 microgrammi/g) alla terapia con acitretina nella psoriasi. Br J Dermatol 1998; 138: 84-89.
- Gupta AK, et al: Profilo degli effetti collaterali della terapia con acitretina nella psoriasi. J Am Acad Dermatol 1989; 20: 1088-1093.
- Griffiths CE, et al: Eliminazione della psoriasi con la ciclosporina a basso dosaggio. Br Med J (Clin Res Ed) 1986; 293: 731-732.
- Lowe NJ, et al: Terapia a lungo termine con ciclosporina a basso dosaggio per la psoriasi grave. Effetti sulla funzione e sulla struttura renale. J Am Acad Dermatol 1996; 35: 710-719.
- Koo J: Uno studio randomizzato, in doppio cieco, che confronta l’efficacia, la sicurezza e la dose ottimale di due formulazioni di ciclosporina, Neoral e Sandimmun, nei pazienti con psoriasi grave. Gruppo di studio OLP302. Br J Dermatol 1998; 139: 88-95.
- Laburte C, et al: Efficacia e sicurezza della ciclosporina A orale (CyA; Sandimmun) per il trattamento a lungo termine della psoriasi a placche cronica grave. Br J Dermatol 1994; 130: 366-375.
- Altmeyer PJ, et al.: Effetto antipsoriatico dei derivati dell’acido fumarico. Risultati di uno studio multicentrico in doppio cieco su 100 pazienti. J Am Acad Dermatol 1994; 30: 977-981.
- Gollnick H, et al: Il calcipotriolo topico più l’acido fumarico orale è più efficace e agisce più rapidamente rispetto alla monoterapia con acido fumarico orale nel trattamento della psoriasi vulgaris cronica grave a placche. Dermatologia 2002; 205: 46-53.
- Altmeyer P, Hartwig R, Matthes U: [Efficacia e profilo di sicurezza degli esteri di acido fumarico nella terapia orale a lungo termine con psoriasi vulgaris grave refrattaria al trattamento. Uno studio su 83 pazienti]. Dermatologo 1996; 47: 190-196.
- Gottlieb AB, et al: Uno studio randomizzato di etanercept come monoterapia per la psoriasi. Arch Dermatol 2003; 139: 1627-1632; discussione 32.
- Paller AS, et al: Trattamento con etanercept per bambini e adolescenti con psoriasi a placche. N Engl J Med 2008; 358: 241-251.
- Leonardi CL, et al: Efficacia e sicurezza di ustekinumab, un anticorpo monoclonale umano interleuchina-12/23, nei pazienti con psoriasi: risultati a 76 settimane di uno studio randomizzato, in doppio cieco, controllato con placebo (PHOENIX 1). Lancet 2008; 371: 1665-1674.
- Papp KA, et al: Efficacia e sicurezza di ustekinumab, un anticorpo monoclonale umano interleuchina-12/23, nei pazienti con psoriasi: risultati a 52 settimane di uno studio randomizzato, in doppio cieco, controllato con placebo (PHOENIX 2). Lancet 2008; 371: 1675-1684.
- Langley RG, et al: Secukinumab nella psoriasi a placche – risultati di due studi di fase 3. N Engl J Med 2014; 371: 326-338.
- McInnes IB, et al: Efficacia e sicurezza del secukinumab, un anticorpo monoclonale anti-interleuchina-17A completamente umano, nei pazienti con artrite psoriasica da moderata a grave: uno studio di prova di concetto di fase II, randomizzato, in doppio cieco, controllato con placebo, della durata di 24 settimane. Ann Rheum Dis 2014; 73: 349-356.
- Papp K, et al.: Apremilast, un inibitore orale della fosfodiesterasi 4 (PDE4), nei pazienti con psoriasi a placche da moderata a grave. Risultati di uno studio di fase III, randomizzato e controllato (Efficacy and Safety Trial Evaluating the Effects of Apremilast in Psoriasis [ESTEEM] 1). J Am Acad Dermatol 2015; 73: 37-49.
- Schafer PH, et al: L’impatto farmacodinamico di apremilast, un inibitore orale della fosfodiesterasi 4, sui livelli circolanti di biomarcatori infiammatori nei pazienti con artrite psoriasica. Risultati di un sottostudio di fase III, randomizzato, controllato con placebo (PALACE 1). J Immunol Res 2015; 2015: 906349.
PRATICA DERMATOLOGICA 2016: 26(2): 10-16