I tumori neuroendocrini (NET) non sono così rari. La prevalenza di questi tumori nel tratto gastrointestinale è superata solo dal carcinoma del colon. Spesso i NET vengono scoperti solo in fase avanzata, a causa dei sintomi sottili, e spesso sono già in uno stadio palliativo, non operabile. È quindi importante pensare a questi tumori. Negli ultimi anni sono state introdotte molte nuove opzioni di terapia chirurgica, locale-interventistica e sistemica. A causa dell’elevato grado di complessità nella diagnosi e nel trattamento di questi tumori, è auspicabile la collaborazione in un team specializzato di gastroenterologi, chirurghi, patologi, radiologi, specialisti di medicina nucleare, endocrinologi e oncologi.
I tumori neuroendocrini (NET) hanno un’incidenza relativamente bassa ma in aumento, pari a 4-5 nuovi casi / 100.000 abitanti all’anno [1]. Tuttavia, la prevalenza, ossia il numero di pazienti affetti da tumori neuroendocrini gastrointestinali (GEP-NET), è di gran lunga superiore e nel tratto gastrointestinale è superata solo dal carcinoma del colon. Inoltre, l’incidenza di tutti i GEP-NET, ad eccezione dei carcinoidi appendicolari, è in aumento [2]. In pratica, le GEP-NET sono più comuni del previsto. Questa breve panoramica riassume i fatti più importanti nella diagnosi, le diverse forme di diagnosi di diffusione, le misure terapeutiche più importanti e la cura successiva. Il riassunto si basa sulle attuali linee guida della Società Europea dei Tumori Neuroendocrini(www.enets.org).
Classificazione di GEP-NET
I tumori neuroendocrini sono classificati principalmente in base alla localizzazione del tumore primario e al numero di mitosi (Ki67). Il tasso mitotico è uno dei fattori prognostici più importanti e divide questi tumori in G1 (Ki67 ≤ 2%), G2 (Ki67 3-20%) e G3 (Ki67 >20%), con lo stadio G3 che corrisponde a un carcinoma neuroendocrino meno differenziato e spesso aggressivo rispetto ai tumori neuroendocrini meglio differenziati [3,4].
I tumori neuroendocrini gastrointestinali possono insorgere in qualsiasi punto del tratto digestivo. A seconda della localizzazione del tumore primario, le caratteristiche e la forma della metastasi sono diverse e richiedono un chiarimento corrispondente. L’incidenza del NET gastrico (g-NET) è aumentata costantemente negli ultimi anni e ammonta a circa l’8% dei GEP-NET [5]. Le ragioni di ciò sono certamente l’introduzione diffusa della gastroscopia e forse l’uso frequente di inibitori della pompa protonica [6].
I g-NET sono suddivisi in tre sottogruppi. Il tipo I, il più comune, può essere accompagnato da gastrite atrofica, di solito è ben differenziato, raramente metastatizza e ha una buona prognosi. I sottotipi II e III sono più rari, metastatizzano più frequentemente e hanno una prognosi peggiore (soprattutto il sottotipo III) [5]. Il work-up e la prognosi di questi tumori gastrici devono essere adattati in base al tipo e alle dimensioni. I NET duodenali (d-NET) sono rari (1- 2% dei GEP-NET), si verificano soprattutto nei primi due terzi del duodeno, sono di solito relativamente piccoli, piuttosto ben differenziati e tuttavia metastatizzano localmente ai linfonodi nel 40-60% [7]. L’incidenza del GEP-NET pancreatico (p-NET) è compresa tra 2 e 3/100.000 persone all’anno [8]. Nel p-NET, i segni precoci della malattia maligna sono spesso assenti. Questi pazienti si presentano al medico con una compressione locale o con segni di metastasi avanzate (soprattutto al fegato). Per questo motivo, oltre il 50% dei pazienti con p-NET presenta già metastasi a distanza.
Una malattia di base rara ma tipica del p-NET (anche del d-NET) è la Neoplasia Endocrina Multipla di Tipo I (MEN I).
Circa il 20% dei pazienti con MEN1 soffre di p-NET, con un’incidenza crescente con l’età [8]. Allo stesso modo, i pazienti con la malattia di Von Hippel-Lindau, tra le altre neoplasie, hanno maggiori probabilità di sviluppare il p-NET.
I NET giunzionali e ileali sono i NET GEP più comuni, rappresentando fino al 30% di tutti i casi [9]. I NET del piccolo intestino, simili ai p-NET, tendono ad essere già metastatizzati al momento della diagnosi. In genere, vengono spesso colpiti i linfonodi locali e successivamente anche il fegato. I NET del colon si verificano in circa il 7% di tutti i GEP-NET e generalmente hanno la prognosi peggiore [10]. Analogamente ai tumori già descritti, i NET del colon di solito sono già molto avanzati al momento della diagnosi e metastatizzano a livello locale, peritoneale e al fegato. I NET rettali, invece, vengono spesso trovati relativamente presto. Questo è dovuto ai primi sintomi, come il dolore o il sangue ab ano. Per questo motivo, tra l’altro, le metastasi nel NET rettale sono piuttosto rare [10]. Nel complesso, la biologia del GEP-NET varia a seconda della localizzazione e della differenziazione. Pertanto, la diagnosi, la terapia e il follow-up devono essere adattati alla localizzazione primaria.
Chiarimenti diagnostici e imaging
A seconda della localizzazione, il chiarimento della GEP-NET varia. La diagnosi viene fatta con la conferma istologica [11]. Un’aspirazione con ago sottile per il work-up citologico è spesso insufficiente. I marcatori obbligatori per la diagnosi sono la sinaptofisina e la cromogranina A. Si deve anche determinare il grado di differenziazione (G1-G3). Altri marcatori, ad esempio i singoli recettori della somatostatina, non sono obbligatori, ma sono interessanti, ad esempio per ulteriori fasi terapeutiche.
Dopo la diagnosi, la stadiazione viene effettuata [12]. La stadiazione, insieme al grading, è il marcatore prognostico più importante per il paziente. I metodi utilizzati comprendono l’ecografia (compresa l’ecografia endoscopica), spesso la TAC con contrasto, la risonanza magnetica e i metodi funzionali come la scintigrafia con octreotide e la PET/CT con gallio-68 DOTATO/DOTATOC e la PET/CT con fluoro-18 desossiglucosio (FDG). Il dominio degli ultrasuoni è principalmente la visualizzazione delle metastasi epatiche, con una sensibilità e una specificità intorno al 90%. L’ecografia endoscopica (EUS) viene utilizzata in particolare per i tumori neuroendocrini del pancreas (ad esempio, insulinomi pancreatici o tumori pancreatici non funzionali). La specificità/sensibilità è superiore al 90%. I tumori duodenali sono più difficili da visualizzare con l’EUS. Il tasso di rilevamento di questi tumori con l’EUS è solo del 60% circa. La TAC con contrasto è il metodo più utilizzato per la stadiazione del GEP-NET. È importante eseguire una fase arteriosa, soprattutto in caso di metastasi epatiche. Questo aumenta il tasso di rilevamento delle metastasi epatiche a circa l’80%. Tuttavia, la sensibilità è leggermente inferiore (circa il 70%), soprattutto per i p-NET e le metastasi dei tessuti molli. Questi tumori sono il dominio tipico dell’esame di risonanza magnetica. La risonanza magnetica ha una sensibilità superiore al 90% per il p-NET nel pancreas. Inoltre, la risonanza magnetica epatica con mezzo di contrasto specifico per il fegato è l’esame di scelta per trovare le metastasi epatiche. Con un tasso di rilevamento fino al 95%, la risonanza magnetica epatica è il metodo più sensibile per le metastasi epatiche. I metodi funzionali sono tipicamente utilizzati per la diagnostica della propagazione e per misurare l’espressione dei recettori della somatostatina (in particolare SSTR2) [13].
La scintigrafia con octreotide utilizzata fino a poco tempo fa, che ha un’esposizione alle radiazioni relativamente elevata e protocolli di registrazione di diversi giorni, viene ora sostituita dalla PET/CT con gallio-68 DOTATO/DOTATOC. L’esame PET presenta una radiazione significativamente inferiore (circa il 30%) e una risoluzione notevolmente migliorata rispetto al metodo scintigrafico. In molti centri NET, la scintigrafia è stata completamente sostituita dalla PET/CT con gallio-68 DOTATO/DOTATOC (Fig. 1) .
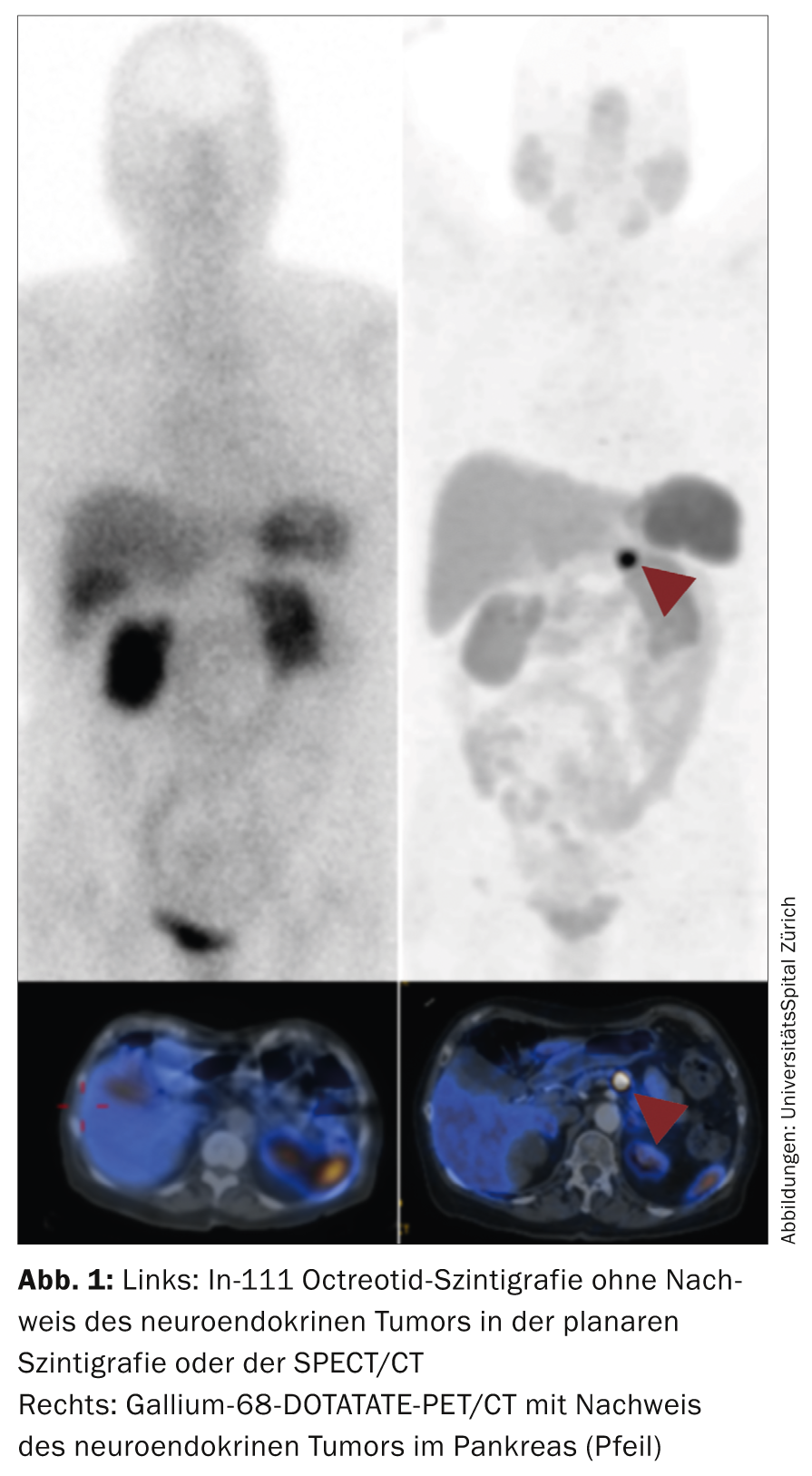
La FDG-PET/CT viene utilizzata per i carcinomi dedifferenziati (G3), sebbene anche i tumori di grado superiore G2 possano evidenziarsi meglio con la FDG-PET. I pazienti con tumori funzionali con sintomi da carcinoide devono ricevere almeno una volta un’ecocardiografia per escludere un coinvolgimento cardiaco [14].
Marcatori biochimici
I GEP-NET, in particolare i tumori “midgut”, possono produrre e secernere peptidi funzionalmente attivi. Tuttavia, il tasso di tumori clinicamente funzionali rispetto a quelli non funzionali è solo di 1:10 circa. I cosiddetti tumori “Foregut” e “Hindgut” sono funzionali un po’ meno frequentemente. La misurazione di questi peptidi nelle urine o nel sangue può essere utilizzata come indicatore di progressione se i sintomi sono presenti [15].
Il test standard è la misurazione dell’acido 5-indoleacetico (5-HIAA) nelle urine per 24 ore. In presenza di sintomi funzionali NET, i tassi di sensibilità e specificità risp. al 70 e al 90%. Il 5-HIAA può anche essere elevato dalle malattie infiammatorie croniche dell’intestino e quindi influenzare il risultato della misurazione in modo falsamente positivo. Anche i farmaci, ad esempio i chemioterapici o le sostanze attive a livello centrale come gli antidepressivi triciclici, possono influenzare i valori della raccolta delle urine delle 24 ore e devono essere richiesti.
Altri esami, come il test del digiuno per l’insulinoma o il test della secretina per il gastrinoma, devono essere eseguiti da uno specialista esperto (ad esempio, in un reparto di endocrinologia specializzato). La cromogranina A (CgA) è un altro importante marcatore biochimico plasmatico del NET. La CgA è prodotta nei granuli neurosecretori delle cellule tumorali e può essere secreta allo stesso modo nei NET funzionali e non funzionali. Va notato che la CgA può essere falsamente elevata, soprattutto se si assumono contemporaneamente degli inibitori della pompa protonica. Altri fattori che possono aumentare la CgA sono: Insufficienza renale, morbo di Parkinson, ipertensione non trattata, gravidanza, glucocorticoidi, gastrite cronica di tipo A e malattia infiammatoria intestinale. Tuttavia, è stato dimostrato che la CgA è più accurata della misurazione del 5-HIAA urinario o dell’Enolasi Neurone Specifica (NSE) comunemente eseguita [15].
Terapia della GEP-NET
La terapia dei tumori neuroendocrini è complessa e deve essere discussa e decisa su base multidisciplinare. Una commissione tumori con la presenza di diverse discipline diagnostiche, chirurgiche e mediche dovrebbe decidere almeno una volta la diagnosi, la terapia e il follow-up di un paziente con NET.
La prima priorità di qualsiasi terapia è quella di puntare all’intervento chirurgico (purché sembri ragionevole). L’obiettivo dell’operazione deve essere, quando possibile, l’asportazione completa del tumore. Inoltre, i tumori localmente sintomatici devono essere trattati chirurgicamente, ad esempio in caso di ileo imminente o di ab ano sanguigno. La terapia citoriduttiva può essere discussa in alcuni casi in un contesto palliativo con un elevato carico tumorale. Tuttavia, questo deve essere discusso in dettaglio con il paziente, in considerazione del contesto palliativo, della morbilità talvolta elevata dell’intervento e della malattia che spesso progredisce lentamente.
I pazienti con sintomi funzionali pronunciati devono essere sottoposti a screening perioperatorio con Sandostatina, eventualmente bloccanti H1/H2 e cortisone [16]. Va notato anche che la catecolamina può portare a un aumento del rilascio di ormoni.
Nei pazienti con un carico tumorale elevato, le procedure interventistiche (ad esempio, l’embolizzazione) possono causare una rapida variazione della pressione sanguigna. Questo è particolarmente importante nei pazienti con coinvolgimento cardiaco della sindrome carcinoide. Se non è possibile un intervento chirurgico, in linea di principio si ricorre a terapie locali-interventistiche o sistemiche.
I metodi interventistici locali comprendono l’embolizzazione di particelle, la chemioembolizzazione e la radioembolizzazione. L’embolizzazione classica blanda, tuttavia, oggi viene eseguita solo in piccole quantità per il NET. Ciò è dovuto principalmente all’alto tasso di effetti collaterali (a causa dell’effetto diretto della grave ipossia locale e della necrosi). Allo stesso modo, la chemioembolizzazione nei NET spesso porta a sintomi gravi (soprattutto la sindrome post-embolizzazione), soprattutto nei tumori epatici avanzati e di grandi dimensioni. La radioembolizzazione è una terapia elegante con pochi effetti collaterali nelle mani di specialisti esperti. L’infusione locale di microsfere radioattive, tipicamente caricate con ittrio-90, un emettitore β puro, deposita radiazioni locali fino a più di 500 gradi nelle metastasi epatiche in una sola seduta. Ciò è dovuto alle proprietà radianti dell’ittrio-90 e alla perfusione arteriosa tipicamente selettiva delle metastasi NET nel fegato (Fig. 2).
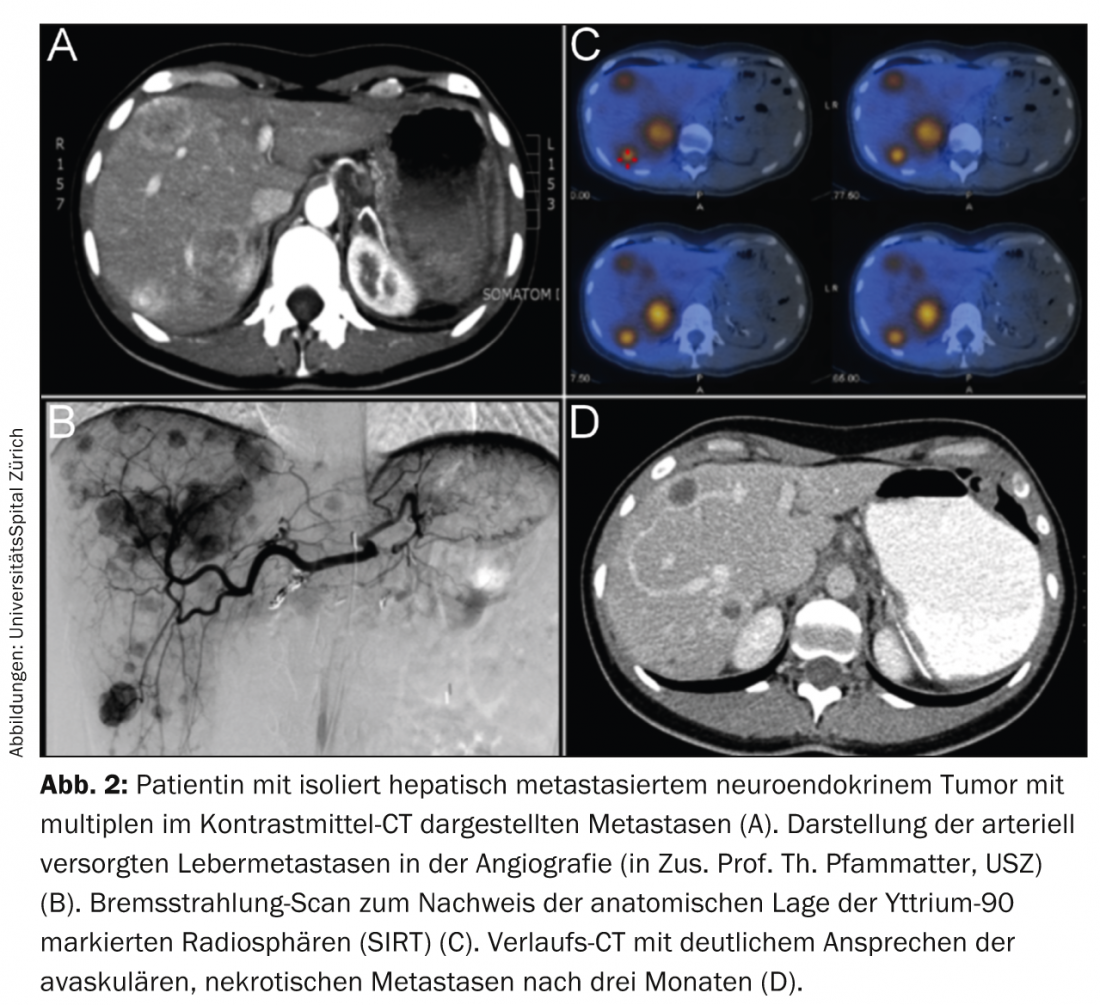
A causa del basso tasso di effetti collaterali della radioembolizzazione ambulatoriale eseguita correttamente, la chemioembolizzazione e soprattutto l’embolizzazione sono state quasi completamente sostituite [17]. Tuttavia, questa terapia viene eseguita regolarmente solo in alcuni centri in Svizzera, ad esempio il Centro di Eccellenza ENETS dell’Ospedale Universitario di Zurigo.
Se non viene presa in considerazione una terapia chirurgica o locale-sistemica, una terapia sistemica palliativa deve essere discussa in seno al comitato tumori. Per i tumori “dell’intestino medio” non pancreatici e ben differenziati, la terapia con analoghi della somatostatina è lo standard come prima linea di terapia. In linea di principio, sono disponibili due diversi farmaci a lunga durata d’azione. Octreotide-LAR ha dimostrato una prolungata sopravvivenza libera da progressione nei NET funzionalmente attivi e inattivi in uno studio controllato con placebo (studio PROMID) nei tumori “midgut” ben differenziati [18]. L’analisi dei dati a lungo termine dello studio PROMID ha anche mostrato una tendenza positiva dell’octreotide sul prolungamento della sopravvivenza globale, nonostante il cross-over al braccio di trattamento (octreotide) dopo il progresso [19].
Recentemente sono stati presentati anche i dati su lanreotide, che hanno mostrato un miglioramento significativo della sopravvivenza libera da progressione [20]. Questi preparati non sono stati confrontati direttamente tra loro e quale di questi preparati possa essere utilizzato in quale indicazione resta da vedere nella pratica clinica quotidiana. Nella migliore delle ipotesi, lanreotide sarà utilizzato nei tumori più avanzati con un carico tumorale più elevato, a causa del disegno dello studio Clarinet. Nei tumori pancreatici ben differenziati (pochi “di grado intermedio”), everolimus ha mostrato un prolungamento della sopravvivenza libera da progressione ed è approvato come Afinitor® di prima linea nel p-NET [21].
L’everolimus in combinazione con l’octreotide può essere preso in considerazione anche per altri NET, ad esempio polmone e colon, grazie all’impatto positivo sulla sopravvivenza libera da progressione nello studio RADIANT-2, che ha mancato di poco la significatività statistica [22]. Sutent® mostra anche un prolungamento della sopravvivenza libera da progressione e della sopravvivenza globale nei pazienti con NET del pancreas ben differenziato [23]. Entrambi i farmaci sono un’opzione nei pazienti con p-NET ben differenziato. Tuttavia, gli effetti collaterali di queste terapie sono talvolta considerevoli e devono essere eseguite da uno specialista esperto. Le terapie sistemiche sopra menzionate sono utilizzate principalmente per i GEP-NET ben differenziati.
Per i tumori G2 più proliferativi, vengono utilizzate classicamente le chemioterapie combinate. In particolare, le terapie a base di 5-fluorouracile vengono utilizzate in combinazione con la streptozotocina o Temodal® [24,25]. Queste chemioterapie sono generalmente relativamente tossiche, ma possono essere utilizzate con buon successo da oncologi esperti, soprattutto nei pazienti con un carico tumorale elevato, sintomi e crescita relativamente rapida. I pazienti con carcinomi neuroendocrini a grandi o piccole cellule altamente proliferativi e dedifferenziati spesso beneficiano della chemioterapia combinata con cisplatino ed etoposide [26]. I pazienti con un’alta espressione dei recettori della somatostatina alla scintigrafia con octreotide o alla PET/CT con gallio-68 DOTATO/DOTATOC possono essere valutati per una terapia con radionuclidi peptidici. Questa terapia con radionuclidi, somministrata per via sistemica, irradia i tumori SSTR2-positivi legando e assorbendo gli analoghi della somatostatina radiomarcati. Questa terapia è attualmente oggetto di uno studio di fase III rispetto all’octreotide-LAR. Negli studi di fase II, questa terapia si è dimostrata molto efficace con un tasso molto basso di effetti collaterali [27]. In particolare, l’insufficienza renale, spesso menzionata, si verifica in meno dell’1% dei pazienti. Questa terapia è offerta da alcuni centri in Svizzera, ad esempio il Centro di Eccellenza ENETS dell’Ospedale Universitario di Zurigo o gli Ospedali Universitari di Basilea e Berna. L’Ospedale Universitario di Basilea ha assunto un ruolo pionieristico in questo ambito. I nuovi approcci terapeutici stanno studiando nuove combinazioni della terapia di cui sopra ed esplorando nuovi modi come la riduzione dei sintomi del carcinoide [28]. Gli analoghi della somatostatina di seconda generazione (pasireotide Signifor®) non hanno mostrato un miglioramento del controllo dei sintomi in uno studio di fase III, ma un prolungamento della sopravvivenza libera da progressione di cinque mesi rispetto a octreotide-LAR [29].
In generale, esiste un’ampia varietà di terapie diverse per il GEP-NET e queste devono essere adattate alla localizzazione del tumore primario e alla sua differenziazione. Questo è uno dei motivi per cui i pazienti con NET dovrebbero essere discussi in un comitato tumori specializzato.
Follow-up dei pazienti con NET
Il follow-up dei pazienti con NET varia a seconda del tumore primario e della differenziazione del tumore. In generale, gli insulinomi benigni dopo l’asportazione, i carcinoidi rettali dopo l’asportazione e i carcinoidi appendicolari precoci non richiedono un follow-up. I NET gastrici di tipo I necessitano di un’endoscopia annuale. In generale, i tumori G1 devono essere monitorati tramite imaging e laboratorio ogni dodici mesi, i tumori G2 ogni sei mesi e i carcinomi G3 ogni tre mesi. Si raccomanda il metodo di successo della stadiazione [30].
Prof. Dr. med. Niklaus G. Schaefer
Letteratura:
- Yao JC, et al: Cento anni dopo il “carcinoide”: epidemiologia e fattori prognostici dei tumori neuroendocrini in 35.825 casi negli Stati Uniti. J Clin Oncol 2008; 26(18): 3063-3072.
- Tsikitis VL, Wertheim BC, Guerrero MA: Tendenze di incidenza e sopravvivenza dei tumori neuroendocrini gastrointestinali negli Stati Uniti: un’analisi Seer. J Cancer 2012; 3: 292-302.
- Rindi G, et al: Stadiazione TNM dei tumori (neuro)endocrini dell’intestino anteriore: una proposta di consenso che include un sistema di classificazione. Archivio Virchows 2006; 4; 395-401.
- Rindi G, et al: Stadiazione TNM dei tumori endocrini dell’intestino medio e dell’intestino posteriore (neuro): una proposta di consenso che include un sistema di classificazione. Archivio Virchows 2007; 4; 757-762.
- Ruszniewski P, et al: Tumori/Carcinomi gastrici ben differenziati. Neuroendocrinologia 2006; 84: 158-164.
- Lawrence B, et al: Una prospettiva clinica sulla neoplasia neuroendocrina gastrica. Curr Gastroenterol Rep 2011 Feb; 13(1): 101-109.
- Robert T, et al: Tumore/Carcinoma duodenale ben differenziato (esclusi i gastrinomi). Neuroendocrinologia 2006; 84: 165-172.
- Falconi M, et al: Tumori non funzionanti del pancreas ben differenziati/Carcinoma. Neuroendocrinologia 2006; 84: 196-211.
- Eriksson B, et al: Linee guida di consenso per la gestione dei pazienti con tumori neuroendocrini dell’apparato digerente – tumore/carcinoma ben differenziato del giugulo-ileale. Neuroendocrinologia 2008; 87: 8-19.
- Ramage JK, et al: Linee guida di consenso per la gestione dei pazienti con tumori neuroendocrini dell’apparato digerente: tumore/carcinoma ben differenziato del colon e del retto. Neuroendocrinologia 2008; 87: 31-39.
- Klöppel G, et al: Linee guida di consenso ENETS per gli standard di cura nei tumori neuroendocrini: verso un approccio standardizzato alla diagnosi dei tumori neuroendocrini gastroenteropancreatici e alla loro stratificazione prognostica. Neuroendocrinologia 2009; 90: 162-166.
- Sundin A, et al: Linee guida di consenso ENETS per gli standard di cura nei tumori neuroendocrini: esami radiologici. Neuroendocrinologia 2009; 90: 167-183.
- Dik J, et al: Linee guida di consenso ENETS per gli standard di cura nei tumori neuroendocrini: imaging del recettore della somatostatina con 111 In-Pentetreotide. Neuroendocrinologia 2009; 90: 184-189.
- Plöckinger U, et al: Linee guida di consenso ENETS per gli standard di cura nei tumori neuroendocrini: ecocardiografia. Neuroendocrinologia 2009; 90: 190-193.
- O’Toole D, et al: Linee guida di consenso ENETS per gli standard di cura nei tumori neuroendocrini: marcatori biochimici. Neuroendocrinologia 2009; 90: 194-202.
- Akerström G, et al: Linee guida di consenso ENETS per gli standard di cura nei tumori neuroendocrini: terapia pre- e perioperatoria nei pazienti con tumori neuroendocrini. Neuroendocrinologia 2009; 90: 203-208.
- Kennedy A, et al: Radioembolizzazione per metastasi epatiche neuroendocrine non resecabili con microsfere di resina 90Y: risultati precoci in 148 pazienti. Am J Clin Oncol 2008; 31: 271-279.
- Rinke A, et al: Studio prospettico, randomizzato, in doppio cieco, controllato con placebo, sull’effetto di octreotide LAR nel controllo della crescita tumorale nei pazienti con tumori neuroendocrini metastatici dell’intestino medio: un rapporto del gruppo di studio PROMID. J Clin Oncol 2009 Oct 1; 27(28): 4656-4663.
- Arnold R, et al: Studio prospettico, randomizzato, in doppio cieco, controllato con placebo sull’effetto dell’octreotide LAR nel controllo della crescita tumorale nei pazienti con tumori neuroendocrini metastatici dell’intestino medio (PROMID): risultati sulla sopravvivenza a lungo termine. J Clin Oncol 2013; 31 (suppl; abstr 4030).
- www.esmo.org/Conferences/Past-Conferences/European-Cancer-Congress-2013/News/Phase-III-Trial-Results-Favour-Lanreotide-Therapy-in-Patients-with-Gastroenteropancreatic-Neuro-Endocrine-Tumours.
- Yao JC, et al: Everolimus per i tumori neuroendocrini pancreatici avanzati. N Engl J Med 2011 Feb 10; 364(6): 514-523.
- Pavel ME, et al: Everolimus più octreotide a lunga durata d’azione ripetibile per il trattamento dei tumori neuroendocrini avanzati associati alla sindrome carcinoide (RADIANT-2): uno studio di fase 3 randomizzato, controllato con placebo. Lancet 2011 Dec 10; 378(9808): 2005-2012.
- Raymond E, et al: Sunitinib malato per il trattamento dei tumori neuroendocrini del pancreas. N Engl J Med 2011 Feb 10; 364(6): 501-513.
- Engstrom PF, et al: Streptozocina più fluorouracile rispetto alla terapia con doxorubicina per il tumore carcinoide metastatico. J Clin Oncol 1984 Nov; 2(11): 1255-1259.
- Strosberg JR, et al: Chemioterapia di prima linea con capecitabina e temozolomide nei pazienti con carcinomi endocrini pancreatici metastatici. Cancro 2011 Jan 15; 117(2): 268-275.
- Fazio N, Spada F, Giovannini M: Chemioterapia nei carcinomi neuroendocrini (NEC) gastroenteropancreatici (GEP): una visione critica. Cancer Treat Rev 2013 maggio; 39(3): 270-274.
- Kwekkeboom DJ, et al.: Trattamento con l’analogo della somatostatina radiomarcato [177 Lu-DOTA 0,Tyr3]octreotate: tossicità, efficacia e sopravvivenza. J Clin Oncol 2008 1 maggio; 26(13): 2124-2130.
- http://telotristat-telestar.com/what-is-the-telestar-trial.php.
- Wolin EM, et al: Studio multicentrico, randomizzato, in cieco, di fase III di pasireotide LAR rispetto a octreotide LAR in pazienti con tumori neuroendocrini metastatici (NET) con sintomi correlati alla malattia non adeguatamente controllati dagli analoghi della somatostatina. J Clin Oncol 2013; 31 (suppl; abstr 4031).
- Arnold R, et al: Linee guida di consenso ENETS per gli standard di cura nei tumori neuroendocrini: follow-up e documentazione. Neuroendocrinologia 2009; 90: 227-233.
InFo Oncologia & Ematologia 2014; 2(5): 14-18