L’identificazione e l’indagine dei biomarcatori molecolari può aiutare a scomporre il complesso fenotipo della dermatite atopica in sotto-fenotipi. Un obiettivo a lungo termine di questa ricerca traslazionale è la stratificazione e la selezione dei pazienti sulla base di biomarcatori diagnostici, prognostici e predittivi, come base per una strategia terapeutica individuale ottimale.
Numerose pubblicazioni recenti affrontano il tema degli approcci di ricerca traslazionale nel contesto della dermatite atopica (AD). Compreso un articolo di revisione pubblicato in Cellular & Molecular Immunology 2023 da Facheris et al. e una recensione di Balato et al. pubblicata su Life 2022 [1,2]. Di seguito è riportato un riassunto di alcuni dei risultati chiave affrontati nel sito [1,2].
Ricerca traslazionale per approcci terapeutici personalizzati
I recenti progressi nella comprensione della patogenesi dell’AD hanno rivoluzionato la ricerca traslazionale e portato a un’espansione esponenziale della pipeline terapeutica [1]. Oltre ai biologici già approvati (Dupilumab, Tralokinumab) e agli inibitori JAK (Baricitinib, Upadacitinib, Abrocitinib), numerosi altri principi attivi innovativi, come biologici e “piccole molecole”, sono attualmente in fase di sviluppo per l’area di indicazione della dermatite atopica. Questi includono lebrikizumab (anti-IL13), nemolizumab (anti-31-R), tezepelumab (anti-TSLP), anti-Ox-40-Ak, nonché brepocitinib (inibitore topico di TYK2/JAK1) e modulatori dei recettori degli idrocarburi arilici [1,2]. Partendo dal presupposto che manifestazioni sintomatologiche e decorso della malattia eterogenei riflettono differenze fondamentali a livello molecolare, in futuro dovrebbe essere possibile identificare sottogruppi di pazienti con diversi sottotipi di malattia e risposte diverse a determinate terapie.
| Progetti di ricerca traslazionale Nel progetto “BIOMAP “* (Biomarkers in Atopic Dermatitis and Psoriasis) [14], si stanno studiando le cause e i meccanismi della DA e della psoriasi, con l’obiettivo di identificare i biomarcatori responsabili delle variazioni nel decorso della malattia. L’obiettivo del progetto “CHAMP“$ (CHildhood Allergy and tolerance: bioMarkers and Predictors) [15] è la ricerca dei determinanti di varie malattie allergiche (allergia alimentare, dermatite atopica, asma, febbre da fieno) dalla nascita all’adolescenza. Si presta particolare attenzione ai fattori che determinano la tolleranza primaria (=assenza di malattie) e la tolleranza acquisita (= remissione delle malattie esistenti). Il progetto di studio identificherà i biomarcatori clinicamente rilevanti che possono essere utilizzati per prevedere l’insorgenza precoce, la progressione e la remissione. |
* Durata: 01.04.2019-31.03.2024 Durata: 2017-2022 |
AD: fisiopatologia multifattoriale con predisposizione genetica
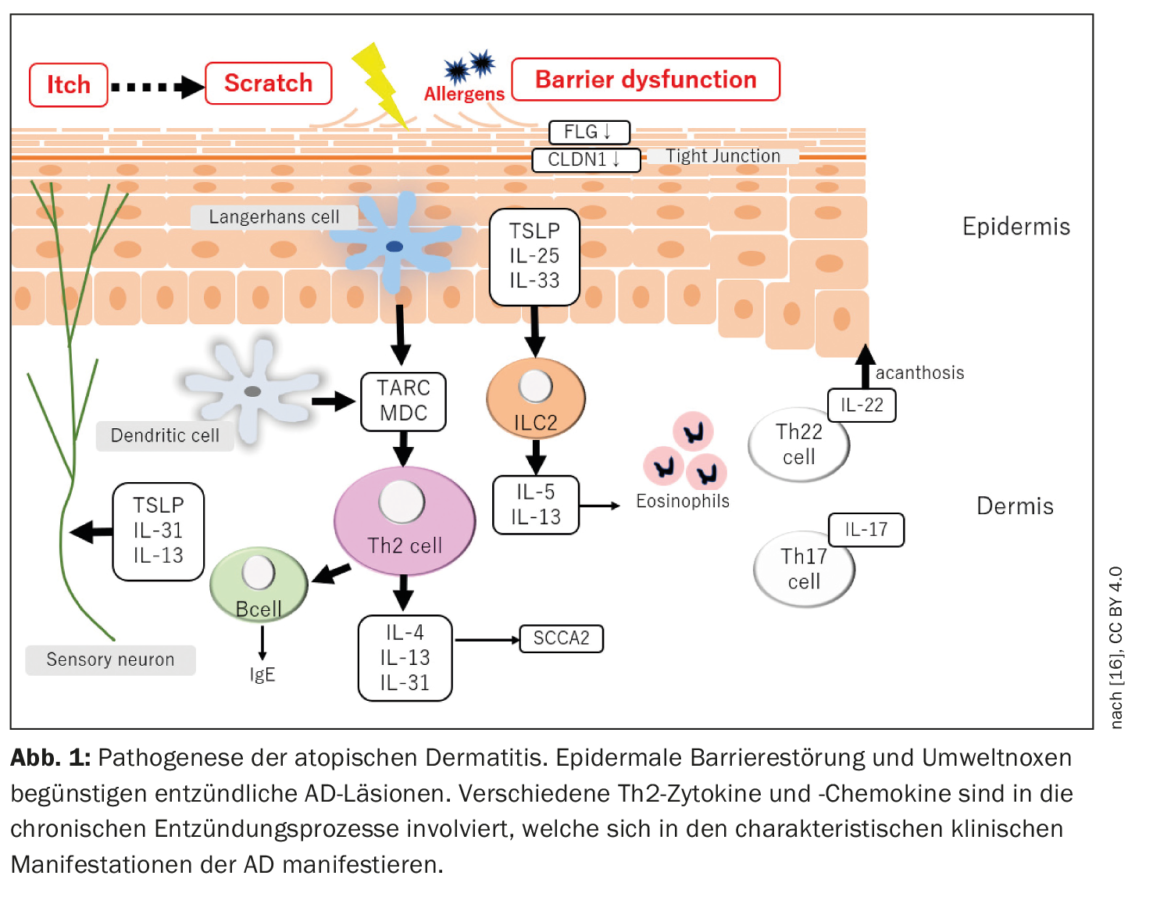
La dermatite atopica è caratterizzata da un decorso cronico recidivante con esordio nella prima infanzia. Le manifestazioni acute sono accompagnate da lesioni cutanee infiammatorie e da un forte prurito, tanto che la qualità di vita dei pazienti è notevolmente compromessa [3]. La fisiopatologia dell’AD è complessa (Fig. 1) : Le interazioni tra la funzione di barriera cutanea compromessa e le risposte immunitarie modificate contribuiscono allo sviluppo e al mantenimento della malattia [2].
È noto che una predisposizione genetica è un prerequisito per lo sviluppo dell’AD. Il fattore di rischio genetico più noto è una mutazione nel gene FLG, che porta a una ridotta espressione della filaggrina nella pelle e a un disturbo della barriera epidermica associato [4]. Oltre a FLG, sono stati identificati più di 30 loci genetici associati all’AD [5,6]. Inoltre, le varianti nel gene IL-13 o nella regione del recettore dell’IL-6, così come diverse varianti rare codificanti proteine, spiegano quasi il 30% della suscettibilità genetica all’AD [7]. L’AD è considerata una malattia mediata da Th2, il che è supportato dai risultati di un aumento dei livelli di mediatori Th2 e di una diminuzione dei livelli di IFN-γ nel sangue dei pazienti con AD grave [1,8]. Diversi studi hanno confermato che le lesioni da AD sono principalmente, ma non esclusivamente, mediate da Th2 e associate alla sovrapproduzione di importanti citochine e chemochine Th2. Tuttavia, sembra essere coinvolto anche l’asse Th22, come risulta da una sovrapproduzione di IL-22, mentre il coinvolgimento degli assi Th1 e Th17 apparentemente varia a seconda dell’endofenotipo di AD [1].
L’identificazione di biomarcatori clinicamente rilevanti rimane una sfida.
I progetti di ricerca di biomarcatori clinicamente rilevanti utilizzano gli ultimi sviluppi tecnici della medicina traslazionale con l’obiettivo a lungo termine di migliorare le opzioni di trattamento e la “gestione della malattia”.
Un criterio per i biomarcatori molecolari è che vengano rilevati e misurati nel sangue, in altri fluidi corporei o nei tessuti e che possano essere utilizzati come indicatori di processi rilevanti per la malattia nell’organismo [9].
Attualmente ci sono almeno 18 biomarcatori ematici/sierici noti associati all’attività della malattia di AD, come i livelli di granulociti eosinofili, la lattato deidrogenasi, le IgE totali o i livelli del recettore IL-2 solubile [10]. Inoltre, diverse chemochine# (CCL17, CCL18, CCL22, CCL26, CCL27) e interleuchine (IL-13, IL-22, IL-24, IL-25, IL-31, IL-33), così come la “Thymic Stromal Lymphopoietint” (TSLP), la periostina e l’antigene-2 del carcinoma a cellule squamose sono considerati biomarcatori nell’AD [10]. CCL18, TSLP e CCL26 sono stati associati all’asma in comorbilità in uno studio danese su bambini affetti da AD [11]. I ricercatori hanno studiato quattro gruppi di bambini di 6-12 anni: (1) AD passata o presente senza asma, (2) AD passata o presente e asma attuale, (3) asma attuale senza AD. (4) controlli sani. È stato condotto uno studio clinico esplorativo per indagare quali biomarcatori sono associati alla risposta al trattamento con l’inibizione del recettore IL-4-α da parte dell’anticorpo monoclonale dupilumab nell’AD da moderata a grave. È stato dimostrato che il dupilumab riduce l’aumento dell’espressione delle firme Th2 come IL-13, IL-31, CCL17, CCL18, CCL22 e CCL26 nel sangue e nella pelle lesionata dell’AD [12,13]. Balato et al. indicano che sono necessari ulteriori studi per scoprire di più sulle possibili associazioni di questi biomarcatori con la malattia e gli esiti del trattamento nell’AD [2].
# Le chemochine sono un sottogruppo delle citochine; sono proteine piccole (8-10 kDa), attive dal punto di vista chemiotattico (proteine di segnalazione).
Letteratura:
- Facheris P, et al: La rivoluzione traslazionale nella dermatite atopica: il cambio di paradigma dalla patogenesi al trattamento. Cellula Mol Immunol 2023,
https://doi.org/10.1038/s41423-023-00992-4,(ultimo accesso 24.02.2023). - Balato A, et al: L’impatto della psoriasi e della dermatite atopica sulla qualità della vita: una ricerca di letteratura sui biomarcatori. Vita. 2022; 12(12): 2026.
- Arima K, et al: Carico della dermatite atopica negli adulti giapponesi: analisi dei dati del National Health and Wellness Survey 2013. J Dermatol 2018; 45, 390-396.
- Irvine AD, et al: Mutazioni della filaggrina associate a malattie cutanee e allergiche. N Engl J Med 2011; 365: 1315-1327.
- Ellinghaus D, et al.: Uno studio di genotipizzazione ad alta densità identifica quattro nuovi loci di suscettibilità per la dermatite atopica. Nat Genet 2013; 45: 808-812.
- Løset M, et al: Genetica della dermatite atopica: dalla sequenza del DNA alla rilevanza clinica. Dermatologia 2019; 235: 355-364.
- Mucha S, et al.: Le varianti di codifica delle proteine contribuiscono al rischio di dermatite atopica e all’espressione genica specifica della pelle. J Allergy Clin Immunol 2020, 145, 1208-1218.
- Gittler JK, et al: L’attivazione progressiva delle citochine T(H)2/T(H)22 e delle proteine epidermiche selettive caratterizza la dermatite atopica acuta e cronica. J Allergy Clin Immunol 2012; 130: 1344-1354.
- Agenzia Europea dei Medicinali (EMA). Qualificazione di nuove metodologie per lo sviluppo di farmaci. Regolatore umano. Ricerca e sviluppo. Pareri e lettere di sostegno sulla qualificazione di nuove metodologie per lo sviluppo di farmaci. Disponibile online: www.ema.europa.eu/en/glossary/biomarker,(ultimo accesso 24.03.2023).
- Nakahara T, et al: Esplorazione dei biomarcatori per prevedere il miglioramento clinico della dermatite atopica nei pazienti trattati con dupilumab: un protocollo di studio. Medicina 2020; 99: e22043.
- Basu MN, et al: Biomarcatori nell’asma nel contesto della dermatite atopica nei bambini piccoli. Pediatr Allergy Immunol 2022; 33: e13823.
- Guttman-Yassky E, et al: Dupilumab migliora progressivamente le anomalie sistemiche e cutanee nei pazienti con dermatite atopica. J Allergy Clin Immunol 2019; 143: 155-172.
- Hamilton JD, et al: Dupilumab migliora la firma molecolare nella pelle dei pazienti con dermatite atopica da moderata a grave. J Allergy Clin Immunol 2014; 134: 1293-1300.
- Medicina di precisione nell’infiammazione cronica, www.precisionmedicine.de/fileadmin/user_upload/cluster/pmi/downloads/PMI-Magazin2021_digital_Doppelseiten.pdf,(ultimo accesso 24.03.2023)
- BMFB: CHAMP – Allergy and Tolerance in Childhood: Biomarkers and Predictors, www.gesundheitsforschung-bmbf.de/de/champ-allergie-und-toleranz-im-kindesalter-biomarker-und-pradiktoren-7268.php,(ultimo accesso 24.03.2023)
- Itamura M, Sawada Y: Coinvolgimento della dermatite atopica nello sviluppo di malattie infiammatorie sistemiche. Giornale Internazionale di Scienze Molecolari. 2022; 23(21): 13445, www.mdpi.com/1422-0067/23/21/13445,(ultimo accesso 23.03.2023).
PRATICA DERMATOLOGICA 2023; 33(2): 28-29