Il Clostridium difficile è una causa comune di diarrea e colite associata agli antibiotici. L’incidenza è in aumento. Le forme ricorrenti della malattia, in particolare, comportano un elevato “carico di malattia”.
Secondo i dati epidemiologici pubblicati nel 2017, i ceppi tossigeni di Clostridium difficile (C.difficile) sono presenti fino al 15,5% dei pazienti ospedalizzati, con un tasso di mortalità compreso tra il 3% e il 14% [2]. Nel 10-20% dei casi di diarrea associata agli antibiotici, si tratta di diarrea associata alla C. difficile . La comparsa dei sintomi è tipica da ore a settimane dopo il trattamento antibiotico; la prevalenza varia a seconda del principio attivo utilizzato (ampicillina 5-10%; amoxicillina-acido clavulanico 10-25%; cefixime 15-20%; altri come cefalosporine, fluorochinoloni, macrolidi, tetraciclina 2-5%), ha detto il relatore [3]. Il rischio di recidiva dopo un primo episodio trattato con successo è di circa il 20% e aumenta al 40-60% dopo il secondo episodio, spiega il Prof. Ansgar W. Lohse, MD, Direttore della Clinica e Specialista in Medicina Interna e Gastroenterologia, University Medical Center Hamburg-Eppendorf [1,3].
Diagnostica: cosa raccomandano le linee guida attuali?
Secondo il Professor Lohse, le caratteristiche cliniche classiche di un’infezione da C.difficile (CDI) sono le seguenti: diarrea acquosa (raramente sanguinolenta), febbre (28%), dolore addominale (22%), ileo, megacolon tossico, perforazione intestinale, sepsi [3]. Per il work-up diagnostico, i seguenti fattori di rischio possono essere indicativi di una possibile CDI come diagnosi provvisoria in caso di sintomi corrispondenti: terapia antibiotica (cefalosporine, chinoloni, clindamicina, acido clavulanico); inibitori della pompa protonica; immunosoppressione; età>65 anni; colonizzazione con C. difficile (0-3% nelle persone non ospedalizzate; 20-40% nei pazienti ospedalizzati; malattia infiammatoria cronica intestinale [2–4].
Secondo la linea guida S2k, il C. difficile gastrointestinale e i norovirus sono possibili cause di gastroenterite nosocomiale; altri patogeni sono irrilevanti e non devono essere testati, ha spiegato il relatore. Come misura precauzionale, i pazienti devono essere isolati dai contatti fino a 48 ore dopo la comparsa dei sintomi clinici, se si sospetta una gastroenterite infettiva (vedere riquadro) [3,5]. Il relatore ha aggiunto che 48 ore dopo la fine dei sintomi, è possibile eseguire il de-isolamento senza ripetere il test [3].

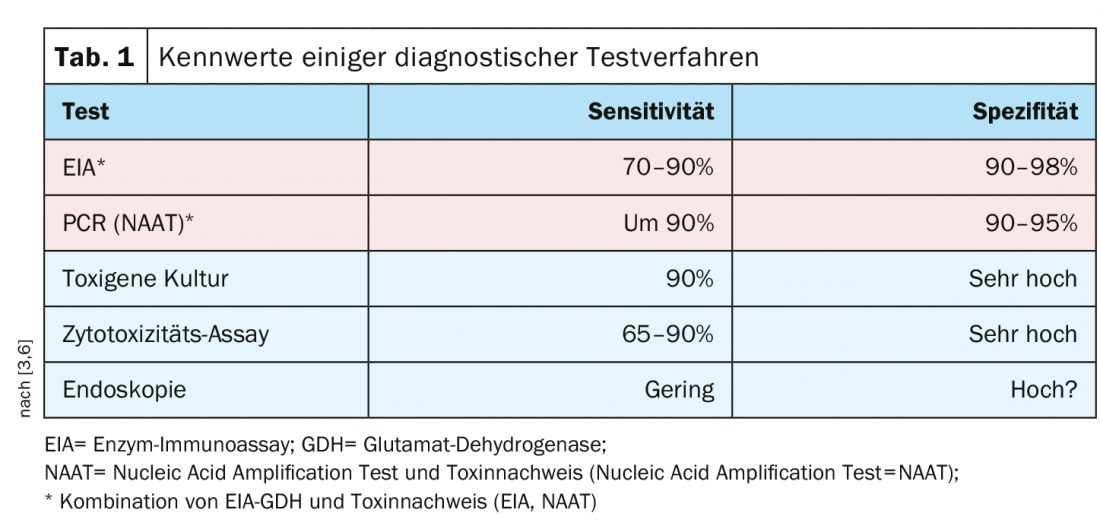
Esistono diversi metodi di analisi con un’elevata sensibilità e specificità, per cui si raccomanda una combinazione di immunodosaggio enzimatico/glutammato deidrogenasi (EIA-GDH) e rilevamento della tossina (immunodosaggio enzimatico=EIA; test di amplificazione degli acidi nucleici=NAAT) ( Tab. 1).
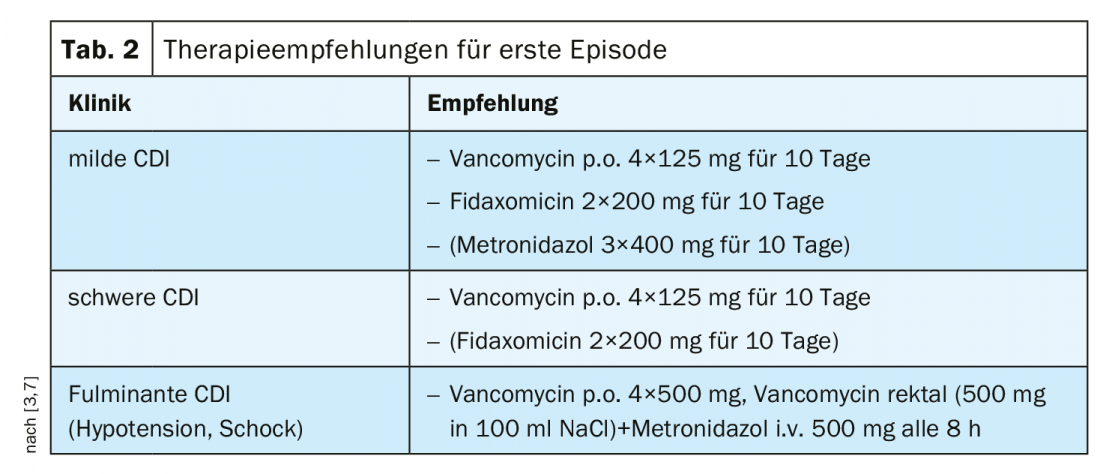
La vancomicina è ora considerata la terapia di prima linea
In precedenza, il metronidazolo era stato raccomandato per la CDI da lieve a moderata come trattamento economicamente vantaggioso [1]. La vancomicina è stata utilizzata nei casi di intolleranza al metronidazolo e/o di aumento del rischio di recidiva [1]. In base ai risultati degli studi pertinenti, la raccomandazione secondo le linee guida IDSA/SHEA 2018 è stata adattata in base alla gravità della CDI [1]. Secondo le attuali raccomandazioni di consenso, la vancomicina è considerata la terapia di prima linea per i gradi lievi e gravi di CDI. (Tab. 2). Nei casi di CDI lieve e di rischio di recidiva, si può utilizzare la fidaxomicina; contrariamente alle valutazioni precedenti, l’uso del metronidazolo dovrebbe essere limitato ai casi di mancanza di disponibilità o di intolleranza agli altri due agenti [7]. Nelle forme gravi e nei decorsi complicati di CDI, la vancomicina deve essere sempre utilizzata come trattamento di prima linea [3]. I predittori di CDI grave, secondo la linea guida S2k, sono mostrati nella panoramica 1. La vancomicina o la fidaxomicina possono essere utilizzate per il trattamento della CDI ricorrente [3,7] (Tab. 3).

La profilassi delle ricadute è molto importante
I dati mostrano che anche dopo un trattamento di successo con sollievo dai sintomi, una percentuale significativa di pazienti ha una ricaduta e il rischio di ricaduta aumenta ad ogni ricaduta [8]. Il criterio temporale per una ricaduta è una nuova comparsa di sintomi nel periodo compreso tra almeno due settimane e al massimo due mesi dopo il miglioramento dei sintomi iniziali (nuova infezione o reinfezione), secondo il relatore [3].

Nei due studi randomizzati controllati con placebo MODIFY I e MODIFY II, la somministrazione concomitante di una dose singola di bezlotoxumab (10 mg per chilogrammo di peso corporeo) durante la terapia standard (vancomicina, metronidazolo o fidaxomicina) per C. difficile ha comportato una riduzione del 38% del tasso di recidiva entro 12 settimane [9].
In Svizzera, il bezlotoxumab, un anticorpo monoclonale con elevata affinità per la tossina B del C. difficile, è stato approvato dalla fine del 2017 per la prevenzione delle recidive di Clostridioides difficile. Il bezlotoxumab è diretto contro la tossina B della C. difficile. Un’altra opzione per la profilassi delle ricadute con un alto tasso di successo è il trasferimento del microbioma fecale (FMT) [2,3,12].

Stanno emergendo ricerche sulle strategie preventive, come l’uso di probiotici, la manipolazione del microbioma intestinale durante il trattamento antibiotico, la vaccinazione e i nuovi antibiotici che riducono l’impatto negativo sul microbioma intestinale [1]. Per quanto riguarda l’opzione vaccinale, uno studio di fase III è ancora in fase di reclutamento fino al 2020 [3,13].
Fonte: DGIM, Wiesbaden (D)
Letteratura:
- Dieterle MG, Rao K, Young VB: Nuove terapie e strategie preventive per le infezioni primarie e ricorrenti da Clostridium difficile. Numero speciale: Antimicrobial Therapeutics Reviews 2019; 1435 (1): 110-138.
- Solbach P, Dersch P, Bachmann O: Strategie di trattamento individualizzate per le infezioni da Clostridium difficile [Article in German]. Internist (Berl) 2017; 58(7): 675-681. doi: 10.1007/s00108-017-0268-2.
- Lohse A: Presentazione diapositiva, DGIM 2019, 05.05.2019, Addome acuto: Unità 1: C. diff. Colite, Prof. Dr. med. A. Lohse, Direttore della clinica, Specialista in Medicina Interna e Gastroenterologia, Centro Medico Universitario Hamburg-Eppendorf.
- Gould LH, Limbago B: Clostridium difficile negli alimenti e negli animali domestici: un nuovo patogeno di origine alimentare. Clin Infect Dis 2010; 51(5): 577-582. doi: 10.1086/655692.
- AWMF: Infezioni gastrointestinali e malattia di Whipple, linea guida S2k 2015, AWMF online. Il portale di medicina scientifica, numero di registro 021-024, al 31.01.2015, valido fino al 30.01.2020. www.awmf.org/leitlinien/detail/ll/021-024.html, ultimo accesso 15 maggio 2019.
- Manthey CF, Eckmann L, Fuhrmann C: Terapia per l’infezione da Clostridium difficile – qualche novità oltre a Metronidazolo e Vancomicina? Expert Review of Clinical Pharmacology 2017; 10 (11). www.tandfonline.com, ultimo accesso 15 maggio 2019.
- McDonald LC, et al: Linee guida di pratica clinica per l’infezione da Clostridium difficile negli adulti e nei bambini: aggiornamento 2017 della Infectious Diseases Society of America (IDSA) e della Society for Healthcare Epidemiology of America (SHEA). Clin. Infect Dis 1018; 66: e1-e48.
- Deshpande A, et al: Fattori di rischio per le infezioni ricorrenti da Clostridium difficile: una revisione sistematica e una meta-analisi. Infect Control Hosp Epidemiol 2015; 36: 452-460.
- Wilcox MH, et al: Bezlotoxumab per la prevenzione delle infezioni ricorrenti da Clostridium difficile. N Engl J Med 2017; 376(4): 305-317.
- Curry SR, et al: Alta frequenza di resistenza alla rifampicina identificata in un clone epidemico di Clostridium difficile proveniente da un grande ospedale universitario. Clin Infect Dis 2009; 48: 425-429.
- Muller L, Halfmann A, Herrmann M: [Current data and trends on the development of antibiotic resistance of Clostridium difficile]. Bundesgesundheitsblatt Ricerca sulla salute Protezione della salute 2012; 55: 1410-1417.
- Van Nood, E: Infusione duodenale di feci di donatori per il Clostridium difficile ricorrente. NEJM 2013; 368(5): 407-415.
- Pfizer Inc: Studio sull’efficacia del vaccino contro il clostridium difficile: NCT03090191. www.pfizer.com/science/find-a-trial/nct03090191, ultimo accesso 15 maggio 2019.
HAUSARZT PRAXIS 2019; 14(6): 32-33 (pubblicato il 24.5.19, prima della stampa).